用于卵巢癌化疗-光热联合治疗的吉西他滨/聚吡咯复合纳米粒子
刘树威,晋 皓,尹万忠,张 皓
(1.吉林大学第一医院光功能诊疗医学化学联合实验室,长春 130021;2.吉林大学白求恩第一医院耳鼻咽喉头颈外科,长春 130021)
卵巢癌是女性生殖系统常见的恶性肿瘤之一[1]. 其中,上皮性卵巢癌的死亡率占据各类妇科肿瘤的首位[2]. 卵巢癌早期无明显临床症状,难以发现,并且容易浸润和转移,对女性生命健康造成了严重威胁[3]. 目前的临床治疗中,手术辅以术后化疗是上皮性卵巢癌的标准治疗方案[4].
化疗是化学药物治疗的简称,是利用化学药物阻止癌细胞的增殖、浸润及转移,并杀灭癌细胞的一种治疗方式,是当前癌症治疗的重要手段[5,6]. 以对卵巢癌有较好疗效的嘧啶类抗肿瘤药物吉西他滨为例,其作用机制主要包括两方面:一是作用于细胞的有丝分裂,阻止G1期向S期的进展;二是抑制核苷酸还原酶,导致细胞内脱氧核苷三磷酸酯减少,降低细胞内代谢产物的降解,进而达到抗肿瘤的目的[7]. 但化疗也存在明显的缺点,在对晚期肿瘤和已扩散肿瘤的全身化疗中,吉西他滨的副作用十分明显,主要是骨髓抑制、血小板减少、白细胞下降,也可引起便秘、腹泻、口腔炎等消化系统的反应,还可以引起发烧、头痛、乏力及厌食,甚至会导致肝肾等主要器官的损伤[8]. 此外,长期化疗诱发的多药耐药会严重降低化疗效果. 通过调整化疗药物种类、提高给药剂量和给药频率等来克服多药耐药的方法不仅不能保证疗效,还极容易加剧对正常组织的毒性[9,10]. 因此,提高化疗药物的生物利用率、降低对正常组织的毒副作用具有重要的研究意义.
纳米材料能够通过高渗透长滞留(EPR)效应向肿瘤中富集,使用纳米载体对化疗药物进行负载,就能实现化疗药物的高效递送;再利用纳米载体在肿瘤微环境过表达的某些物质或外界刺激下的形貌或结构变化,实现化疗药物的可控释放,是解决上述问题的新思路[11,12]. 理想的纳米载体需要具备以下几个条件:无毒或低毒、高药物负载率、较高的稳定性和药物的可控释放等[13]. 这对纳米载体的设计提出了更高的要求,尤其是需要载体本身兼具某些诊疗功能. 例如,以聚苯胺、聚多巴胺、聚吡咯等为主体的聚合物纳米载体具有优良的光热转化性能,能够将所吸收的近红外光转化为热能,起到肿瘤光热治疗的作用[14~16]. 此外,光热效应还能够促进化疗药物的释放、激发机体免疫等,为发展光热介导下的肿瘤治疗新方法提供了机会[17~19].
基于上述背景,本文设计了一种负载化疗药物吉西他滨的聚吡咯纳米粒子,该纳米粒子具有化疗/光热联合治疗上皮性卵巢癌的功效. 通过铁离子诱发的氧化聚合,吡咯单体聚合生成聚吡咯纳米粒子,其生物毒性极低[20,21]. 聚吡咯纳米粒子对吉西他滨具有较强的负载能力,载药率为13.7%,包封率为15.9%,药物负载前后纳米粒子均具有良好的胶体稳定性,不会出现聚沉等现象. 在波长808 nm的近红外激光照射下,吉西他滨/聚吡咯复合纳米粒子溶液快速升温. 因癌细胞的热耐受性差,当体系温度升至42 ℃以上时,就产生了光热治疗的作用. 同时,热刺激导致吉西他滨在肿瘤组织中快速释放,产生光热介导的化疗作用,避免了全身毒性. 在卵巢癌动物模型治疗实验中,吉西他滨/聚吡咯复合纳米粒子展现了良好的联合治疗潜力.
1 实验部分
1.1 试剂与仪器
吡咯,99%,国药集团化学试剂有限公司;六水合三氯化铁,98%,阿拉丁试剂(上海)有限公司;透析袋,截留分子量5000,湖南翊博生物科技有限公司;碳支持膜铜网(T11023型,300目),北京新兴百瑞技术有限公司;DMEM 培养基(高糖),美国Gibco 公司;结晶紫染色液和磷酸盐(PBS)缓冲液(pH值为7.2~7.4),上海碧云天生物技术有限公司;胎牛血清(特级),美国Gemini 公司;盐酸吉西他滨(标准品)、CCK-8 试剂盒和胰蛋白酶消化液(质量分数0.25%),北京索莱宝科技有限公司;裸鼠Balb/c-nu,北京维通利华实验动物技术有限公司.
H-800 型透射电子显微镜(TEM),日本Hitachi 公司;Empyrean 型X 射线衍射仪(XRD),荷兰PANalytical 公司;ESCALAB 250 型X 射线光电子能谱仪(XPS),美国Thermo 公司;Zetasizer NanoZS 型纳米粒度仪,英国Malvern 公司;UV-2600 型紫外-可见-近红外(UV-Vis-NIR)分光光度计,日本Shimadzu公司;LEO-808型光纤激光器,深圳理欧光电科技有限公司;PYXE-80IR型孵箱,青岛海尔生物医疗股份有限公司;RT-6000型酶标仪,深圳雷杜生命科学股份有限公司;EOS M50型数码相机,日本Canon公司;Ti27型红外热像仪,美国Fluke公司.
1.2 实验过程
1.2.1 聚吡咯纳米粒子的制备与表征 预先配制浓度为1 mmol/L的吡咯水溶液和浓度为100 mmol/L的六水合三氯化铁水溶液. 将100 mL 吡咯水溶液转移至锥形瓶并置于冰水浴中,在磁力搅拌下(400 r/min)加入1 mL 六水合三氯化铁水溶液;在冰水浴中继续搅拌12 h,得到聚吡咯纳米粒子;将该纳米粒子溶液置于透析袋内,并浸于去离子水中透析24 h,每4 h换一次水,除去未反应的吡咯单体和六水合三氯化铁,透析袋内的产物即为提纯后的聚吡咯纳米粒子.
将聚吡咯纳米粒子水溶液滴在碳支持膜铜网上,通过透射电子显微镜观察产物的形貌. 测定聚吡咯纳米粒子水溶液的浓度. 通过冻干得到聚吡咯纳米粒子粉末,进行XRD和XPS测试. 配制聚吡咯纳米粒子稀溶液,进行Zeta电势测试.
1.2.2 吉西他滨/聚吡咯复合纳米粒子的制备与表征 预先配制浓度为2 mg/mL的聚吡咯纳米粒子水溶液和浓度为2 mg/mL 的盐酸吉西他滨水溶液. 将5 mL聚吡咯纳米粒子水溶液与5 mL盐酸吉西他滨水溶液混合,在室温下搅拌24 h;离心后收集沉淀,得到吉西他滨/聚吡咯复合纳米粒子. 测定不同浓度(2.5,5,7.5,10,15和20 μg/mL)的盐酸吉西他滨水溶液的UV吸收光谱,绘制紫外吸收值对吉西他滨浓度的标准曲线,根据离心后上清液的紫外吸收值,计算吉西他滨的载药率和包封率.
将吉西他滨/聚吡咯复合纳米粒子水溶液滴在碳支持膜铜网上,通过透射电子显微镜观察产物的形貌. 利用分光光度计测定产物在近红外光区的吸收. 测定吉西他滨/聚吡咯复合纳米粒子水溶液的浓度.
1.2.3 吉西他滨/聚吡咯复合纳米粒子的光热性能 配制6 mL浓度为100 μg/mL的吉西他滨/聚吡咯复合纳米粒子水溶液,并平均分为3 组,施加15 min 功率密度分别为1,2 和3 W/cm2的808 nm 近红外激光,通过热电偶温度计监测复合纳米粒子水溶液的温度变化. 配制6 mL浓度为200 μg/mL的吉西他滨/聚吡咯复合纳米粒子水溶液,以相同的实验方法,通过热电偶温度计监测复合纳米粒子水溶液的温度变化. 配制2 mL浓度为100 μg/mL的吉西他滨/聚吡咯复合纳米粒子水溶液,施加功率密度为3 W/cm2的808 nm近红外激光,当溶液温度不再升高后停止激光照射,通过热电偶温度计监测复合纳米粒子水溶液升温和降温过程中的温度变化,计算光热转化效率.
1.2.4 升温导致的药物释放 配制浓度为100 μg/mL的吉西他滨/聚吡咯复合纳米粒子水溶液,并平均分为两组;一组在45 min和105 min时分别施加15 min功率密度为3 W/cm2的808 nm近红外激光,另一组不施加近红外激光;在1 h和2 h后分别测定两组溶液中吉西他滨的释放率.
1.2.5 吉西他滨/聚吡咯复合纳米粒子对卵巢癌细胞的治疗效果 以人肠系膜下腔动脉血管内皮细胞(Ealy926)作为正常细胞研究对象,以人上皮性卵巢癌细胞(A2780)作为卵巢癌细胞研究对象. 将Ealy926 细胞以5×103cell/孔的密度接种在96 孔板中,置于孵箱中培养[37 ℃,5%(体积分数)CO2].24 h后,与浓度分别为0,25,50,100,150和200 μg/mL的吉西他滨/聚吡咯复合纳米粒子共培养. 24 h后,向每孔中分别加入10 μL CCK-8溶液,继续孵育2 h后,使用酶标仪测试450 nm处的光密度值,进而计算Ealy926细胞的相对存活率,考察吉西他滨/聚吡咯复合纳米粒子对正常细胞的毒性. 以相同的实验方法考察吉西他滨/聚吡咯复合纳米粒子对人卵巢癌细胞(A2780)的毒性.
将A2780 细胞以5×103cell/孔的密度接种在96 孔板中,置于孵箱中培养[37 ℃,5%(体积分数)CO2]. 24 h后,与浓度为100 μg/mL的吉西他滨/聚吡咯复合纳米粒子共培养. 2 h后,施加15 min功率密度分别为0,1,2和3 W/cm2的808 nm近红外激光. 24 h后,以CCK-8染色法测试并计算A2780细胞的相对存活率,考察吉西他滨/聚吡咯复合纳米粒子的治疗效果.
将A2780 细胞以2×105cell/孔的密度接种在6 孔板中,置于孵箱中培养[37 ℃,5%(体积分数)CO2]. 24 h 后,与浓度分别为0,50,100 和200 μg/mL 的吉西他滨/聚吡咯复合纳米粒子共培养. 2 h后,施加15 min功率密度为3 W/cm2的808 nm近红外激光. 孵育2 h后,将各组中的细胞消化计数,再以500 cell/孔的密度接种在新的6孔板中,置于孵箱中继续培养[37 ℃,5%(体积分数)CO2]. 待孔板中出现含有50个以上细胞的细胞集落时,终止培养,弃去培养液. 用PBS洗涤2次,向每孔中加入1 mL质量分数为4%的多聚甲醛,于4 ℃冰箱中固定细胞1 h,用PBS洗涤一次,再向每孔中加入1 mL结晶紫染液,用去离子水洗涤3次,晾干后使用数码相机进行拍照,并在显微镜下统计细胞集落的相对数目,考察吉西他滨/聚吡咯复合纳米粒子的治疗效果.
1.2.6 吉西他滨/聚吡咯复合纳米粒子在动物肿瘤模型中的升温能力 本文所涉及动物实验方案通过了吉林大学第一医院动物伦理委员会的审查,所有实验均严格按照操作规范进行. 将1×106个A2780细胞分散在无血清的DMEM高糖培养基中获得细胞悬液,皮下注射至裸鼠右后臀部,待肿瘤体积生长至200 mm3左右时,将200 μg吉西他滨/聚吡咯复合纳米粒子分散于40 μL生理盐水中,经尾静脉注射至裸鼠体内. 24 h后,向肿瘤部位施加功率密度为1 W/cm2的近红外激光,通过红外热像仪监测肿瘤温度随时间的变化.
2 结果与讨论
2.1 聚吡咯纳米粒子的制备和表征
图1(A)为聚吡咯纳米粒子的TEM 照片. 聚吡咯纳米粒子展现了尺寸均一的球形形貌,平均直径约为59.6 nm. 图1(B)为聚吡咯纳米粒子的XRD谱图. 聚吡咯纳米粒子的结晶性很差,谱图中没有高强度的特征峰,在32°和37°左右的低强度特征峰来自纳米粒子中掺杂的少量铁复合物. 图1(C)为聚吡咯纳米粒子的XPS谱图. 根据谱图中特征峰所在位置对应的结合能数值可知,纳米粒子中存在铁和氮的配位,所以铁复合物的存在形式为铁离子掺杂的聚吡咯. 铁离子的掺杂通常会引起纳米粒子Zeta电势的升高,然而,图1(D)中的Zeta电势测试结果显示聚吡咯纳米粒子表面电势为1.64 mV,仅带少量的正电,这说明铁离子的掺杂量较低,对Zeta电势的影响较小.

Fig.1 TEM image(A),XRD pattern(B),XPS Fe2p spectrum(C)and zeta potential(D)of polypyrrole NPs
2.2 吉西他滨/聚吡咯复合纳米粒子的制备和表征
在制备的聚吡咯纳米粒子中进一步负载化疗药物吉西他滨,能够得到吉西他滨/聚吡咯复合纳米粒子. 图2(A)给出了吉西他滨/聚吡咯复合纳米粒子的TEM照片,其形貌和尺寸与药物负载前基本保持一致,说明吉西他滨的负载并不会对复合纳米粒子的形貌和尺寸产生影响. 图2(B)给出了吉西他滨/聚吡咯复合纳米粒子的可见-近红外吸收光谱,其在808 nm处具有较强的吸收,表明复合纳米粒子具有吸收近红外光的能力,具有应用于光热治疗和光热促进药物释放的潜力.

Fig.2 TEM image(A)and Vis⁃NIR absorption spectrum(B)of gemcitabine/polypyrrole composite NPs
图3 (A)给出了不同浓度的盐酸吉西他滨水溶液的紫外吸收光谱. 选取268.5 nm 处的吸光度值,绘制出的盐酸吉西他滨吸光度值对浓度的标准曲线如图3(B)所示. 通过测试载药后上清液的吸光度值,计算得到上清液中盐酸吉西他滨的浓度为0.841 mg/mL,进而计算得到吉西他滨/聚吡咯复合纳米粒子中吉西他滨的载药率为13.7%,包封率为15.9%. 可见,聚吡咯纳米粒子对吉西他滨具有较强的负载能力.
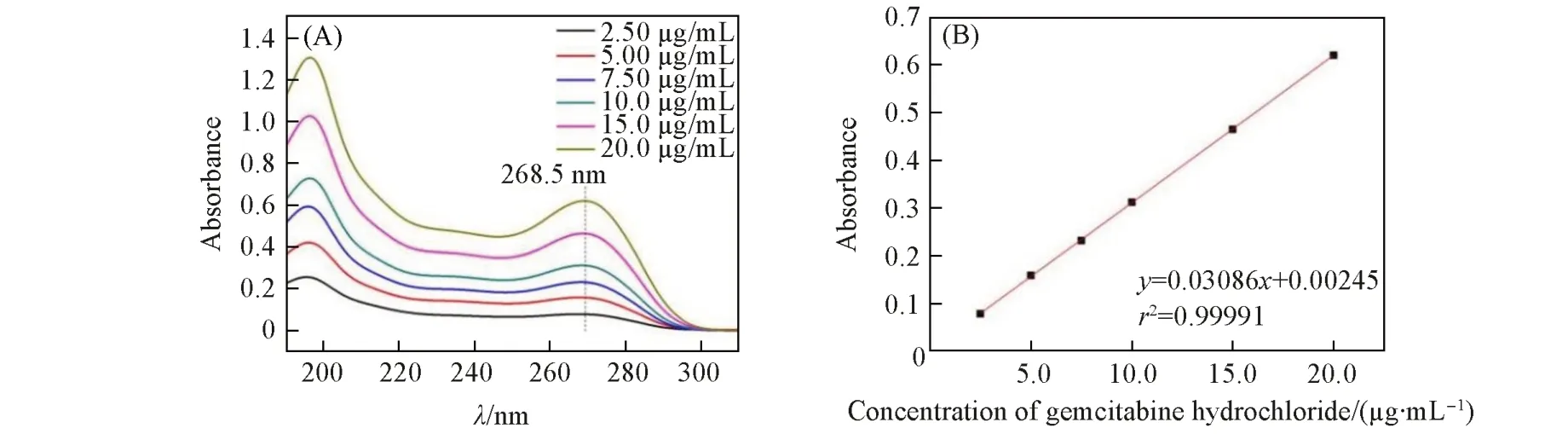
Fig.3 UV absorption spectra of gemcitabine hydrochloride at the concentrations of 2.5, 5, 7.5, 10, 15 and 20 μg/mL(A)and the standard absorption curve of gemcitabine versus concentration(B)
2.3 吉西他滨/聚吡咯复合纳米粒子的光热性能

Fig.4 Temperature increment of gemcitabine/polypyrrole composite NPs solutions by altering the laser power density at 100 μg/mL(A)and 200 μg/mL(B)
因为吉西他滨/聚吡咯复合纳米粒子在近红外光区具有较强吸收,本文进一步研究了其在808 nm激光照射下的光热性能. 图4(A)和(B)给出了复合纳米粒子溶液的温度随照射时间变化的曲线. 随着光照时间的延长,溶液温度逐渐升高. 当固定浓度不变时,复合纳米粒子溶液的温度随着激光功率的增加而升高,光热转化性能良好.
图5给出3 W/cm2的激光功率密度下,浓度为100 μg/mL的复合纳米粒子溶液的升温-降温曲线. 由图5可以看出,在近红外激光照射下,溶液的升温能力很强. 以图5中降温过程的前20个点为研究对象,以时间为纵坐标,温度增量与最大温度增量比值的负对数(-lnθ)为横坐标,得到图6. 由拟合得到直线的斜率确定时间常数为344.3 s,进而计算得到吉西他滨/聚吡咯复合纳米粒子的光热转化效率为35.3%. 上述结果表明该复合纳米粒子是一种良好的光热试剂,能够发挥光热治疗的作用.

Fig.5 Real⁃time temperature of a heating⁃cooling cycle of gemcitabine/polypyrrole composite NPs solutionConcentration of composite NPs: 100 μg/mL; laser power density:3 W/cm2.

Fig.6 Time vs. -lnθ fitting plot of the cooling process of Fig.5
2.4 吉西他滨/聚吡咯复合纳米粒子的药物释放
考察了吉西他滨/聚吡咯复合纳米粒子中负载的吉西他滨的释放. 在不同实验处理后的不同时间点将复合纳米粒子溶液离心,测试上清液在268.5 nm处的吸光度值,利用图3(B)中给出的标准曲线计算得到药物的释放率. 在不施加808 nm激光的条件下,1 h后吉西他滨的释放率为6.0%,2 h后增加到了9.3%. 近红外激光能够明显加速吉西他滨的释放,1 h后的释放率就已经高达24.2%,2 h后增加到52.7%. 这表明808 nm的激光照射能够极大促进吉西他滨释放,从而发挥更好的化疗作用.
2.5 吉西他滨/聚吡咯复合纳米粒子协同治疗卵巢癌
由图7(A)可见,吉西他滨/聚吡咯复合纳米粒子对正常细胞Ealy926的毒性很低. 一方面,这说明吉西他滨在聚吡咯纳米粒子中的负载比较稳定,不易脱落,对降低化疗药物的毒副作用、提高利用率具有重要意义;另一方面,这也说明复合纳米粒子本身具有较好的生物安全性. 图7(B)示出了吉西他滨/聚吡咯复合纳米粒子对卵巢癌细胞A2780的毒性,细胞存活率受到的影响较小,说明复合纳米粒子本身并不具有杀伤癌细胞的能力.

Fig.7 Relative cell viability of Ealy926 cells(A) and A2780 cells(B) after 24 h incubation with different concentrations of gemcitabine/polypyrrole composite NPs
图8 示出了808 nm 激光照射下吉西他滨/聚吡咯复合纳米粒子对A2780 细胞的联合治疗效果. 可见,光热治疗和热刺激的化疗药物释放可以大幅度杀伤卵巢癌细胞,随着激光功率密度的增加,A2780细胞的存活率逐渐降低.
图9 为克隆形成实验结果. 结晶紫染色照片及定量统计结果显示,单纯的808 nm激光照射不能引起溶液的明显升温,对A2780 细胞的增殖能力影响极低. 而吉西他滨/聚吡咯复合纳米粒子在近红外光下的联合治疗作用能够对细胞的增殖能力产生影响. 随着复合纳米粒子浓度的升高,A2780 细胞的增殖能力逐渐降低. 与浓度为200 μg/mL 的吉西他滨/聚吡咯复合纳米粒子共培养,又经过15 min功率密度为3 W/cm2的808 nm激光照射后,A2780细胞的增殖能力受到了极大的破坏,光热治疗/化疗的联合治疗效果显著.

Fig.8 Relative cell viability of A2780 cells after the treatment with 100 μg/mL gemcitabine/poly⁃pyrrole composite NPs and 808 nm laser of different power density**P<0.01,***P<0.001.

Fig.9 Crystal violet stained A2780 cells after the treatment with gemcitabine/polypyrrole composite NPs of different concentrations and 808 nm laser of 3 W/cm2(A—D) and the relative number of cell colony obtained by statistics(E)Concentration of composite NPs/(μg·mL-1):(A)0;(B)50;(C)100;(D)200.
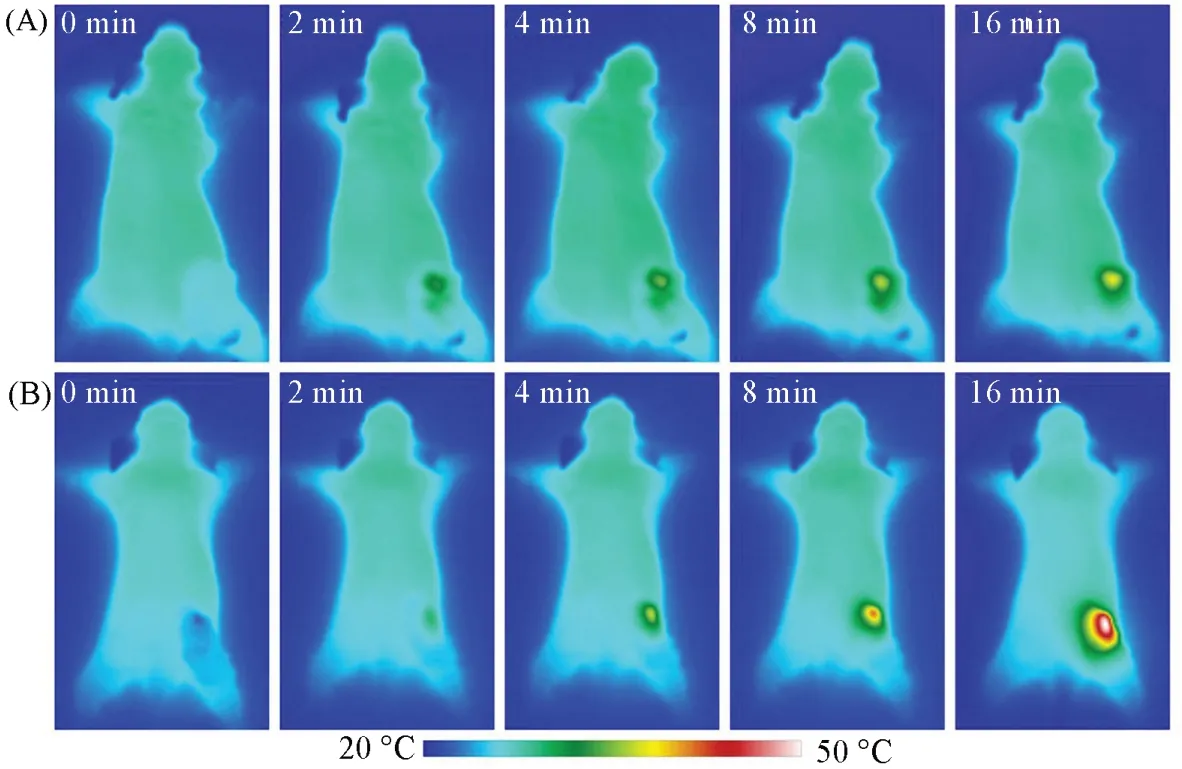
Fig.10 Infrared thermal images of the mice treated with saline(A)and gemcitabine/polypyrrole composite NPs(B)under the irradiation of 808 nm laser at the power density of 1 W/cm2 after 0,2,4,8 and 16 min
进一步评估了吉西他滨/聚吡咯复合纳米粒子在动物体内的联合治疗潜力. 由图10(A)可见,作为对照组,尾静脉注射了生理盐水的荷瘤裸鼠的肿瘤部位升温速率很慢,并不足以实现光热治疗并诱发化疗药物的大量释放,因此对肿瘤生长的影响十分有限. 由图10(B)可见,尾静脉注射了吉西他滨/聚吡咯复合纳米粒子的荷瘤裸鼠的肿瘤部位升温速率显著提高,能够在8 min左右就达到42 ℃. 在此基础上持续施加光照,肿瘤温度可以超过42 ℃并长时间保持,进而实现对卵巢癌模型的光热治疗;同时,热刺激下吉西他滨的大量释放还能够发挥化疗的作用. 因此,在动物体内,吉西他滨/聚吡咯复合纳米粒子仍然可以通过光热治疗/化疗联合治疗卵巢癌.
3 结论
设计了一种具有化疗/光热联合治疗上皮性卵巢癌功效的吉西他滨/聚吡咯复合纳米粒子. 聚吡咯纳米粒子通过铁离子诱发吡咯单体氧化聚合的方法制备,对吉西他滨具有较强的负载能力,能够极大降低吉西他滨的毒副作用、提升药物利用率. 该复合纳米粒子在近红外光区具有较强的吸收,是一种良好的光热试剂,其光热转化效率为35.3%. 因此,吉西他滨/聚吡咯复合纳米粒子可以用于光热治疗,利用癌细胞热耐受性差的特点,发挥抗肿瘤作用. 另一方面,光热升温能够刺激复合纳米粒子释放负载的吉西他滨,并通过化疗抗肿瘤. 细胞实验中,吉西他滨/聚吡咯复合纳米粒子的光热治疗/化疗联合治疗能够有效杀伤卵巢癌A2780细胞,并抑制A2780细胞的增殖. 动物实验中,复合纳米粒子在808 nm激光下升温效果显著,展现出治疗卵巢癌的潜力.
感谢吉林大学第一医院肿瘤妇科赵本正博士、张梦文硕士提供A2780细胞.感谢吉林大学第一医院实验动物中心在动物实验中提供的支持.

