赝电容控制型钙钛矿高熵氧化物La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3负极材料的制备及储锂性能
贾洋刚,邵 霞,程 婕,王朋朋,冒爱琴
(安徽工业大学材料科学与工程学院,先进金属材料绿色制备与表面技术教育部重点实验室,马鞍山 243032)
锂离子电池(Lithium ion batteries,LIBs)作为一种长寿命、免维护的高效能量转换与储存装置,已被广泛应用于移动电子设备、电动汽车和航空航天等领域[1,2]. 电动汽车对锂离子电池的能量密度提出了更高的要求,因此提高锂离子电池的能量密度成为该领域的研究焦点[3]. 目前,锂离子电池负极材料根据储锂机制可以分为插入型负极材料(如中间相碳微球、人造石墨、天然石墨和硬碳材料)[4]、合金型负极材料(锡、硅、锗及相应的氧化物)[5,6]和转换型负极材料(如过渡金属氧化物)[7]. 上述负极材料都有各自的优势和不足. 其中,3d过渡金属氧化物(理论容量500~1000 mA·h/g)负极材料与目前商用的石墨负极材料(理论容量372 mA·h/g)相比,具有更高的理论容量,但其自身导电性差,充放电过程中较大的体积膨胀导致其循环性能和倍率性能较差,限制了它的实际应用. 因此,探索新一代容量高、倍率性能好且循环寿命长的LIBs负极材料具有十分重要的意义.
钙钛矿型(ABO3)过渡金属氧化物是一种电子或电子/空穴和氧离子的优良导体,其粒子表面的氧化还原协同作用及晶格缺陷的存在,使ABO3材料具有较高的电化学活性和电子、离子传导性,是一种潜在的电极材料. Hu 等[8]采用静电纺丝和煅烧结合的方法制备了LaMO3(M=Fe,Co,Ni),研究发现,LaMO3(M=Fe,Co,Ni)作为锂离子电池正极材料时,在200 mA/g的电流密度下循环200次后,LaFeO3,LaCoO3和LaNiO3的可逆容量分别为331,646和92 mA·h/g,即使在2000 mA/g的高电流密度下,LaCoO3仍能保持150 mA·h/g 的可逆比容量,容量保持率为54.82%;而LaFeO3和LaNiO3的容量保持率仅为16.78%和2.48%,可以看出,LaCoO3拥有更高的比容量和更优异的倍率性能. 过渡金属氧化物虽然拥有较高的比容量,但在实际使用过程中,该种材料存在电化学活性低和体积膨胀等问题[9]. 过渡金属基高熵氧化物具有熵稳定的晶体结构和多主元协同效应,缓解了体积膨胀问题,使其在循环过程中保持了结构的完整性,表现出更优异的锂离子存储性能和高效的循环稳定性[10~13]. Yan等[14]通过固相法合成了钙钛矿型高熵氧化物[(Bi,Na)1/5(La,Li)1/5(Ce,K)1/5Ca1/5Sr1/5]TiO3,在100 mA/g 的电流密度下循环,表现出125.9 mA·h/g 的初始放电容量,在1000 mA/g 的电流密度下获得120.4 mA·h/g 的可逆容量,即使在3000 mA/g的大电流密度下,仍能保持70 mA·h/g的可逆容量,可见其倍率性能优异,但是并不能满足LIBs的高比容量需求.
因此,本文在设计钙钛矿型高熵氧化物时,A位的选择从稀土元素的电子构型和离子半径的角度综合考虑,选择基态电子构型4f0(全空)且阳离子半径最大的La3+;B位选择离子半径接近的活泼过渡金属元素Co,Cr,Fe,Mn 和Ni. 该钙钛矿型La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3高熵氧化物的容忍因子[t=(rA+rO)/ 2 (rB+rO)]达到0.966,接近稳定钙钛矿的容忍因子的上限,具有良好的对称性以及较小的晶格畸变;在此基础上,采用金属硝酸盐为金属源,NaOH和Na2CO3为沉淀剂,通过共沉淀法制备了La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3高熵氧化物纳米粉体负极材料,并将其与相同实验条件下制备的二元LaCoO3的电化学性能进行了比较.
1 实验部分
1.1 试剂与仪器
导电炭黑、海藻酸钠、碳酸二甲酯(DMC)、碳酸乙烯酯(EC)、碳酸二乙酯(DEC)和六氟磷锂(LiPF6)均为电池级,购自科路得实验器材科技有限公司;Celgard2300聚丙烯多孔膜,购自美国Celgard公司;高纯锂片,购自泰州市亚骏电池材料有限公司;六水合硝酸镧[La(NO3)3·6H2O]、六水合硝酸钴[Co(NO3)2·6H2O]、九水合硝酸铬[Cr(NO3)3·9H2O]、九水合硝酸铁[Fe(NO3)3·9H2O]、四水合硝酸锰[Mn(NO3)2·4H2O]和六水合硝酸镍[Ni(NO3)2·6H2O],均为分析纯,购自国药集团化学试剂有限公司;聚乙二醇-600(PEG-600,纯度99%)购自青岛优索化学科技有限公司;去离子水(自制).
Rigaku Mini-Flex 型600 X射线衍射仪(XRD,日本理学公司);ΣIGMA HV-01-043型扫描电子显微镜(SEM,德国蔡司公司);Bruker Nano Xflash Detector 5010 型能谱仪(EDS,德国布鲁克公司);CHI760E型电化学工作站(上海辰华仪器有限公司);CT-4008T-5V10 mA-164型新威电池测试系统(深圳新威有限公司);ASAP2020/Tristar3000 型全自动气体吸附仪(美国Micromeritics 公司);TF-0410301型透明电气炉(日本Ishikawa公司).
1.2 样品的制备
将2.7062 g(6.25 mmol)的La(NO3)3·6H2O,以及等摩尔量(1.25 mmol)的0.3638 g Co(NO3)2·6H2O,0.2976 g Cr(NO3)3·9H2O,0.5050 g Fe(NO3)3·9H2O,0.3138 g Mn(NO3)2·4H2O 和0.3635 g Ni(NO3)2·6H2O 溶于少量蒸馏水中,称取0.1 g PEG-600 并加入上述金属硝酸盐混合溶液中,搅拌均匀;然后将0.60 g NaOH和0.99 g Na2CO3溶于少量蒸馏水,搅拌均匀后逐滴加入到上述金属盐溶液中;反应1 h后将沉淀进行真空抽滤,分别用蒸馏水洗涤3次,无水乙醇洗涤2次;然后将沉淀在90 ℃下烘干后研磨30 min,得到高熵氧化物前驱体;最后在空气气氛下,使用透明电气炉煅烧样品,以10 ℃/min升温速率升温至相应温度(500,750和950 ℃)后,将前驱体放入透明电气炉中保温30 min,然后立即取出研磨后得到La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3纳米粉体. 为了进行比较,在相同实验条件下,制备了传统二元LaCoO3纳米粉体.
1.3 样品的表征
采用XRD 测试样品的晶体结构,测试条件:扫描速率为5°/min,Cu 靶,Kα辐射,测定管压为40 kV,管流为100 mA,步长为0.02°,扫描范围为20°~85°. 采用SEM对样品进行形貌分析;采用X射线能谱(EDS)进一步分析样品中元素组成以及分布情况. 采用全自动气体吸附仪,测试样品的N2吸附-脱附等温曲线,测试条件:液氮为吸附介质,相对压力p/p0为0.0292~0.9931,采用Brunauer-Emmett-Teller(BET)模型计算比表面积,采用Barrett-Joyner-Halenda(BJH)法计算了孔分布和孔容.
1.4 电极片准备、电池组装和电化学性能测试
采用CR2025扣式电池探究高熵氧化物(HEO)电极材料的电化学性能. 将70 g HEOs粉体、20 g导电剂(硝酸处理过后的碳黑)及10 g黏结剂(海藻酸钠),放入玛瑙中并充分研磨(研磨过程中可加入少量蒸馏水),直至浆料不成股下流,将研磨好的浆料用刀片均匀涂覆在整洁的铜箔上,将涂好片的铜箔在90 ℃下真空干燥10 h,将冷却后的电极片切成圆片(直径13.9 mm),用压片机以8 MPa的压力保持30 s将其压实即制得电极片. 安装扣式电池在充满高纯氩气的手套箱中安装,以直径为15.6 mm的纯锂片为对电极,聚丙烯多孔膜为隔膜,将l mol/L LiPF6溶于等体积的碳酸二甲酯(DMC)、碳酸乙烯酯(EC)和碳酸二乙酯(DEC)混合溶液为电解液.
采用CHI760E型电化学工作站测试扣式电池的循环伏安(CV)曲线和电化学阻抗谱(EIS),其中CV曲线的测试条件为:电压为0.01~3 V,扫描速率分别为0.1,0.2,0.5,0.8和1.0 mV/s. EIS谱的测试条件为:测试频率范围为0.01~100000 Hz,扫描速率为0.5 mV/s,振幅为0.005 V. 采用CT-4008T-5V10 mA-164型新威电池测试系统测试电池的充放电特性(充放电曲线、循环性能和倍率性能),测试条件为:0.01~3 V.
2 结果与讨论
2.1 样品的结构形貌表征
图1为分别在500,750,950 ℃下煅烧30 min所制备的La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3粉体的XRD谱图. 从图1(A)可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3前驱体和在500 ℃煅烧的粉体均为非晶态结构;当煅烧温度进一步升高到750和950 ℃时,样品的所有衍射峰与ABO3型钙钛矿结构LaCo0.4Fe0.6O3标准卡片(PDF#40-0224)相符,均可得到具有单一钙钛矿结构的高熵氧化物固溶体,其中22.8°,32.5°,40.1°,46.7°,52.6°,58.1°,68.1°和77.6°处的衍射峰分别对应LaCo0.4Fe0.6O3的(100),(110),(111),(200),(210),(211),(220)和(310)晶面. 此外,由图1(A)中局部放大XRD谱图可以看出,随着煅烧温度的升高,(110)晶面的衍射角向小角度方向偏移,这是由于随着煅烧温度的提高,样品的晶粒尺寸变大,衍射峰发生了向左的偏移. 图1(B)为在750 ℃下煅烧30 min 所制得的传统二元LaCoO3粉体的XRD谱图,可以证实在相同条件下也得到具有单一钙钛矿结构的LaCoO3固溶体.
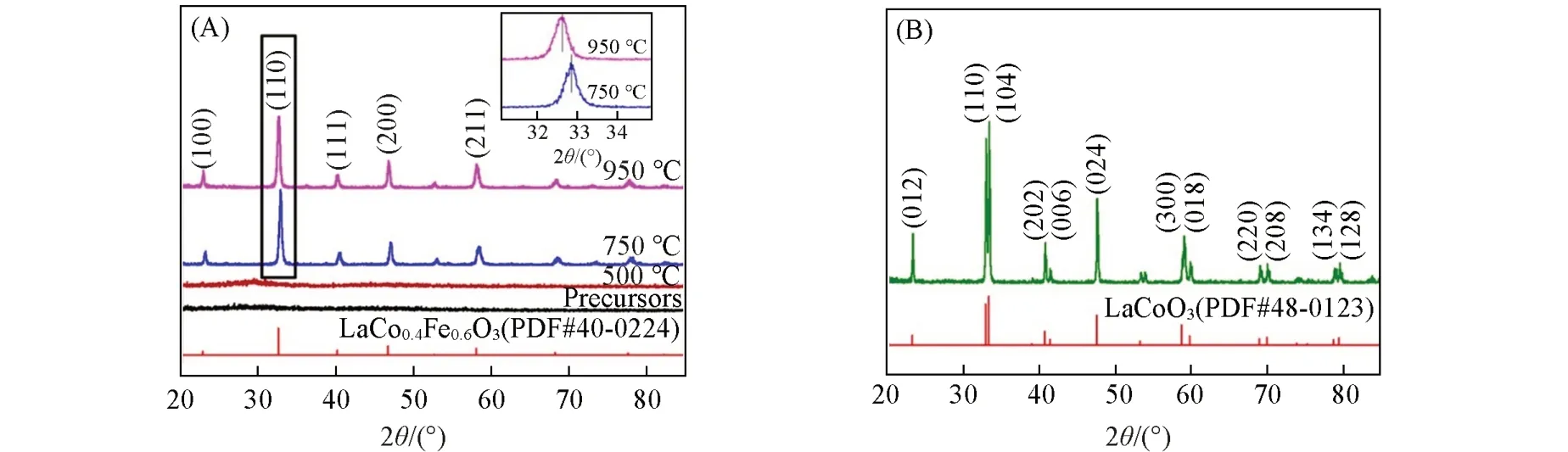
Fig.1 XRD patterns of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 powders at different calcination temperatures(A)and LaCoO3 powders(B)
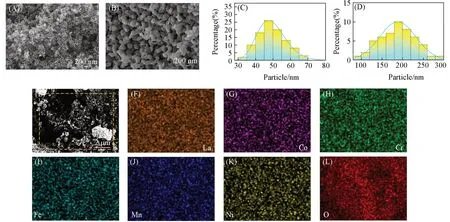
Fig.2 SEM images of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 powder prepared at 750(A)and 950 ℃(B),particle size distribution of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 powder prepared at 750(C)and 950 ℃(D),SEM images(E)and EDS mapping images(F—L)of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 powder prepared at 750 ℃
图2 (A)和(B)分别为La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3纳米粉体在750 和950 ℃下煅烧30 min后的SEM照片,图2(C)和(D)为La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3纳米粉体相应的粒度分布图. 从图2(A)~(D)可见,不同温度下煅烧的La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3粉体形貌均为球形,其粒径大小呈正态分布.750 ℃所制备的粉体平均粒径为29.21 nm,且无明显团聚现象. 值得注意的是,随着煅烧温度的升高,颗粒尺寸明显增大,950 ℃所制备样品的平均粒径为188.2 nm,但是样品存在少许团聚现象. 进一步由图2(E)~(L)可知,750 ℃所制备的粉体中各元素均匀分布,无明显团聚.
2.2 N2吸附-脱附性能
图3(A)为750 ℃所制备La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3的N2吸附-脱附等温曲线,图3(B)为相应的孔径分布图. 从图3(A)可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3样品的N2吸附-脱附等温曲线属于第Ⅴ种类型,滞后环属于H3 型,即La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3样品含有介孔[15~17];从图3(B)可以看到,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3样品的平均孔径在21.2 nm 左右,并且通过计算得到La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3高熵氧化物纳米粉体的比表面积、总孔容和平均孔径分别为19.83 m2/g,0.08 cm3/g和21.24 nm. 传统二元LaCoO3样品的平均孔径在17.2 nm左右(图S1,见本文支持信息),计算得到的比表面积、总孔容和平均孔径分别为5.16 m2/g,0.02 cm3/g和17.14 nm. 由此可见,与传统二元的LaCoO3纳米粉体相比,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3高熵氧化物纳米粉体拥有更大的比表面积,这有利于增加工作电极与电解液的接触面积,缩短电子与离子的传输路径,从而提高电化学性能.
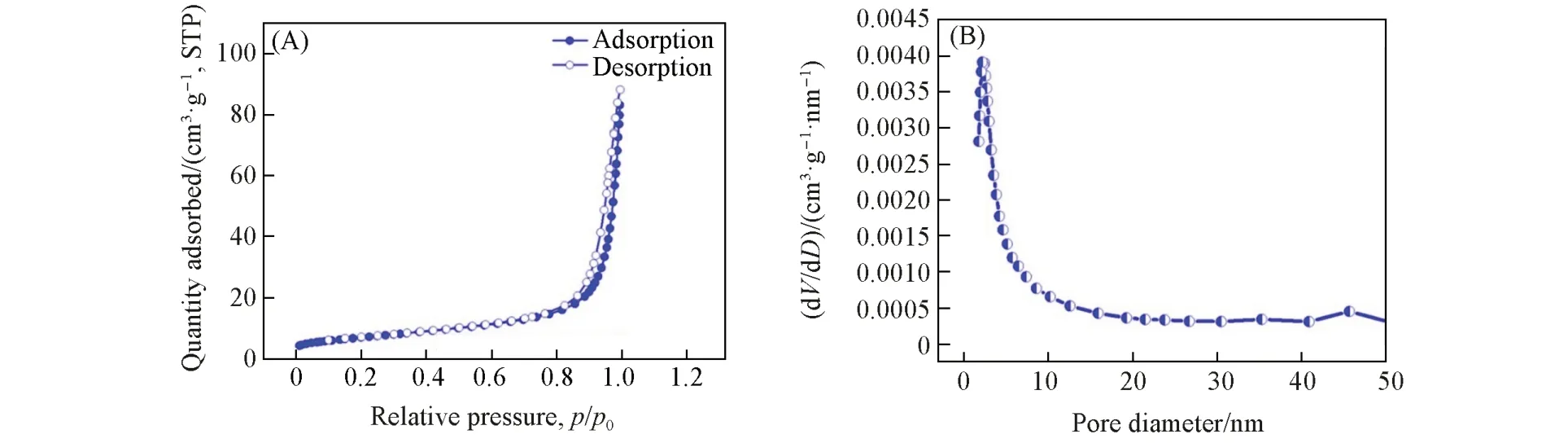
Fig.3 N2 adsorption-desorption isothermal curves of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3(A) and BJH pore size distribution of the samples(B)
2.3 样品的电化学性能
图4 (A)给出了La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3(750 ℃/950 ℃)和LaCoO3(750 ℃)在200 mA/g电流密度下的循环性能,图4(B)给出了La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和LaCoO3的倍率性能,图4(C)给出了La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和LaCoO3在大电流密度3000 mA/g下的循环性能. 根据下式可以计算出理论比容量[18,19]:

式中:n为每摩尔活性物质发生转化反应所含的电子数(本实验测试材料n=3.0);F(96485 C/mol)为法拉第常数;M为物质的相对分子质量.
由式(1)计算得到,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和LaCoO3的理论比容量分别为331.6 和327.1 mA·h/g,前者略高于后者.
从图4(A)可见,随着循环的进行,比容量都呈现出先降低(前5次)后升高的趋势,与报道的转换型材料容量变化趋势一致[10]. 容量的衰减是因为固体电解质界面膜(SEI)的形成和不可逆Li2O的产生;随着循环的进行,比容量的增加与反应活性位点的增加有关. 从图4(A)还可见,煅烧温度为750 ℃制备的La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3样品比950 ℃制备的样品具有更高的比容量,主要是因为750 ℃制备的样品拥有更小的颗粒尺寸,使得工作电极与电解液的接触面积增大,从而能够提供更多的活性位点,因此本文选择煅烧温度为750 ℃制备的La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3样品进行进一步的探究. 从图4(A)还可以明显看出,在200 mA/g 电流密度下,高熵氧化物La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3的比容量始终高于传统二元LaCoO3,这是因为高熵氧化物作为负极材料时,由于熵稳定的晶体结构和多主元协同效应,使得其作为锂离子电池负极材料拥有更高的比容量和良好的电化学性能[20];另一方面是由于高熵氧化物具有更大的比表面积,扩大了电极与电解液的接触面积,并提供更多的活性位点,以及赝电容的贡献使其具有较高的比容量和倍率性能. 随着循环的进行,高熵氧化物负极材料循环150次的比容量增加至771.8 mA·h/g,远高于其理论比容量(331.6 mA·h/g). 有研究报道,赝电容贡献率的增加,有利于提高材料的储锂性能[21,22].
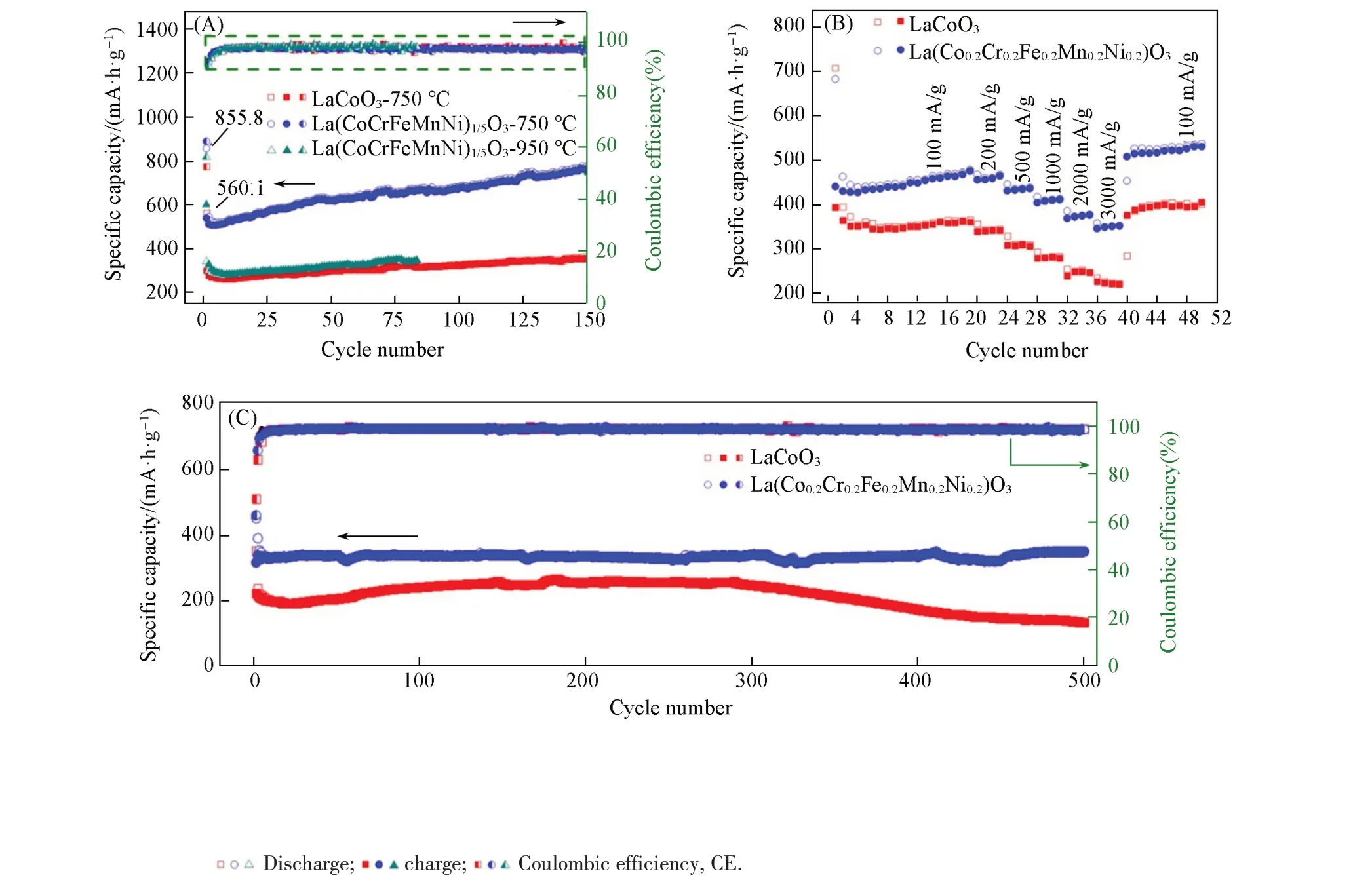
Fig.4 Cycling performance at 200 mA/g and coulombic efficiency(A),multiplicity performance(B),and cycling performance and coulombic efficiency at a current density of 3000 mA/g(C) of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 and LaCoO3
从图4(B)的倍率性能可见,电流密度为100 mA/g 时,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3负极材料提供了470 mA·h/g左右的可逆容量,当电流密度增加到200,500,1000,2000和3000 mA/g时,容量略有下降,分别为450,430,410,370和350 mA·h/g,即使在3000 mA/g的高电流密度下,容量保持率仍高达74.4%;当电流密度恢复至100 mA/g 时,比容量增加至510 mA·h/g. 对于传统二元LaCoO3负极材料,在3000 mA/g 的高电流密度下,容量保持率为61.1%. 由此可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3负极材料比传统二元LaCoO3负极材料具有更优异的倍率性能.
图4(C)示出了La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和LaCoO3电极在3000 mA/g 电流密度下的循环性能.可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极表现出更为优异的循环稳定性,循环500次后容量保持率约为95.1%. LaCoO3电极在循环300次左右时容量发生明显下降,循环500次后容量仅为135.2 mA·h/g,容量保持率约为67.5%,可能是由于LaCoO3电极在大电流下发生体积膨胀导致容量衰减.La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在大电流下优异的循环稳定性,是由于较大的构型熵可稳定晶体结构,缓冲锂化/脱锂过程中的体积变化;较大的锂离子扩散系数也能够使La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在较大的电流密度下获得优异的充放电能力[23,24].
图5(A)给出了La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在0.01~3 V 范围、0.5 mV/s 扫描速率下的CV 曲线. 可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在首次锂化时,在1.59 V处出现第1个还原峰,而该还原峰在之后的循环中未出现,该还原峰对应电解质在电极表面分解形成的固体电解质中间相SEI膜[19,25,26];随后在0.18 V 处出现1 个宽化的还原峰,对应过渡金属阳离子发生还原反应,同时伴随着Li2O的生成[23,27]. 在随后的充电过程中,1.49 V处的氧化峰为金属Co,Cr,Fe,Mn和Ni氧化为相应的金属氧化物,并伴随Li2O的分解. 由于本实验所使用的金属阳离子的标准电极电位比较接近,因此表现为一个宽化的还原峰. 通常,氧化还原峰的峰值电势差与电极在电化学反应过程中的极化有关,峰值电势差越小,电化学反应的可逆性越好[28~31]. 从图5(A)和(C)可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极的氧化还原峰之间的电势差(0.86 V)明显小于LaCoO3电极的氧化还原峰之间的电势差(1.15 V),进一步表明La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极具有更好的可逆性.
图5(B)和(D)分别为La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极和LaCoO3电极在电压范围为0.01~3 V,电流密度为200 mA/g下的充放电曲线. 可见,在电流密度为200 mA/g时,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和传统二元LaCoO3电极材料的初始放电比容量和首次库伦效率分别为855.8 mA·h/g,62%和560.1 mA·h/g,53%. 由此可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极表现出更为优越的初始放电/充电容量和初始库伦效率. 高熵氧化物负极材料的首次放电平台约为1.59 V,这与其CV曲线中1.59 V处出现的还原峰相对应,而此放电平台在之后的放电曲线中也没有再出现,进一步证实该放电平台是SEI膜形成所产生的[32,33]. 从图5(B)可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和传统二元LaCoO3电极相比,第2次和第3次充放电曲线重合度更好,进一步证实La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极具有更好的可逆性.
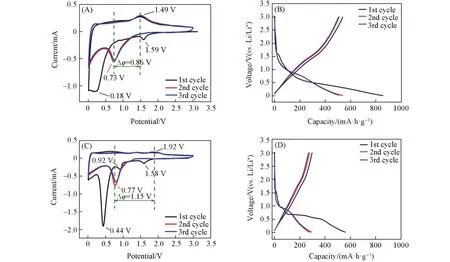
Fig.5 CV curves of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 electrode(A) and LaCoO3 electrode(C) at a scan rate of 0.5 mV/s , constant current charge/discharge curves of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 electrode(B)and LaCoO3 electrode(D)at 200 mA/g current density
2.4 样品电极的反应动力学特征
图6 (A)和(C)分别为La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和LaCoO3电极在循环前与循环3次和150次后在开路电压下的EIS 谱,其中的插图为其等效电路图,在等效电路中,Rs和Rct分别为电解液的欧姆电阻和电荷传递电阻,CPE为双层电容,Zw为Warburg阻抗[7,21,28,29]. 表1列出了拟合后的Rs、Rct和锂离子的扩散系数(DLi+,cm2/s). 图6(B)和(D)分别为两种电极的ω-1/2与Z'的直线关系图,利用下面公式可以计算出DLi+:

式中:R(8.3145 J·mol-1·K-1)为气体常数;T(298.15 K)为测试温度;A(1.51747 cm2)为电极的表面积;c为锂离子的浓度;σ为实部(Z')与低频区频率(ω-1/2)关系曲线的斜率[19,23,34~37].
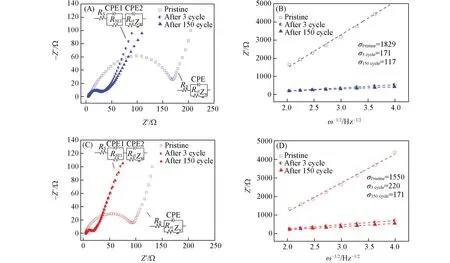
Fig.6 EIS spectra of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3(A) and LaCoO3 electrodes(C) before and after 3 and 150 cycles, plots of Z′ against ω-1/2 in the low frequency region of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3(B)and LaCoO3 electrodes(D)before and after 3 and 150 cyclesInset:the equivalent circuit diagram.
从表1可以看到,循环3次后,Rct明显减小,这可能是由于在充放电过程中活性物质逐步活化,锂离子传输通道被打开,使得循环后Rct变小,更加有利于Li+的传输. 虽然La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极的Rct在第3 次和第150 次循环后均高于LaCoO3电极的Rct,但是,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在第3 次和第150 次循环后的锂离子扩散系数明显大于LaCoO3电极的锂离子扩散系数,而且La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极的锂离子扩散系数增幅更大,该结果进一步证实La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极具有优异的倍率性能.
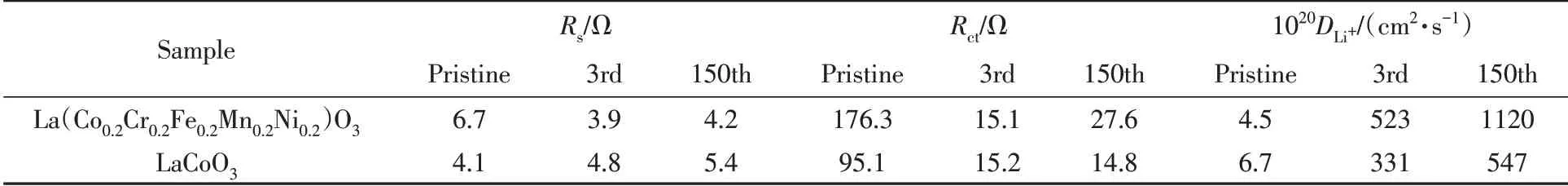
Table 1 Parameters of equivalent circuit diagrams of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 and LaCoO3 electrodesbefore and after 3 cycles and 150 cycles
图7(A)为La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在0.1,0.2,0.5,0.8和1.0 mV/s扫描速率下的CV曲线. 通过式(4)可以初步了解电荷储存机制,对式(4)进行变形得到式(5)[38],斜率b值即为所求.

式中:a为常数;ip(mA)为峰值电流;v(mV/s)为扫描速率;b为在0.5~1之间的变化值(临界条件b=0.5为扩散控制贡献,b=1.0为电容性贡献[23,39~41]).
从图7(A)可见,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在不同的扫描速率下,可观察到一个阴极峰和一个阳极峰,对其ip与v分别取对数作图[图7(B)],得到b值分别为0.84和0.91的两条直线方程,这表明La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极材料的电荷储存行为表现为赝电容与扩散型两种行为的协同作用. 为了得到赝电容和扩散反应对电池反应的具体贡献率,利用下式进行了计算:

式中:i(V)(mA)为电压V下的电流;特定电压下k1和k2为常数;v(mA/s)为扫描速率;k1v(mA)为表面电容贡献的电流;k2v1/2(mA)为扩散控制过程的反应电流.
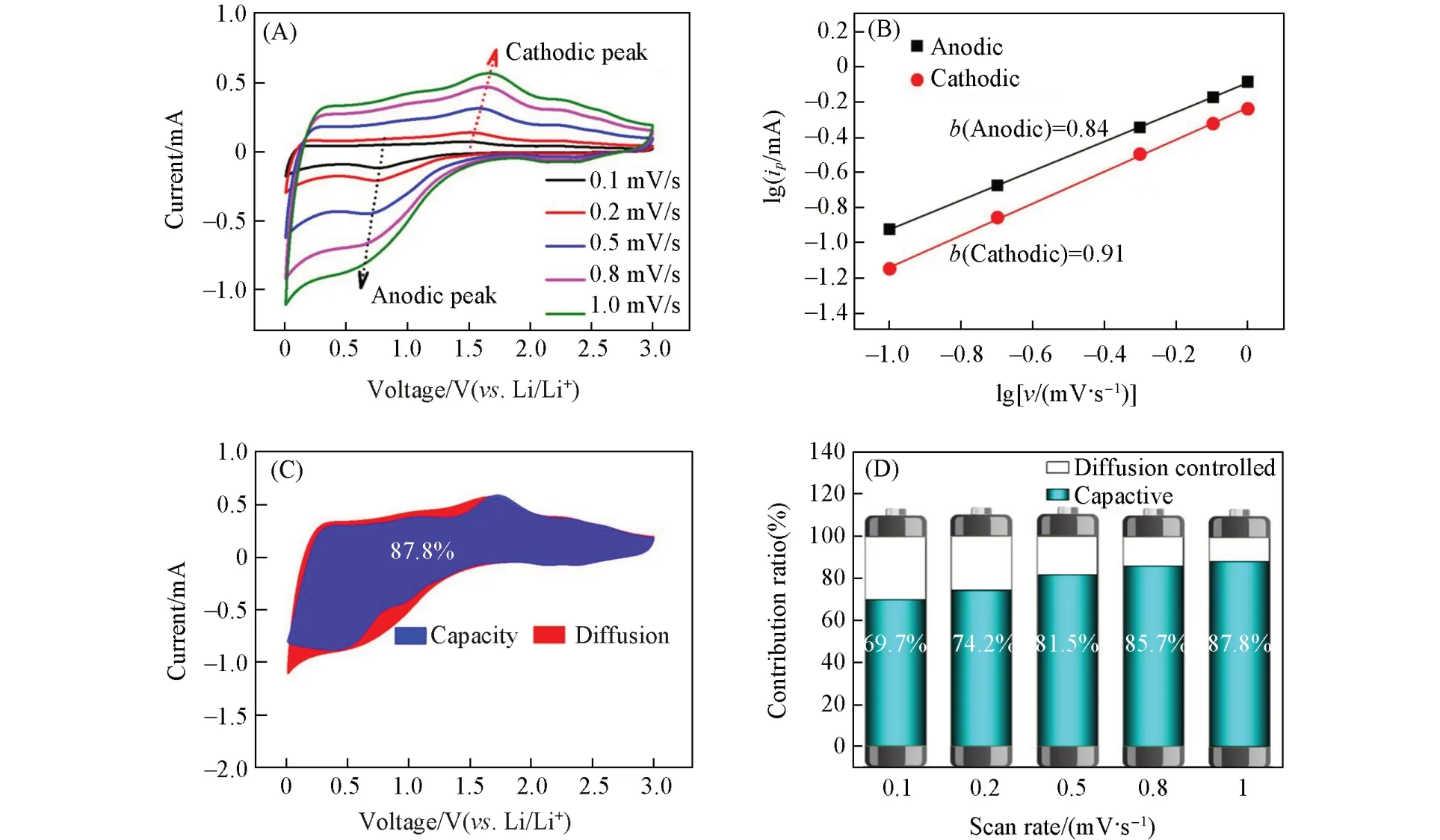
Fig.7 Cyclic voltammetry(CV)curves of La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 electrode at 0.1,0.2,0.5,0.8,1.0 and 1.0 mV/s sweep rates(A), lgip vs. lgv(B), separation of pseudocapacitive(blue region) and diffusion(red region) controlled contribution at 1.0 mV/s(C) and contribution ratios of pseudocapacitive capacities at different scan rates for La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3 electrode(D)
图7 (C)给出了在1.0 mV/s 时,赝电容(蓝色区域)和扩散(红色区域)控制的贡献占比,由图7(C)可见,当扫描速率为1.0 mV/s 时赝电容贡献为87.8%. 图7(D)给出了La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在不同扫描速率下赝电容的贡献率. 可以看出,赝电容的贡献率随扫描速率的增加而上升,当扫描速率从0.1 mV/s 增加到1.0 mV/s 时,赝电容的贡献也从69.7%增加到87.8%. 赝电容行为较高的材料具有很好的快速充放电的能力,而较多的介孔可以增加赝电容的比例[23],使得La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极具有优异的电化学性能.
在相同条件下对LaCoO3电极的反应动力学进行了分析(图S2,见本文支持信息). 从图S2(B)可见,对其扫描速率和峰电流分别取对数并作图,得到了斜率分别为0.72和0.90的两条直线方程,这表明LaCoO3电极材料的电荷储存行为也表现为电容型与扩散型两种行为的协同作用. 由LaCoO3电极在不同扫描速率下赝电容的贡献率可见,赝电容的贡献率随扫描速率的增加而上升,当扫描速率从0.1 mV/s增加到1.0 mV/s时,赝电容贡献率也从67.9%增加到86.9%[图S2(C)和(D)],可见,赝电容贡献在LaCoO3电极电池性能上也起到较大的作用.
虽然赝电容贡献对La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和传统二元LaCoO3电极的电池性能均有较大的贡献,但是La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3体系具有更大的混合熵(△Smix).

式中:△Hmix为混合焓;△Gmix为混合自由能.
根据式(7)可知,△Smix值的增大,使得其具有较小的混合自由能(△Gmix),使其在充放电过程中可以很好地稳定其晶体结构,从而提高循环稳定性[20]. 进一步的,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3样品中多种金属阳离子之间的协同效应,使其具有更为优异的电化学性能.
在此基础上,较大的赝电容贡献与上述优势,使得La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3电极在循环150次后的比容量(771.8 mA·h/g)远高于理论容量(353.9 mA·h/g). 而传统二元LaCoO3电极虽然也拥有较大的赝电容贡献,但是缺少上述优势,再加上循环过程中的体积膨胀,使得传统二元LaCoO3电极在循环150次后的比容量(353.9 mA·h/g)仅仅略微高于理论容量(327.1 mA·h/g).
3 结论
采用金属硝酸盐为金属源,NaOH和Na2CO3为沉淀剂,利用共沉淀法制备了具有介孔结构、平均粒径为29.21 nm 的球形钙钛矿型La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3高熵氧化物负极材料,研究了其储锂性能,并与相同条件下制备的二元LaCoO3电极材料进行了比较. 结果表明,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3和LaCoO3负极材料在200 mA/g 的电流密度下,首次放电比容量分别为855.8 和560.1 mA·h/g;经过150次充放电循环后,比容量分别为771.8和353.9 mA·h/g;在3000 mA/g 的高电流密度下循环500次后,比容量和容量保持率分别为320 mA·h/g 和95.1%及135.2 mA·h/g 和67.5%. 相比于传统的LaCoO3,La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3负极材料的比容量、循环性能和倍率性能得到大幅度提高,这归因于钙钛矿型La(Co0.2Cr0.2Fe0.2Mn0.2Ni0.2)O3高熵氧化物纳米粉体具有熵稳定的晶体结构,可以缓冲锂化/脱锂过程中的体积变化;同时多主元协同效应有利于提高锂离子的扩散系数,增加赝电容的贡献率;其较大的比表面积和介孔结构扩大了电极与电解液的接触面积,提供了更多的活性位点. 研究结果为传统金属氧化物电极材料电化学性能的提升提供了借鉴,也为设计成本低廉、性能良好的少钴或无钴化替代电极材料提供了新的设计理念和思路.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/20220157.

