食管鳞状细胞癌胸椎功能不全性骨折与放射治疗的相关性
吴兴强,张天悦,冯钰玲,李春平,陈天武,李睿
川北医学院附属医院放射科,四川 南充 637000;*通信作者 李睿 ddtwg_nsmc@163.com
食管癌是我国常见的消化道肿瘤之一,鳞状上皮细胞癌是其最主要的病理类型[1],每年我国的食管癌发病率约占全世界的50%,发病率及死亡率约为36.91/10万和25.68/10万[2]。目前手术切除仍是食管癌最重要的治疗方式,但术中局部切除不彻底,术前已有潜在的病灶和已经播散的转移灶可导致局部复发或远处转移,患者的术后生存率明显下降。
放射治疗(简称放疗)作为术后治疗的补充,能有效降低局部复发率,显著改善患者预后。同时,放疗还可以应用于可手术切除食管癌患者的术前放疗,降低肿瘤的TNM分期;放疗更是无法手术切除食管癌的主要治疗方式。然而,肿瘤放疗可引起照射野内骨质密度降低及骨质疏松,并由此可能发生功能不全性骨折。既往研究[3]报道胃癌患者在接受放疗后腰椎骨质密度减低,且部分患者发生腰椎骨折。直肠癌和宫颈癌患者在接受放疗后发生骨盆功能不全性骨折的概率也明显升高[4-5]。当食管癌患者接受放疗时,由于食管毗邻胸椎,胸椎椎体不可避免地会受到辐射,可能引起胸椎椎体骨质密度下降,并导致胸椎发生功能不全性骨折。目前与食管癌放疗相关的胸椎椎体骨质疏松及椎体功能不全性骨折的研究鲜有报道,因此本研究拟探讨食管鳞状细胞癌患者发生胸椎功能不全性骨折与接受放疗的相关性,并分析发生椎体功能不全性骨折的危险因素,以期为临床提供有效的预防措施,改善患者预后。
1 资料与方法
1.1 研究对象 回顾性分析2016年3月—2018年4月就诊于川北医学院附属医院,并经手术病理证实为食管癌的315例连续性患者的临床和影像资料。最终纳入239例符合标准的患者,其中男172例,女67例,年龄42~85岁,平均(63.3±8.7)岁。根据胸椎椎体是否发生功能不全性骨折将患者分为骨折组20例与非骨折组219例。纳入标准:①经病理证实为食管鳞状细胞癌;②根据美国癌症联合委员会与国际抗癌联盟联合出版的食管癌第8版分期系统行TNM分期[6]的食管癌;③确诊前未接受过任何肿瘤相关性治疗;④接受治疗前后及随访期间均行胸部CT扫描;⑤患者临床资料完整。排除标准:①肝、肾等重要器官严重功能障碍;②图像质量不能满足诊断需求者。本研究经川北医学院附属医院伦理委员会批准[2020ER(A)008],所有患者均签署知情同意书。
1.2 仪器与方法 所有纳入患者接受治疗前均行胸部CT扫描。采用西门子Siemens CT SOMATOM Force 128层CT、GE LightSpeed VCT 128层CT、飞利浦Brilliance 128层螺旋CT及Toshiba Aquilion 16层CT。患者取仰卧位,扫描范围从颈根部至双肾上盏层面。CT扫描参数:管电压120 kV,管电流100 mA,扫描层厚5 mm,层间距5 mm,球管转速0.5 s/转,滤过函数FC10,矩阵512×512,螺距0.984∶1。增强扫描:平扫后采用高压注射器经肘静脉注射非离子型等渗对比剂碘海醇(含碘300 mg/ml),注射流速3.0~3.5 ml/s。扫描原始数据传输至后处理工作站进行重建,并获得椎体重建矢状图像,重建层厚为1 mm或1.2 mm,层间距为1 mm或1.2 mm。由2名影像诊断医师(分别具有3年和10年放射诊断工作经验)分别阅片,并一致确定是否发生胸椎椎体功能不全性骨折。根据椎体重建的矢状图像和半定量方法诊断椎体骨折:在矢状面上至少20%的高度损失或10%的椎体区域损失[7]。排除骨转移或肿瘤直接侵犯椎体所导致的病理性骨折。同时在相同扫描层厚下,在胸椎椎体横断位的上、中、下3个层面勾画3个尽量平行于终板的感兴趣区(ROI),ROI仅包括松质骨,尽量避免骨皮质边缘、骨结构异常以及椎体血管等区域,胸椎椎体3个ROI的平均CT值代表该椎体的CT值[8]。并按照此方法测量放疗前后照射野内的所有椎体平均CT值,对于骨折椎体CT值的测量,以骨折椎体邻近上、下2个椎体所测平均CT值替代,并以此评估椎体骨质密度的变化。首次椎体CT值分析结束后2周,由另外1名医师采用独立、双盲原则随机选出30例接受放疗患者,重新测量放疗前后照射野区椎体CT值。比较2名医师的检测结果,完成椎体CT值测量的可重复性分析。
1.3 随访 以患者接受治疗为观察起点,随访2年,临床终点事件定义为胸椎椎体发生功能不全性骨折。治疗后每4个月进行1次胸部CT检查;直到治疗后1年每6个月进行1次胸部CT检查,观察吻合口、纵隔情况及胸椎是否发生功能不全性骨折,随访截止至2020年4月。
1.4 统计学方法 采用SPSS 17.0软件,符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验;计数资料以例(%)表示,组间比较采用χ2检验;分别采用单因素和多因素Logistic回归分析探讨椎体骨折的独立危险因素;采用ROC曲线分析胸椎CT值对椎体骨折的预测价值;采用Kappa检验分析骨折组放疗患者的放疗照射野与椎体骨折部位的一致性。采用变异系数(coefficient of variation,CV)评估胸椎椎体Hu值测量的可重复性,其定义为标准差和相应平均数的百分比值,CV<10%认为可重复性较好。P<0.05为差异有统计学意义。
2 结果
2.1 患者临床基线资料 239例患者中,148例接受放疗,91例未接受放疗。骨折组与非骨折组中分别有18例及130例接受放疗,两组患者治疗方式差异有统计学意义(χ2=7.297,P=0.007)。两组患者年龄差异有统计学意义(t=2.646,P=0.009),性别、体重指数、吸烟史、饮酒史、化疗史、放疗方式、原发肿瘤部位、T分期、N分期比较,差异均无统计学意义(P>0.05),见表1。
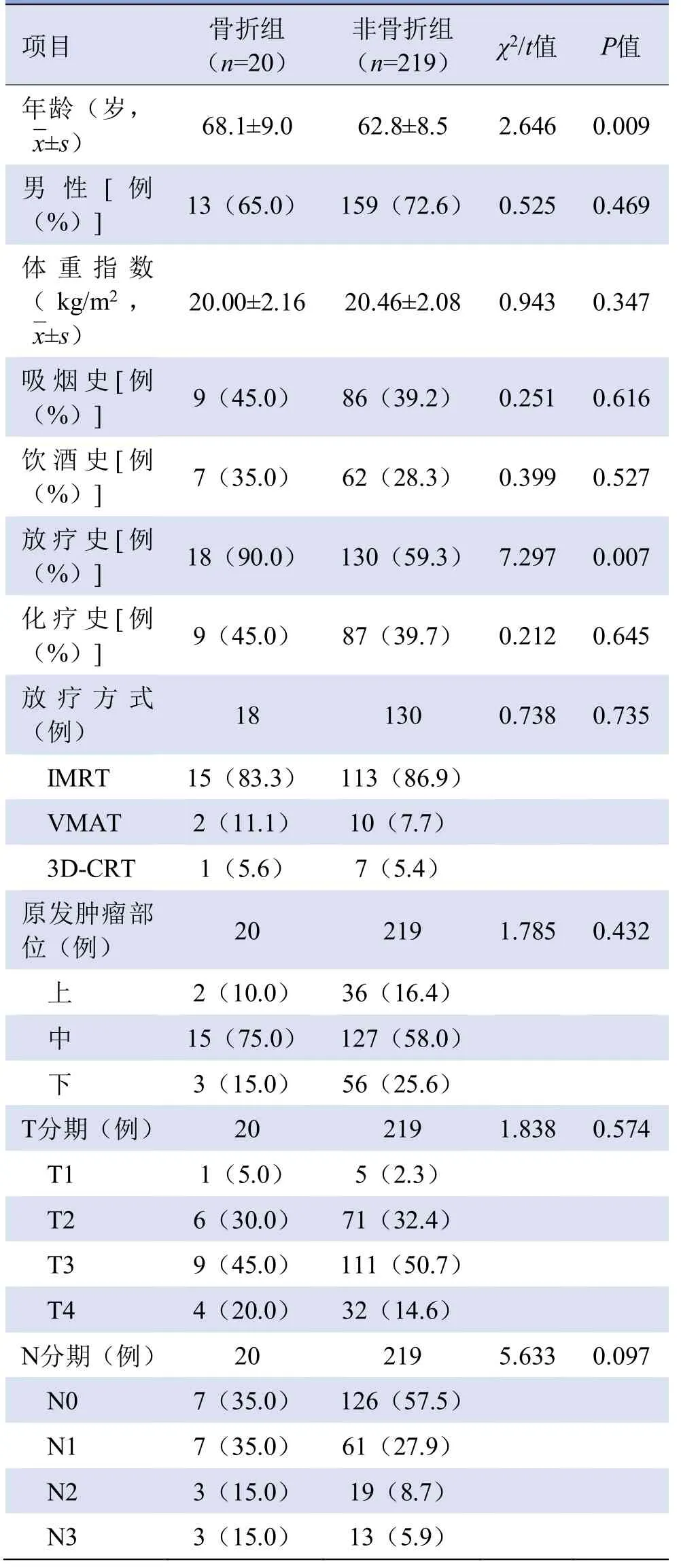
表1 食管癌骨折组与非骨折组患者临床基线资料比较
2.2 Logistic回归分析胸椎骨折的危险因素 接受放疗的148例食管癌患者中,18例发生胸椎骨折,椎体骨折发生率为12.16%,其中2例发生2个椎体骨折,其余16例均为1个椎体发生骨折;未接受放疗的食管癌患者中仅2例发生椎体骨折,均为单个椎体骨折,骨折发生率为2.19%(2/91)。将年龄、放疗因素、化疗因素及放疗方式作为自变量,进行二元Logistic回归分析。单因素回归分析显示,放疗(OR=6.162,P=0.016)和年龄≥65.5岁(OR=3.291,P=0.015)是发生胸椎功能不全性骨折的危险因素;经多因素Logistic回归模型调整年龄因素后,放疗仍是食管癌患者发生胸椎功能不全性骨折的独立危险因素(OR=6.105,P=0.018),见表2。
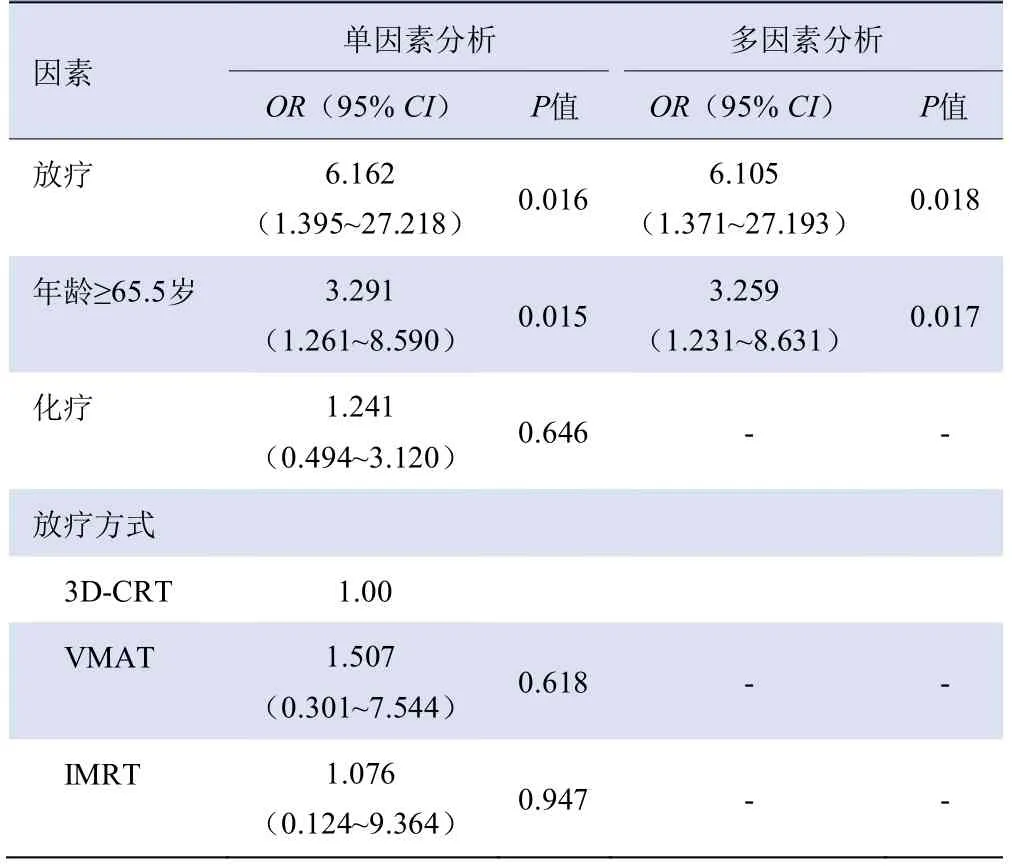
表2 食管癌患者胸椎骨折危险因素Logistic回归分析
2.3 放疗照射野与骨折发生部位的相关性 骨折组接受放疗的18例食管癌患者,大部分胸椎椎体骨折发生于肿瘤放疗照射野内,其中分别有2例、14例及2例照射野位于上段、中段及下段胸椎区域(图1);相应区域分别发生2例、13例及3例胸椎功能不全性骨折,两者具有较好的一致性(Kappa=0.70,P<0.001)。
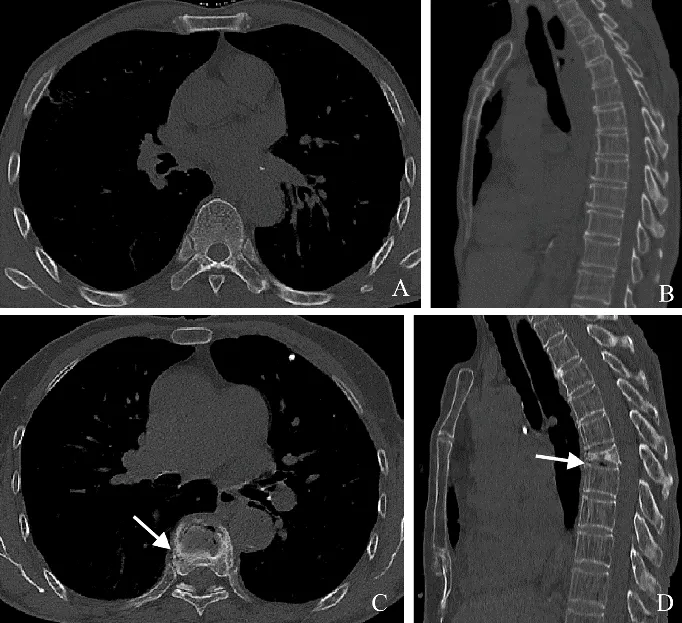
图1 男,75岁,食管中段鳞癌,接受放疗前后胸椎对比。A.放疗前CT平扫轴位示椎体密度均匀,骨小梁结构清晰;B.矢状位重建示胸椎椎体未见骨折;C.接受食管癌术后及放疗后第19个月随访CT平扫轴位提示胸6椎体密度不均(箭);D.矢状位重建示胸6椎体压缩性骨折,其余照射野内多个椎体骨质密度减低,骨小梁稀疏(箭)
2.4 放疗照射野与胸椎CT值变化的相关性 随机抽取30例患者进行胸椎CT值重复测量,结果显示放疗前(CV=1.92%)和放疗后(CV=3.78%)椎体平均CT值测量均具有较好的可重复性(表3)。随访发现,接受放疗的食管癌患者(148例)照射野内的胸椎椎体CT值较放疗前明显减低(118.07±34.30比145.92±32.69;t=7.831,P<0.001)。同时,对胸椎CT值进行ROC曲线分析发现,当胸椎平均CT值下降到约97 Hu时,椎体骨折的危险性增加(AUC=0.896,敏感度为0.723,特异度为0.889)。此外,骨折组中放疗患者发生骨折的中位时间16.5(13.75~26.75)个月,低于非放疗患者的22.0(16.0~25.0)个月,但差异无统计学意义(U=14.00,P=0.613)。
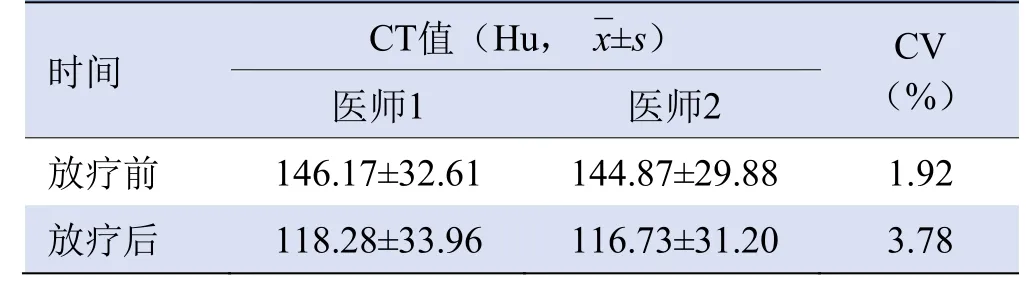
表3 30例放疗患者照射野椎体平均CT值测量的可重复性分析(n=30)
3 讨论
3.1 放疗是胸椎骨折的危险因素之一 本研究发现,接受放疗是食管癌患者胸椎功能不全性骨折的独立危险因素。与接受非放疗的食管癌患者相比,接受放疗的食管癌患者发生胸椎椎体骨折的概率明显高于非放疗的食管癌患者(12.16%比2.19%),与其他部位肿瘤接受放疗后功能不全性骨折的发生率大致相似:宫颈癌放疗后骶骨功能不全性骨折发生率约为8.2%~15.2%,直肠癌约为9%~11.2%[4-5,9-10]。这一征象提示胸椎骨折并非食管癌放疗后罕见的不良事件,但由于大多数胸椎椎体骨折症状不明显,并未引起临床重视。只有当部分患者出现明显胸背部疼痛或功能活动受限时,胸椎骨折通常才会被临床医师注意,但此时胸椎骨折情况已较为严重,会增加患者残疾的风险,甚至发生瘫痪,对患者的生活质量及预后产生严重的不良影响。因此,在食管癌的治疗过程中,早期、及时认识到放疗的骨并发症并采取针对性的预防措施至关重要,对改善患者的预后具有重要临床意义。
3.2 胸椎骨折部位及椎体CT值均与放疗照射野有关本研究发现,食管癌患者的大部分椎体骨折发生于肿瘤放疗照射野内。在随访过程中,接受放疗的食管癌患者即使未发生相应区域的胸椎功能性骨折,但与治疗前相比,照射野内胸椎椎体的骨质密度明显减低,部分患者甚至可发生较严重的骨质疏松,可能原因是辐射损伤会阻断骨微血管,导致成骨细胞活动停滞及抑制成骨细胞周期的进展,并引起成骨细胞数量减少及死亡。同时,辐射也会损害骨基质,增加骨髓脂肪,减少骨的血管供应,并导致骨骼结构恶化和骨密度丧失,最终引起骨质疏松甚至椎体骨折[11-12],提示骨形成减少可能是放疗引起骨损伤的主要原因。此外,既往研究报道,椎体平均CT值>160 Hu时,可认为椎体骨质密度正常,在100~160 Hu之间则认为椎体骨质密度降低,而<100 Hu时则认为是骨质疏松的征象,而骨质疏松是椎体骨折的危险因素[13]。本研究也发现当椎体平均CT值下降到约97 Hu时椎体骨折的风险增加,这类患者在临床中需要重点监测,必要时可利用MR多参数成像进一步分析。
3.3 胸椎骨折的其他相关危险因素 与年龄相关的骨质疏松症也会导致胸椎椎体骨折。本研究发现,年龄是除放疗因素外食管癌患者发生胸椎椎体骨折的另一个危险因素,也是食管癌患者发生椎体骨折的独立危险因素,与Fujii等[14]的研究结论一致。此外,骨折组中部分接受放疗的食管癌患者在治疗过程中甚至接受了2个疗程放疗,使得椎体所受辐射剂量明显增加,而Wei等[15]的研究也发现腹部癌放疗后椎体骨质密度下降及骨折发生率与放疗剂量呈明显正相关,表明放疗剂量也可能与椎体骨折有关。
3.4 胸椎骨折的预防及评估 有研究发现,双膦酸钙盐钙和维生素D在预防骨质疏松症和降低骨折率方面具有重要作用,能降低椎体骨折的风险,并且能有效预防骨折相关的不良事件[16-17]。CT已广泛用于食管癌的术后随访,针对接受放疗及高龄患者,除能评估吻合口、纵隔及双肺改变等外,还应重点观察患者的椎体密度和形态改变,以便早期干预骨质疏松的发展及功能不全性骨折的发生,对于接受多个放疗疗程以及高龄食管癌患者,可行胸椎MR检查以早期发现胸椎损伤。同时,有研究[18-19]发现全身骨显像联合局部SPECT/CT断层显像对功能不全性骨折的诊断具有一定的特异性,且与CT和MRI相比,其对功能不全性骨折具有更高的诊断准确性,因此必要时可行上述检查,以便早期发现胸椎骨折并采取相应的预防措施。此外,Warren等[20]报道在放疗计划研究中,质子疗法可以在不影响目标覆盖的情况下减少对椎体的辐射剂量。因此,更先进的放疗计划也有助于预防发生椎体骨折,改善患者预后。
3.5 研究的局限性 本研究采用回顾性分析,在一定程度上会影响分析结果,今后需增加病例且开展多中心研究加以论证。
综上所述,食管癌的放疗是发生胸椎椎体功能不全性骨折的独立危险因素,需要引起临床医师的高度重视。CT能准确观察到椎体的密度及形态学改变,对临床检测和指导治疗具有重要意义。

