BCR-ABL阴性的骨髓增殖性肿瘤中PD-1和PD-L1的表达研究
彭 芳,钟 斌,张功亮,王 建,王 志
(1. 赣州市人民医院病理科;2. 赣南医学院第一附属医院药学部;3. 赣州市儿童白血病肿瘤免疫治疗药物研发重点实验室,江西 赣州 341000)
骨髓增生性疾病(Myeloproliferative diseases,MPD)是分化相对成熟的一系或多系骨髓细胞持续克隆性增殖所致的一组肿瘤性疾病。BCR-ABL 阴性的MPD 主要包括真性红细胞增多症(Polycythemia vera,PV),原发性血小板增多症(Essential thrombocythemia,ET),原发性骨髓纤维化(Primary myelofibrosis,PMF)等。 程序性死亡受体1(programmed death 1,PD-1)是一种重要的免疫抑制分子,为免疫球蛋白超家族[1]。其最初是从凋亡的小鼠T 细胞杂交瘤2B4. 11 克隆出来[2-3]。以PD-1 为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要意义[4-6]。其配体PD-L1也可作为靶点,相应的抗体也可起到相同的作用[5]。PD-1 和PD-L1 结合启动T 细胞的程序性死亡,使肿瘤细胞获得免疫逃逸[7]。血液系统肿瘤主要采取化疗的治疗方式,抗PD-1/抗PD-L1免疫治疗是肿瘤新的治疗模式,本研究主要分析30 例BCR-ABL 阴性的骨髓增殖性肿瘤的临床资料、病理形态学特征及PD-1 和PD-L1 免疫组化表达情况。探讨这些患者能否在抗PD-1/抗PD-L1免疫治疗中获益,从而提高生命质量和带瘤生存时间。
1 材料和方法
1. 1 一般资料收集2011 年8 月至2020 年8 月赣州市人民医院骨髓涂片、病理活检、流式细胞学和分子遗传学等诊断为真性红细胞增多症5例(男性3例,女性2 例,中位年龄51 岁),原发性血小板增多症10 例(男性6 例,女性4 例,中位年龄50 岁),原发性骨髓纤维化15 例(男性8 例,女性7 例,中位年龄52 岁),骨髓穿刺活检部位均为髂后上棘,所有骨髓活检病例均经2名有经验的病理医师复核确诊。回顾分析患者的临床资料和患者预后随访情况。
1. 2 实验试剂一抗PD-1、PD-L1、Elivision 试剂盒、二抗试剂盒和DAB 试剂均购自福州迈新生物技术开发有限公司,并设阳性对照和阴性对照。
1. 3 免疫组织化学方法所有标本均经4%中性甲醛固定,石蜡包埋,常规3 µm 切片,做HE 染色及免疫组织化学检查。免疫组织化学采用EnVision两步法,行高温抗原修复,DAB显色。
1. 4 结果判定结果由2 名高年资病理专科医师进行双盲独立阅片,PD-1 细胞膜和/或细胞质出现棕黄至棕褐色为阳性表达,PD-L1 以细胞膜出现棕黄至棕褐色为阳性表达。选取3 个高倍镜视野(×400)区域计数阳性细胞数占全部细胞的比例,以5%的细胞阳性为分界值[8]。
1. 5 统计学方法采用SPSS 19. 0 软件进行分析,计数资料用例数(n)表示,组间比较采用t检验;计数资料用率(%)表示,组间比较采用χ2检验;等级变量相关性分析采用spearman 相关性分析。P<0. 05为差异有统计学意义。
2 结 果
2. 1 检验学和病理学特点真性红细胞增多症:患者血常规表现血红蛋白持续升高(男性>18. 5 g·dL-1,女性>16. 5 g·dL-1),部分病例血小板和白细胞升高;骨髓活检显示骨髓增生极度活跃,巨核细胞有特征性,巨核细胞增多,且形态多样,有胞体大、分叶多的巨核细胞,也出现胞体小、分叶少的巨核细胞及正常形态的巨核细胞(图1)。
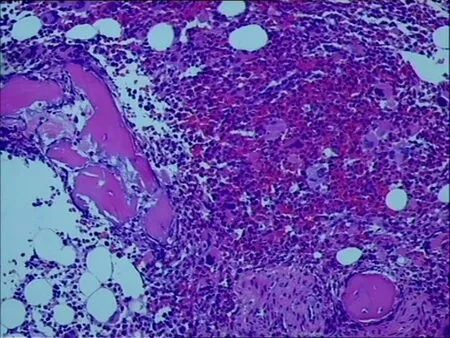
图1 真性红细胞增多症(HE×100)
原发性血小板增多症:患者血常规表现血小板持续升高(>1 000×109·L-1);骨髓活检增生程度较真性红细胞增多症低,显示骨髓增生较活跃,巨核细胞数量增多,巨核细胞形态特征较明显,常表现为胞体大、分叶多的巨核细胞,巨核细胞核常呈“鹿角样”,粒红比例大致正常,粒系各阶段可见,以中幼及以下阶段为主,嗜酸粒细胞散在分布,红系各阶段细胞可见,以中晚幼红细胞为主,淋巴细胞、浆细胞散在分布(图2)。
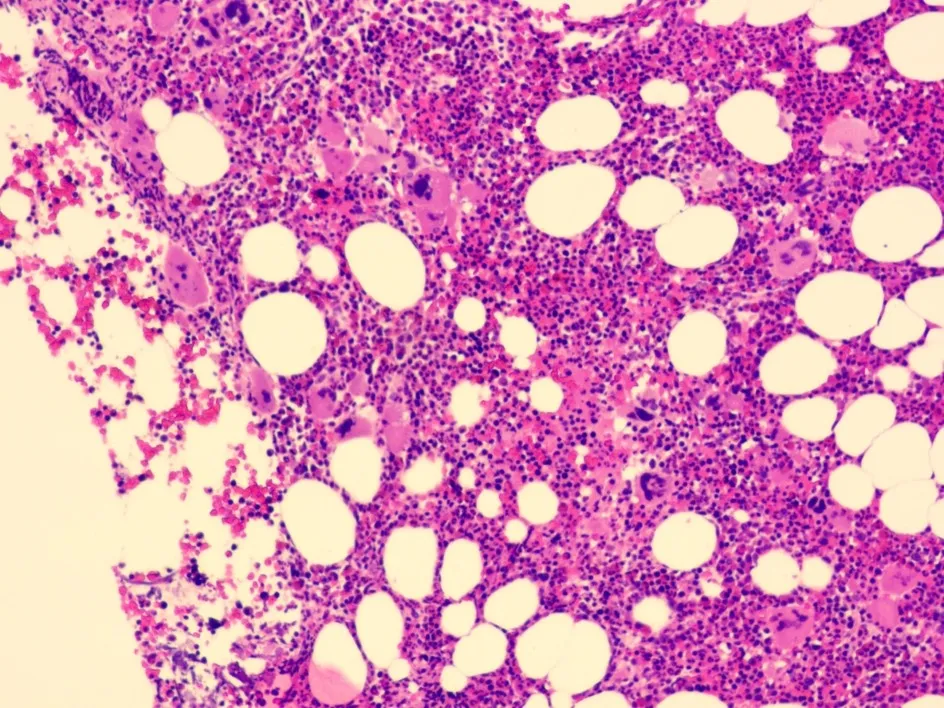
图2 原发性血小板增多症(HE×200)
原发性骨髓纤维化:患者血常规表现贫血和血小板明显增高;骨髓活检组织中纤维组织广泛增生,粒红比例增高,粒系各阶段可见,以中幼及以下阶段为主,嗜酸粒细胞增多,红系各阶段细胞可见,以中晚幼红细胞为主,巨核细胞不少,可见胞体小、分叶少的巨核细胞;淋巴细胞、浆细胞散在分布。
2. 2 免疫组织化学特点PD-1 阳性率:真性红细胞增多症阳性率20. 0%,原发性血小板增多症阳性率30. 0%,原发性骨髓纤维化阳性率20. 0%,总阳性率23. 3%;PD-L1 阳性率:真性红细胞增多症阳性率20. 0%,原发性血小板增多症阳性率30. 0%,原发性骨髓纤维化阳性率33. 3%,总阳性率30. 0%(图3、图4、表1)。
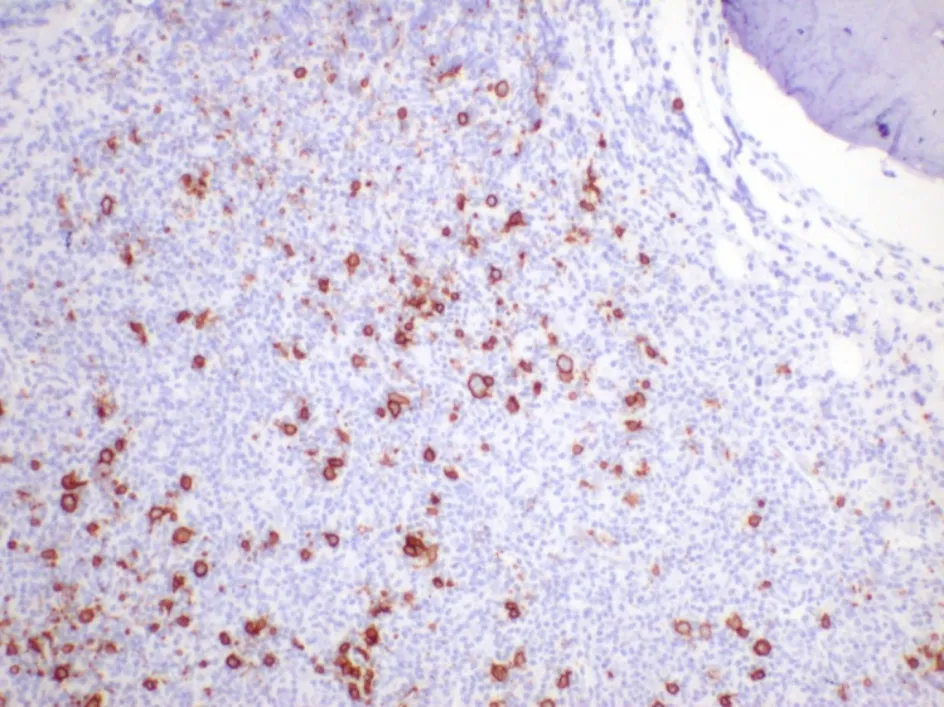
图3 真性红细胞增多症PD-1的表达(EnVision×200)
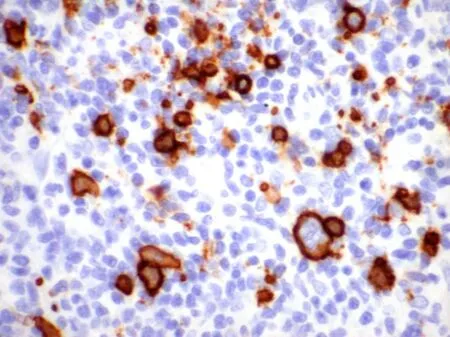
图4 真性红细胞增多症PD-1的表达(EnVision×400)

表1 BCR-ABL阴性的骨髓增值性肿瘤中PD-1和PD-L1的表达/n(%)
2. 3 BCR-ABL 阴性的骨髓增殖性肿瘤中PD-1 和PD-L1 表达与临床特征关系不同年龄和不同性别骨髓组织中PD-l 和PD-L1 的表达水平比较,差异均无统计学意义(P>0. 05)。高危组骨髓组织中PD-l 和PD-L1 表达水平高于低危和中危组,差异有统计学意义(P<0. 05)(表2)。
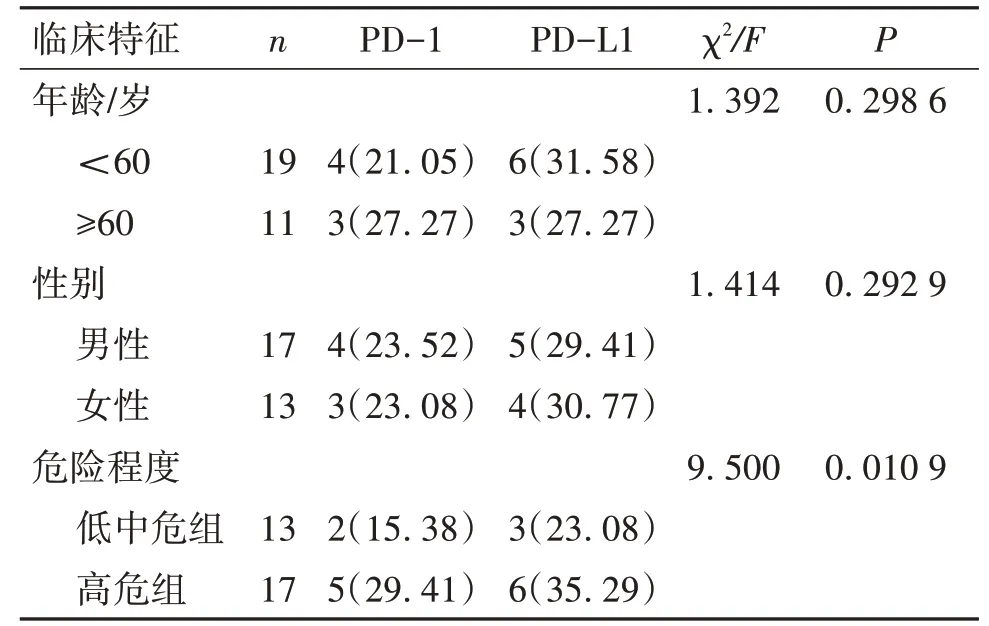
表2 不同临床特征在BCR-ABL 阴性的骨髓增殖性肿瘤中PD-1和PD-L1表达情况/n(%)
3 讨 论
PD-1 通过调节T 细胞活性,激活抗原特异性T细胞凋亡并抑制调节性T细胞凋亡。程序性细胞死亡配体1(PD-L1)是一种跨膜蛋白,被认为是免疫反应的共同抑制因子,它可与PD-1结合以减少PD-1阳性细胞的增殖,抑制其细胞因子分泌并诱导细胞凋亡[9-10]。PD-1/PD-L1 轴在肿瘤的进展中起着至关重要的作用,它可通过改变免疫监视状态治疗肿瘤。PD-1/PD-L1 抑制剂是一些难治性肿瘤治疗的突破。然而,生物标志物反映肿瘤免疫微环境和肿瘤细胞内在特征,如PD-L1表达、细胞密度肿瘤浸润淋巴细胞(TIL)、肿瘤突变负荷和错配修复(MMR)缺陷已被证实与抗PD-1/抗PD-L1治疗效果相关[11-12]。
本研究选取30 例初发BCR-ABL 阴性的骨髓增殖性肿瘤患者,进行骨髓活检组织中PD-1 和PD-L1检测,PD-1阳性率为23. 3%,PD-L1阳性率为30. 0%。根据文献报道健康对照者PD-1 和PD-L1 阳性率约6% 和5%[8-13],本研究结果显示,PD-1 和PD-L1 阳性表达率明显高于健康对照患者,BCR-ABL 阴性的骨髓增殖性肿瘤患者存在PD-1 和PDL-1 的过度表达。但低于文献报道的PD-1 和PDL-1 阳性率约50% 和55%[13]。主要原因有:⑴文献报道的检查方法较敏感,通过血液标本检测相对于病理活检标本经过福尔马林固定、脱钙和烘烤制片后,抗体被破坏得较少。下一步将考虑用未经过福尔马林固定的骨髓标本做免疫组化检查;⑵本研究病例的数量较少,下一步研究将扩大病例数,并添加治疗组和健康对照组,将资料进一步完善。
通过对BCR-ABL 阴性的骨髓增殖性肿瘤患者的临床特征研究发现,PD-1 和PD-L1 的表达和患者的临床危险程度分组呈正相关,提示PD-1 和PD-L1高表达的患者危险程度越高,与PD-1 和PD-L1 在其他肿瘤,如膀胱癌、肺癌等研究结果相似[8];患者的年龄、性别与PD-1 和PD-L1 表达情况差异无统计学意义,表明PD-1 和PD-L1 阳性表达与患者年龄、性别等方面无明显相关性,与其他一些研究结果相似[9-10]。
4 结 论
本研究提示,PD-1和PD-L1在BCR-ABL阴性的骨髓增殖性肿瘤患者中呈高表达,本研究结果为进一步揭示BCR-ABL 阴性的骨髓增殖性肿瘤的临床发病机制提供了基础。

