新型类过氧化物纳米酶NC@MIL-100(Fe)的制备及其对生物硫醇的测定
王佩瑶,张凌怡,张维冰
(华东理工大学 化学与分子工程学院 上海市功能性材料化学重点实验室,上海 200237)
天然酶在自然界中发挥着非常重要的作用,但其制备成本高、储存条件严格,具有一定的局限性[1]。纳米酶是具有类似天然酶催化活性的无机纳米材料,作为新一代的人工酶,具有成本低、稳定性好等优点,弥补了天然酶的不足,成为近年来的研究热点。自2007年Fe3O4纳米粒子作为过氧化物酶的模拟物被发现以来[2],大量基于纳米酶的研究不断涌现。典型的纳米酶包括碳纳米材料(如碳纳米管、氧化石墨烯、碳量子点),金属纳米粒子(如Ag、Au、Pt、Pd),金属氧化物(如Fe3O4),金属有机框架材料(Metal organic frameworks,简称MOFs)及各种复合材料等。纳米酶已被运用在越来越多的领域,如对离子、分子、癌细胞等的检测,对环境污染物的处理,在抗菌、抗癌、抗氧化方面的应用等[3]。
MOFs 是由金属离子/簇与有机配体配位而成的多孔材料,具有大量的活性位点,研究表明MIL-53、MIL-88、MIL-100 和MIL-101 等MOFs 具有良好的催化活性[4]。如MIL-53(Fe)被证明具有类过氧化物酶活性,在H2O2的存在下可以催化3,3′,5,5′-四甲基联苯胺(TMB)和邻苯二胺(OPD)的氧化,并实现对H2O2的比色检测[5]。MOFs 材料具有良好的类过氧化物酶活性,Valekar 等[6]使用N,N,N',N'-四甲基-1,4-丁二胺(TMBDA)将MIL-100(Fe)功能化后与胆碱和乙酰胆碱特异性酶结合,成功地检测了牛奶和血清中分别存在的胆碱和乙酰胆碱。Xu等[7]采用微波辅助法合成了Fe3O4@MIL-100(Fe),证实该材料具有良好的类过氧化物酶(POD)和过氧化氢酶(CAT)活性,发展了简单有效的谷胱甘肽比色检测法,该方法的线性范围为1 ~45µmol/L,检出限(LOD)为0.26µmol/L。
碳纳米材料作为典型的类酶材料,成为纳米酶研究的热点。Song 等[8]合成了羧基修饰的氧化石墨烯(GO-COOH),并成功用于葡萄糖的检测。Zhang等[9]制备了ZIF-8-还原氧化石墨烯(ZIF-8-rGO)负载的双金属(AuPt)纳米颗粒,并作为一种新型的过氧化物酶模拟物用于H2O2的高灵敏度检测。Li等[10]将氮杂原子(N)掺杂到Q-石墨烯(QG)中,制备得到的碳基纳米酶具有高特异性的类过氧化物酶催化活性,其催化性能大大提高。煤系针状焦(NC)是以煤焦油、沥青及其重要馏分为原料[11]制成的固体炭材料,在显微镜下具有明显的针状纹理结构,片层状结构堆积整齐[12],其结构及组成与石墨烯相似,可用于制备特种炭素材料及其复合材料、超高功率电极[11]等。目前将石墨烯作为纳米酶的研究较多,然而并无基于针状焦的纳米酶的相关报道。考虑到针状焦的低成本及其与石墨烯的相似性,发展基于针状焦的新型复合纳米酶具有极大的应用潜力。
生物硫醇主要包括谷胱甘肽和半胱氨酸,在人体代谢中起着至关重要的作用。体液中这些低分子量硫醇的异常水平与一些疾病密切相关,包括糖尿病、癌症和心血管疾病等[13],因此发展谷胱甘肽和半胱氨酸的检测方法具有重要的生物学意义。目前已发展了各类材料用于生物硫醇的检测,如FeS2/SiO2[14]、MoS2@CoFe2O4[15]、Ru@G[16]、Fe3+[17]等。Liu等[18]利用灵芝多糖还原并功能化氧化石墨烯,并将得到的材料用于半胱氨酸检测,检出限为0.1µmol/L,线性范围为2 ~30µmol/L;Deng 等[19]制备了铁和氮共掺杂的石墨烯量子点,实现了复方氨基酸片中半胱氨酸的检测;Wu等[20]合成了石墨氮化碳并将其应用于血清样品中半胱氨酸的检测。
本文以针状焦为基底,利用其与MIL-100(Fe)间的静电相互作用制备了复合材料NC@MIL-100(Fe),对材料进行表征并研究了其类过氧化物酶活性。以NC@MIL-100(Fe)为纳米酶发展了谷胱甘肽和半胱氨酸的分析方法,优化了分析条件,并进一步应用于实际样品人血清中生物硫醇浓度的检测。
1 实验部分
1.1 试剂与仪器
煤系针状焦由鞍山热能院提供;均苯三甲酸(H3BTC)购于西格玛奥德里奇(上海)贸易有限公司;乙醇、硝酸、氯化钾购于上海凌峰试剂有限公司;精氨酸(Arg)购于上海百灵威化学技术有限公司;九水硝酸铁(Fe(NO3)3·9H2O)、30%过氧化氢(30% H2O2)购于国药集团化学试剂有限公司;谷胱甘肽(GSH)、二甲基亚砜(DMSO)、L-半胱氨酸(Cys)、甘氨酸(Gly)购于上海麦克林生化科技有限公司;无水乙酸钠(NaAc)、3,3′,5,5′-四甲基联苯胺(TMB)、氯化钠、氯化镁、乙酸(HAc)、L-组氨酸(His)、酪氨酸(Tyr)等其他氨基酸购于上海阿拉丁生化科技股份有限公司;健康人血清来自复旦大学附属中山医院;实验所用试剂均为分析纯;实验用水均为超纯水。
S-3400N 扫描电子显微镜(SEM,日本日立公司);JEM-1400 生物透射电子显微镜(TEM,日本电子株式会社);FT-IR 6700傅里叶变换红外光谱仪(美国尼高力公司);D/max2550VB/PC X 射线衍射仪(XRD,日本理学电机);UV-2550紫外-可见分光光度计(日本岛津公司)。
1.2 NC@MIL-100(Fe)的制备
将14.43 g Fe(NO3)3·9H2O 与5.04 g H3BTC 溶于36 mL 水中,超声1 h,随后转移至反应釜中160 ℃下反应12 h,之后加水在70 ℃下搅拌3 h,再加乙醇在65 ℃下搅拌3 h以洗去杂质。最后将所得材料置于50 ℃真空烘箱下过夜烘干,得到MIL-100(Fe)[21]。
称取500 mg针状焦,倒入60 mL浓硝酸,60 ℃油浴下搅拌7 h,水洗至中性后置于50 ℃烘箱过夜,得到酸化后的针状焦。
将7.21 g Fe(NO3)3·9H2O与2.52 g H3BTC溶于18 mL水中,取25 mg酸化后的针状焦溶于50 mL水。将以上两种溶液分别超声1 h,之后将两者混合搅拌1 h,转移至反应釜中150 ℃下反应15 h。反应完成后,将材料离心,之后加水在70 ℃下搅拌3 h,再加乙醇在65 ℃下搅拌3 h,洗去杂质。最后将所得材料置于90 ℃烘箱下过夜烘干,得到NC@MIL-100(Fe)。
1.3 NC@MIL-100(Fe)的类过氧化物酶活性研究
将4.8µL TMB(10 mg/mL)、100µL 30%的H2O2及20µL NC@MIL-100(Fe)(1 mg/mL)与0.2 mol/L的NaAc-HAc(pH 3.6)缓冲液混合,使反应液总体积为1 mL。随后在37 ℃下孵育,用紫外-可见分光光度计检测其在500 ~800 nm 波长范围的吸收光谱,并考察其在652 nm 波长下的吸光度随时间的变化曲线。作为对比,针状焦和MIL-100(Fe)也在相同条件下测试。
在保持其他条件一致的情况下,考察了不同的H2O2浓度(0.1 ~5 mmol/L),TMB浓度(0.1 ~4 mmol/L),纳米酶质量浓度(2 ~100µg/mL)及孵育时间(5 ~30 min)下,反应体系在652 nm波长下吸光度的大小。
取20µL NC@MIL-100(Fe)(1 mg/mL),不同体积(1.2、2.4、4.8、7.2、9.6、12、16.8、24µL)的TMB溶液(10 mg/mL)与0.2 mol/L的NaAc-HAc(pH 3.6)缓冲液混合,37 ℃下孵育20 min,加入100µL 30%的H2O2使反应液总体积为1 mL,检测其在652 nm波长下的吸光度随时间的变化。将吸光度增加速率转换为催化反应速度v,并将v和底物浓度拟合到米氏方程,计算动力学常数Vmax和Km。米氏方程如下所示:
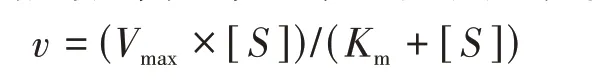
其中Vmax为饱和底物浓度下的最大反应速率,[S]是底物的浓度,Km是米氏常数。Km反映了纳米酶对其底物的亲和力,定义为最大速率一半时的底物浓度,Km越小说明材料对底物的亲和力越强。
以H2O2为底物时,取20µL 的NC@MIL-100(Fe)(1 mg/mL),不同体积(1、2、4、6、8、10、14、20 µL)的H2O2溶液(50 mmol/L)与0.2 mol/L 的NaAc-HAc(pH 3.6)缓冲液混合,37 ℃下孵育20 min,加入120µL TMB溶液(10 mg/mL)使反应液总体积为1 mL,其他步骤同上。
1.4 对生物硫醇的检测
将4.8 µL TMB 溶液(10 mg/mL),20 µL H2O2溶液(50 mmol/L),20 µL 的NC@MIL-100(Fe)(1 mg/mL),不同体积(0、0.6、1、2、3、4、5、6、7、8、9、10、11、12、14、16、18µL)的谷胱甘肽溶液(5 mmol/L)与0.2 mol/L的NaAc-HAc(pH 3.6)缓冲液混合,使反应液总体积为1 mL,37 ℃下孵育20 min,用紫外-可见分光光度计检测其在500 ~800 nm 波长处的吸收光谱。检测半胱氨酸时,则将谷胱甘肽溶液替换为不同体积(0、1、10、20、30、40、50、60、70、80、100、120、140、160、180µL)的半胱氨酸溶液(1 mmol/L),其他条件同上。
将4.8 µL TMB 溶 液(10 mg/mL),20 µL H2O2溶 液(50 mmol/L),20 µL NC@MIL-100(Fe)(1 mg/mL),20µL 浓度为5 mmol/L 的组氨酸(His)、谷氨酸(Glu)、色氨酸(Trp)、苯丙氨酸(Phe)、甘氨酸(Gly)、丙氨酸(Ala)、酪氨酸(Tyr)、赖氨酸(Lys)、脯氨酸(Pro)、天冬氨酸(Asp)、精氨酸(Arg)、Na+、Mg2+和K+溶液与0.2 mol/L 的NaAc-HAc(pH 3.6)缓冲液混合,使反应液总体积为1 mL。在37 ℃下孵育,并检测其在652 nm波长下的吸光度。
将4.8 µL TMB 溶 液(10 mg/mL),20 µL H2O2溶 液(50 mmol/L),20 µL NC@MIL-100(Fe)(1 mg/mL),健康人血清与0.2 mol/L 的NaAc-HAc(pH 3.6)缓冲液混合,使反应液总体积为1 mL 且最终人血清的浓度被稀释10 倍。在37 ℃下孵育,并在652 nm 波长下检测其吸光度。将吸光度变化值转化为浓度,即可得到人血清中生物硫醇的含量。加标实验分别将200µmol/L 和400µmol/L 的半胱氨酸加入上述反应体系中,使其最终浓度被稀释10倍,计算血清中生物硫醇的实际浓度和回收率。
2 结果与讨论
2.1 NC@MIL-100(Fe)的制备与表征
由于煤系针状焦表面基团较少,为了使MIL-100(Fe)顺利吸附,首先用浓硝酸氧化针状焦,在其表面引入羟基、羧基等基团。利用酸化后的针状焦与MIL-100(Fe)间的静电相互作用制备NC@MIL-100(Fe)具有成本低、一次制备产量较大、制备方法简单等优势。
采用扫描电镜(SEM)和透射电镜(TEM)对材料的形貌进行表征,结果如图1 所示。针状焦呈片层状结构,MIL-100(Fe)为直径约100 nm 的颗粒;而从NC@MIL-100(Fe)的电镜图可看出,基于针状焦的片层结构,MIL-100(Fe)能较为均匀地分布在其上,减少了MIL-100(Fe)的团聚现象。

图1 NC(A)、MIL-100(Fe)(B)、NC@MIL-100(Fe)(C)的SEM图及NC(D)、MIL-100(Fe)(E)、NC@MIL-100(Fe)(F)的TEM图Fig.1 SEM images of NC(A),MIL-100(Fe)(B),NC@MIL-100(Fe)(C)and TEM images of NC(D),MIL-100(Fe)(E),NC@MIL-100(Fe)(F)
图2A 为材料的XRD 表征结果。可看出针状焦在26.3°(002)[21]处出现了较强的衍射峰;MIL-100(Fe)在5.3°(333)、10.8°(428)、14.2°(088)、18.2°(7911)、24°(6618)和27.7°(9321)处出现了衍射峰,与文献报道一致[22];而在NC@MIL-100(Fe)中,MIL-100(Fe)的衍射峰均有出现,但针状焦的衍射峰并不明显,可能是因为MIL-100(Fe)较多的覆盖在针状焦的表面。图2B为材料的红外光谱图,针状焦中3424、1654、1631、1051 cm-1处的峰分别对应O—H、—C==O、—C==C、—C—O基团;MIL-100(Fe)中3417、1623、1574、1446、758、711 cm-1处的峰分别对应O—H基团和苯环[23];而在NC@MIL-100(Fe)中,针状焦和MIL-100(Fe)的特征峰均有出现。图2C为材料的N2吸附-脱附等温线,可得到针状焦、MIL-100(Fe)和NC@MIL-100(Fe)的BET比表面积分别为20.53、1354.92、912.38 m²/g。复合材料NC@MIL-100(Fe)仍保持了较大的比表面积。以上表征均证明NC@MIL-100(Fe)成功合成。
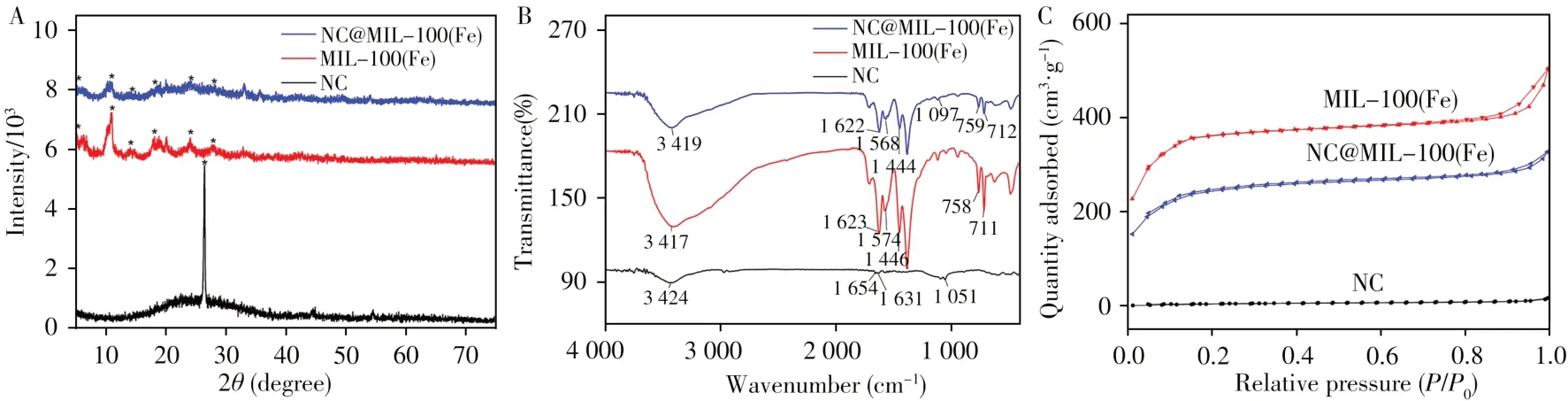
图2 NC、MIL-100(Fe)和NC@MIL-100(Fe)的XRD图谱(A)、红外光谱(B)和N2吸附-脱附等温线(C)Fig.2 XRD patterns(A),FT-IR spectra(B)and N2 adsorption-desorption isotherms(C)of NC,MIL-100(Fe)and NC@MIL-100(Fe)
2.2 类过氧化物酶活性研究
为了考察NC@MIL-100(Fe)材料作为纳米酶的性能,对其类过氧化物酶活性进行了研究。由于类过氧化物酶在H2O2的存在下可以催化TMB的氧化,使反应体系由无色变为蓝色,因此使用紫外-可见分光光度计对反应体系的吸光度进行检测,以吸光度的变化值为参数评价NC@MIL-100(Fe)的类酶活性。首先检测了相同条件下,针状焦、MIL-100(Fe)和NC@MIL-100(Fe)的吸收光谱及吸光度随时间的变化曲线。如图3A 所示,NC@MIL-100(Fe)在652 nm 下的吸光度明显高于单独的针状焦与MIL-100(Fe);图3B 显示在相同时间下,NC@MIL-100(Fe)吸光度的变化值最大,说明在单位时间内NC@MIL-100(Fe)的催化性能优于针状焦与MIL-100(Fe)。
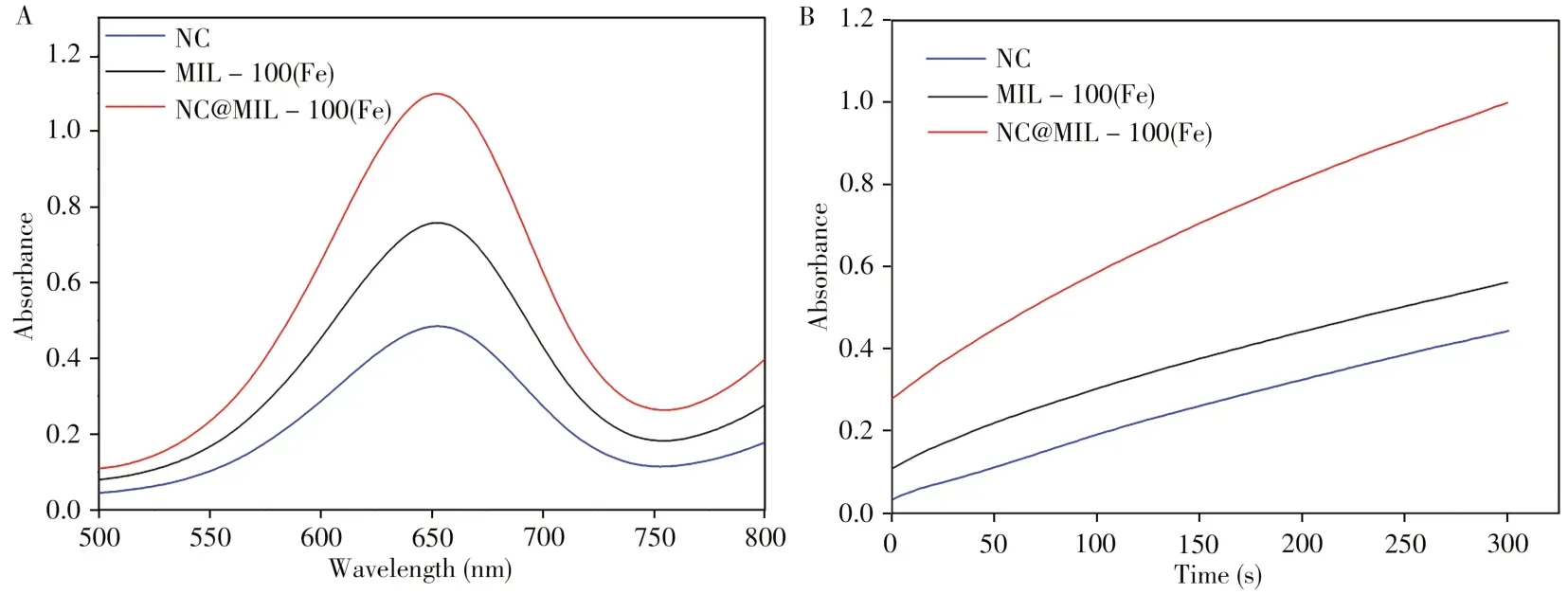
图3 NC、MIL-100(Fe)、NC@MIL-100(Fe)的紫外-可见吸收光谱(A)及吸光度随时间的变化曲线(B)Fig.3 UV-Vis absorption spectra of NC,MIL-100(Fe),NC@MIL-100(Fe)(A)and the curves of absorbance versus time(B)conditions:4.8µL TMB(10 mg/mL),100µL 30%H2O2 and 20µL NC@MIL-100(Fe)(1 mg/mL)
对纳米酶催化条件进行优化(图4),分别考察了其他条件不变时不同H2O2浓度、TMB 浓度、纳米酶质量浓度和孵育时间对反应体系相对吸光度的影响。结果显示催化反应的最佳条件为1 mmol/L H2O2、3 mmol/L TMB、80µg/mL NC@MIL-100(Fe)和20 min的孵育时间。

图4 不同的H2O2浓度(A)、TMB浓度(B)、纳米酶质量浓度(C)及孵育时间(D)对反应体系相对吸光度的影响Fig.4 The effect of different H2O2 concentrations(A),TMB concentrations(B),nanozyme mass concentration(C)and incubation time(D)on the relative absorbance of the reaction systemconditions:24µL TMB(10 mg/mL),20µL H2O2(50 mmol/L),20 min incubation time and 20µL NC@MIL-100(Fe)(1 mg/mL)
分别以TMB 和H2O2为底物,研究了各材料的类过氧化物酶催化动力学,结果见表1。经过对比发现,针状焦的Km和Vmax较小,说明针状焦对底物的亲和力较高,但催化反应速度较慢;MIL-100(Fe)的Km和Vmax较大,说明其催化反应速度较快,但对底物的亲和力较低;而不论是以TMB 还是以H2O2作为底物,NC@MIL-100(Fe)的Km值均介于针状焦与MIL-100(Fe)之间,且Vmax值大于针状焦和MIL-100(Fe),说明该材料结合了针状焦和MIL-100(Fe)的优势,对底物的亲和力较高且催化反应速度较快,具有良好的类过氧化物酶活性。
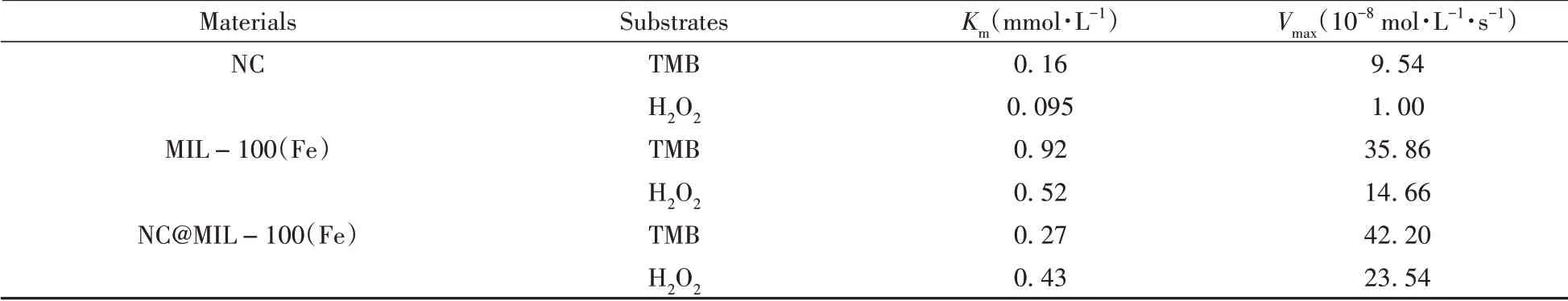
表1 各材料的动力学参数Table 1 The kinetic parameters of each material
表2列举了其他纳米酶和本文合成的纳米酶的催化动力学常数。在分别以TMB和H2O2为底物的情况下,与辣根过氧化物酶(HRP)相比,NC@MIL-100(Fe)的Km值比HRP小1.61倍和8.6倍,说明该材料比天然酶对底物的亲和力更强;与其他纳米酶相比,NC@MIL-100(Fe)也表现出较为优异的催化效果。
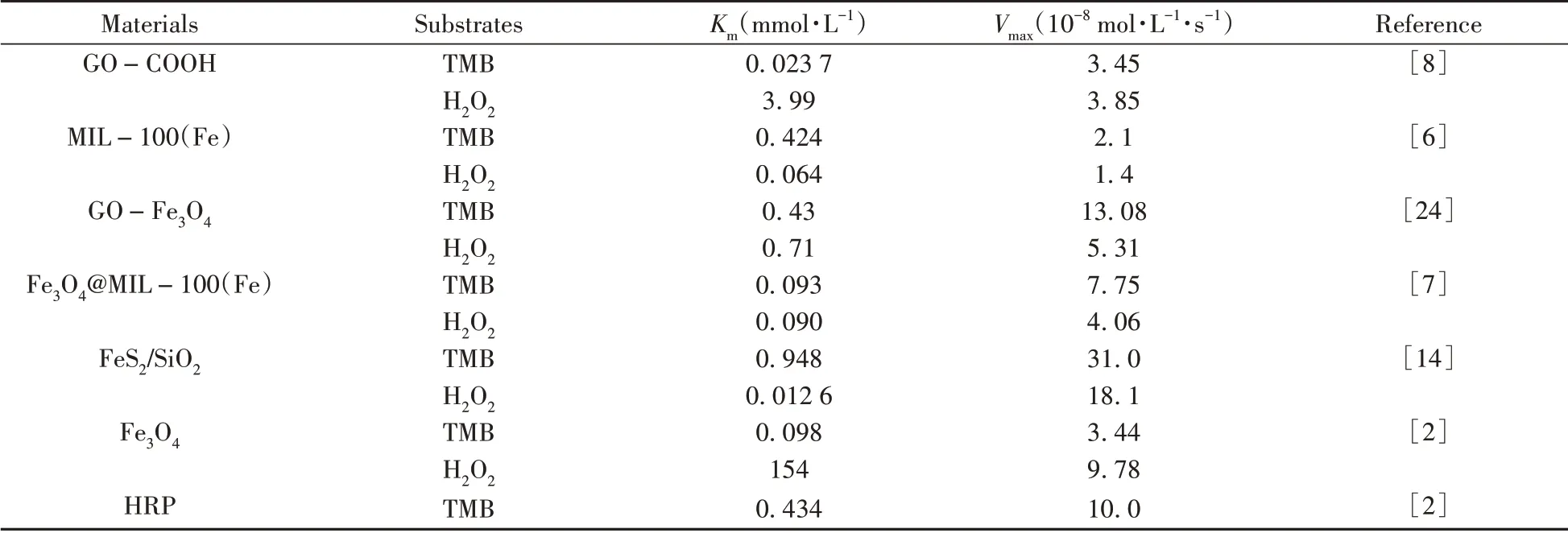
表2 各种纳米酶Km值与Vmax值的对比Table 2 Comparison of Km and Vmax value of various nanozymes
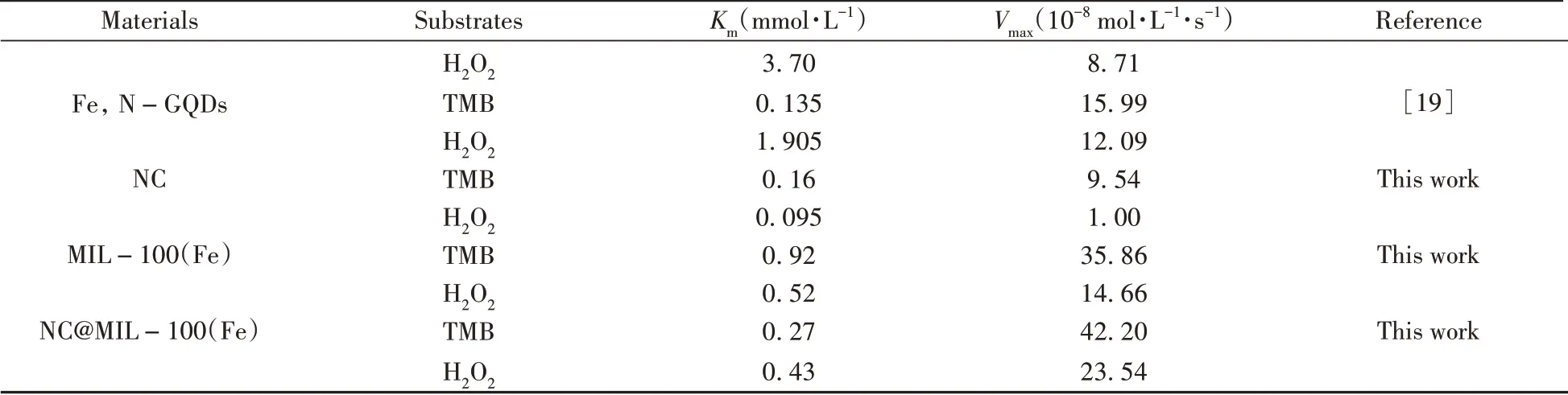
(续表2)
2.3 对生物硫醇的检测
基于NC@MIL-100(Fe)良好的类过氧化物酶活性,将其应用于谷胱甘肽和半胱氨酸的分析。由于谷胱甘肽和半胱氨酸含有巯基,加入反应体系后将与TMB竞争H2O2因被还原而产生的羟基[15],导致被氧化的TMB 含量减少,从而使反应体系的蓝色变浅。如图5A 和图5B 所示,随着谷胱甘肽或半胱氨酸浓度的增加,反应体系在652 nm下的吸光度逐渐减小。以吸光度的变化值(ΔA)为纵坐标,不同的谷胱甘肽和半胱氨酸浓度为横坐标绘制散点图(图5C 和图5D),发现在较高浓度下ΔA趋于饱和。在3 ~70µmol/L 范围内ΔA与谷胱甘肽的浓度呈线性关系,方程为ΔA=0.0143cGSH+9×10-6(r2=0.998),检出限(LOD,3σ/S)为0.33µmol/L;在1 ~80µmol/L 范围内ΔA与半胱氨酸的浓度呈线性关系,方程为ΔA=0.0095cCys+0.0184(r2=0.998),LOD(3σ/S)为0.22µmol/L。

图5 加入不同浓度谷胱甘肽(A)和半胱氨酸(B)的吸收光谱及体系吸光度随两者浓度的变化值(C、D)Fig.5 The UV absorption spectra(A,B)and changes in absorbance(C,D)with different concentrations of GSH and Cysconditions:20µL H2O2(50 mmol/L),4.8µL TMB(10 mg/mL)and 20µL NC@MIL-100(Fe)(1 mg/mL)
表3为多种纳米酶检测谷胱甘肽和半胱氨酸的线性范围及LOD 值。相比其他材料,NC@MIL-100(Fe)检测的线性范围更宽,且LOD较小,是检测谷胱甘肽和半胱氨酸的良好材料。

表3 各纳米酶对谷胱甘肽和半胱氨酸的线性范围及LOD的比较Table 3 Comparison of the linear ranges and LODs of GSH and Cys detected by various nanozymes
2.4 反应体系的选择性
研究了其他氨基酸及离子对反应体系的干扰情况。加入浓度均为100µmol/L的谷胱甘肽、半胱氨酸及干扰物质,并检测反应体系的吸光度。由图6可知,包含谷胱甘肽和半胱氨酸的反应体系吸光度发生了明显变化,溶液褪色明显。以半胱氨酸为例,在几种干扰物质中,组氨酸、谷氨酸、色氨酸、苯丙氨酸、丙氨酸、精氨酸对反应体系具有一定的干扰,其浓度为100 µmol/L 时,相对误差为10.6% ~18.9%;其它组分的干扰较小,浓度为100µmol/L 时,相对误差为0.5%~8.3%,说明反应体系对谷胱甘肽和半胱氨酸的检测具有较好的选择性。但应注意的是,若检测过程中,反应体系内存在能被羟基自由基氧化的其他还原性物质,则该还原性物质也会与TMB 竞争羟基自由基,从而对生物硫醇的检测产生干扰。

图6 体系对GSH和Cys检测的选择性Fig.6 Selectivity of detection for GSH and Cysconditions:the interfering substance is 100µmol/L,and other conditions are the same as those in Fig.5
2.5 实际样品测定
由于人血清中半胱氨酸的浓度远高于谷胱甘肽的浓度[25],因此以血清中半胱氨酸为分析对象。检测结果如表4 所示,人血清中生物硫醇的浓度为178 µmol/L,测定的相对标准偏差为(RSD)为4.2%。向上述样品中分别加入200、400µmol/L 的半胱氨酸标准溶液进行加标实验,得到其回收率为94.5%~103%,RSD 为2.3%~2.4%。结果表明该方法在实际样品中的检测效果良好。但基于本方法的检测原理,如果样品中同时含有谷胱甘肽和半胱氨酸,则本方法不能实现两者的分别测定,仅能对其总量进行估测。

表4 NC@MIL-100(Fe)用于人血清中半胱氨酸浓度的检测Table 4 NC@MIL-100(Fe)for the detection of Cys concentration in human serum
3 结论
本文以针状焦为基底,通过其与MIL-100(Fe)间的静电相互作用制备了新型纳米酶NC@MIL-100(Fe),并应用于谷胱甘肽和半胱氨酸的分析。NC@MIL-100(Fe)不仅原料成本较低、使用量小、合成方法简单,且对底物的亲和力较高,催化反应速度较快。NC@MIL-100(Fe)作为性能优良的纳米酶,有望在生物样品分析和疾病诊断等领域发挥重要作用。
- 分析测试学报的其它文章
- Contents
- 典型石化区大气颗粒物中邻苯二甲酸酯的污染特征和暴露风险评估及影响因素分析
- Rapid Quantification of Evodiamine and Rutaecarpine in Evodia Rutaecarpa(Juss.)Benth.Using Supercritical Fluid Chromatography
- Determination of Brilliant Blue FCF and Erythrosine B in Beverage and Candy Samples Using In-situ Effervescence Assisted Microextraction Method Based on Acidic Ionic Liquid
- 超快速液相色谱-三重四极杆-线性离子阱质谱法同时测定桑寄生中多元活性成分
- 一种新型一氧化氮比率型近红外荧光探针的制备及应用

