早发型重度子痫前期合并胎儿生长受限影响因素分析
张果果 张 静 王 秋
河北省廊坊市人民医院(065000)
子痫前期是妊娠期特发性并发症,是导致孕产妇和围生儿死亡的重要原因之一[1]。临床将发病早于妊娠34周的重度子痫前期称为早发型重度子痫前期(EOSP),其具有发病早、程度重等,是产科面临的极具挑战性的问题[2]。当前国内外对EOSP发病机理尚未明确,既往研究表明[3],EOSP发病较早而胎儿脏器发育尚不完善,易导致胎儿生长受限(FGR)。有研究报道FGR可能是导致EOSP围产儿死亡的重要原因[4]。EOSP合并FGR直接影响母婴健康及妊娠结局。鉴于此,本研究回顾性分析了本院收治的80例EOSP患者,探讨EOSP合并FGR的相关影响因素,为临床预防和诊疗EOSP合并FGR提供参考。
1 资料和方法
1.1 一般资料
回顾性选取2018年1月-2020年2月在本院产科分娩的EOSP患者80例临床资料。纳入标准:①符合EOSP及FGR临床诊断标准[5];②入组时孕周20~34周;③单胎妊娠;④患者及家属签署知情同意书。排除标准:①多胎妊娠;②既往慢性高血压病史、糖尿病史、慢性肾脏病史、免疫系统疾病史等;③严重肝肾功能不全、血液系统疾病、恶性肿瘤等合并症等。本研究经本院伦理委员会审批。
1.2 方法
根据是否合并FGR将80例EOSP患者分为EOSP合并FGR观察组(n=23)和EOSP无合并FGR的对照组(n=57)。收集两组孕产妇年龄、剖宫产史、初产妇、规律产检、子痫前期史等一般资料;收集患者发病孕周、羊水情况、胎儿脐动脉收缩压与舒张压比值(S/D)、24h尿蛋白定量、D-二聚体(D-D)、血小板(PLT)、血尿酸(UA)、血红蛋白(HB)、碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)及乳酸脱氢酶(LDH)等指标;记录两组围产期并发症及围产儿结局。
1.3 统计学方法
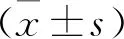
2 结果
2.1 两组一般资料
两组孕产妇一般资料无差异(P>0.05)。见表1。

表1 两组一般资料比较
2.2 EOSP合并FGR单因素分析
单因素分析显示,两组发病孕周、羊水过少、S/D升高、24h尿蛋白定量高、D-D升高、PLT减少、ALP降低、ALT升高、AST升高及LDH升高等指标均有差异(均P<0.05);两组年龄、孕前体质指数(BMI)、UA升高、HB降低等指标无差异(均P>0.05)。见表2。

表2 EOSP合并FGR影响因素单因素分析[例(%)]
2.3 EOSP合并FGR多因素分析
对单因素分析差异具有统计学意义的变量采用多因素logistic回归分析。结果显示,S/D、24h尿蛋白定量、D-D、ALT及LDH升高等均是EOSP合并FGR的独立风险因素(P<0.05)。见表3。

表3 EOSP合并FGR多因素logistic回归分析
2.4 妊娠并发症及围产儿结局
两组孕产妇妊娠期高血压(HELLP)综合征、心衰、肝功能异常、胎盘早剥、胸腹水、眼底血管病变等并发症发生率无差异(P>0.05);观察组妊娠期肾功能异常发生率高于对照组(P<0.05),新生儿体重(1.4±0.7 kg)、分娩孕周(32.4±4.5周)低于对照组(2.9±0.8 kg、36.9±4.6周)(t=7.769、3.999,均P=0.000),新生儿窒息及围产儿死亡发生率高于对照组(均P<0.05);两组围产儿胎儿窘迫、肺透明膜病、心脏发育不全、新生儿贫血、新生儿黄疸、败血症等围产儿结局无差异(P>0.05)。见表4。

表4 两组妊娠并发症及围产儿结局比较[例(%)]
3 讨论
目前关于EOSP的发病机理不明确,而且医学界对EOSP的孕龄界限尚未统一,国外学者普遍将发病时间早于孕34周的重度子痫前期视为EOSP[6]。大量临床研究表明[7],患有EOSP的孕产妇因全身小动脉生理病理学改变而使全身脏器血液灌注不足,微循环障碍导致组织缺血缺氧,从而严重影响胎儿的生长发育甚至威胁母婴生命。Permezel等[8]报道患有EOSP孕产妇并发FGR的风险更高,并认为EOSP并发FGR提示病情严重。Dai等[9]提出EOSP合并FGR造成胎儿发育不成熟而增加围产儿不良结局风险。如何根据影响EOSP合并FGR的风险因素评估母婴健康及指导诊疗尤为重要。
本研究分析发现,发病孕周、羊水过少是发生EOSP合并FGR的相关风险因素。EOSP发病孕周越早,胎儿发育愈不成熟,随着EOSP病情进展而持续影响胎儿生长发育,因而导致FGR的发生。羊水过少反映胎盘血流灌注不足而胎儿尿液形成减少,此外羊水过少也会增加新生儿窒息风险,因此是EOSP合并FGR的影响因素之一。但多因素分析显示发病孕周、羊水过少并不是EOSP合并FGR的独立风险因素,可能是由于发病孕周、羊水过少可综合影响FGR有关。本研究结果表明,S/D升高、24h尿蛋白定量高、D-D升高、ALT升高及LDH升高等指标与EOSP无合并FGR密切相关,且多因素分析表明上述因素为EOSP合并FGR的独立风险因素。分析认为:S/D升高提示胎儿在宫内脐血流异常,反映胎儿在宫内营养物质供应发生异常,从而影响胎儿正常发育[10]。蛋白质是胎儿生长发育主要营养物质,24h尿蛋白定量高反映大量蛋白质丢失,不仅影响胎儿发育且会造成孕母肾功能损伤、贫血等并发症,从而影响妊娠结局,与韩芳等[11]报道一致。D-二聚体升高往往表征孕母体内高凝状态、肾脏损伤等;李春英等[12]报道D-二聚体升高与FGR密切相关。本研究证实D-二聚体升高与EOSP合并FGR存在关联。ALT及LDH升高反映孕母肝功能异常及营养不良,直接影响胎儿生长发育,因此ALT及LDH升高是EOSP合并FGR的独立风险因素。
此外,本研究对EOSP患者妊娠合并症及围产儿结局进行分析表明,两组孕产妇妊娠期HELLP综合征、心衰、肝功能异常、胎盘早剥、胸腹水、眼底血管病变等并发症发生率无显著差异,观察组妊娠期肾功能异常发生率高于对照组,与有关研究[13]报道结果较一致。EOSP合并FGR会增加妊娠期合并症风险,尤其是肾功能异常的发生率大大增加。分析认为:ESOP合并FGR患者往往伴发较严重孕母小动脉痉挛病理学改变,持续的尿蛋白增加肾脏损伤,此外胎盘灌注异常也会降低孕母周身抵抗能力,因此EOSP合并FGR会增加肾功能异常风险。通过对两组围产儿结局分析表明,观察组新生儿体重、分娩孕周均低于对照组,新生儿窒息及围产儿死亡发生率高于对照组。提示EOSP合并FGR将导致早产的发生并影响新生儿出生体重。由于FGR影响胎儿宫内发育,导致新生儿出生时发育不成熟,因此增加了新生儿窒息及围产儿死亡风险。可见,EOSP合并FGR将造成不良妊娠结局。临床上可根据EOSP临床表现及生化指标改变正确评估母婴情况,制定个体化诊疗方案。若出现EOSP合并FGR则及时采取稳定病情干预措施,严密监护患者病情进展,并给予促胎肺成熟治疗,适时采取终止妊娠的治疗手段。
总之,本研究分析了EOSP合并FGR的独立风险因素,EOSP合并FGR可增加妊娠期孕妇合并症及围产儿不良结局风险。由于本研究采用回顾性分析,纳入样本量有限,对研究结果产生一定影响。后续仍需扩大样本量,采用多中心、前瞻性研究来证实研究结果的合理性。

