CalliSpheres载药微球治疗难治性乳腺癌肝转移患者的短期疗效和对肿瘤标志物的影响
李鑫,杨九霄,王友杰,张祖建,周石
(1.德阳市人民医院 介入科,四川 德阳 618099;2.贵州医科大学附属医院 介入科,贵州 贵阳 550004)
乳腺癌是女性最常见的恶性肿瘤,在女性恶性肿瘤中占比约30%。据统计,2020年女性乳腺癌新增确诊病例约230万例[1-2]。约50%的乳腺癌患者会通过血行转移、淋巴结转移等方式发生肿瘤扩散,常见的转移器官包括骨、脑以及肝脏,其中肝转移为5%~12%[3-4]。转移性肝癌发病隐匿,发现时多已晚期,无法采用根治性手术治疗,只能行局部姑息治疗,经动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是目前肝转移瘤局部姑息治疗的常用方法,其疗效确切[5]。CalliSpheres载药微球是一种新型的血管栓塞材料,研究发现采用其进行栓塞治疗(drug-eluting beads TACE,D-TACE)对转移性肝肿瘤具有较好的局部应答率[6],但目前有关CalliSpheres载药微球治疗肝转移瘤的报道多集中于结肠癌肝转移,而在乳腺癌肝转移方面的报道比较少,故本研究探讨D-TACE在难治性乳腺癌肝转移瘤治疗中的安全性、近期疗效及对肿瘤标志物的影响,以期为此类患者治疗提供参考。
1 材料与方法
1.1 临床资料
将49例难治性乳腺癌术后肝转移患者根据使用不同的栓塞剂分为观察组(应用CalliShperes载药微球行D-TACE治疗,n=21)和对照组(应用碘油行TACE治疗,n=28)。纳入标准:(1)肝转移确诊主要依据乳腺癌病史及经皮肝穿刺活检和(或)影像学检查;(2)经系统化疗或靶向药物治疗后,根据mRECIST评估肝脏肿瘤进展定义为难治性乳腺癌转移瘤;(3)已行乳腺癌根治术或改良根治术治疗;(4)肝功能为Child A或B级,总胆红素≤20 mol/L,白蛋白>25 g/L;(5)ECOG评分0~1分;(6)预期生存期>3个月。排除标准:(1)左心室射分数<40%;(2)患有严重不可纠正的肝肾功能障碍;(3)门静脉血栓、或癌栓形成,门静脉高压;(4)有出血倾向,其中血小板<50×109/L,凝血酶原活性<50%;(5)并发骨、脑等其他器官转移;(6)PS评分≥2分;(7)预计生存期<3个月。
1.2 方法
1.2.1器材 5F导管鞘及5F-RH、Yashior导管(泰尔茂公司,日本),COOK同轴导管系统(COOK,美国),CalliSpheres载药微球、8Spheres、罂粟乙碘油(江苏恒瑞医药公司)。
1.2.2CalliSpheres载药微球的制备 (1)用20 mL注射器抽出载药微球(1 g/瓶),竖直放置,待分层后去除上清液;(2)5%葡萄糖溶液5 mL溶解表柔比星60~100 mg;(3)载药微球与表柔比星溶液混合,载药时间>20 min,每5 min摇匀1次;(4)与非离子造影剂碘海醇注射液按1∶1与载药微球溶液混合,接三通管及1 mL注射器。
1.2.3手术过程 经股动脉入路,置入5F-穿刺鞘引入超滑导丝及微导管超选至靶血管,如肿瘤染色不明显,行锥形束CT(cone beam CT,CBCT)明确责任动脉。观察组根据病灶的大小选择合适粒径的载药微球(规格为100~300 μm、300~500 μm),必要时可用8Spheres(300~500 μm)补充栓塞;在透视下将配制好的载药微球以1 mL/min、脉冲式方法栓塞肿瘤血管床,观察造影剂流速判断栓塞的程度。对照组将表柔比星40~60 mg与适量罂粟乙碘油(最大量不超过15 mL)乳化,透视下栓塞供血动脉后,再予以适量明胶海绵补充栓塞。
1.3 观察指标及评价标准
1.3.1手术成功率 手术成功标准:栓塞完毕后行动脉血管造影,血供较丰富肿瘤无染色,乏血供肿瘤相应肝段无染色。手术成功率=(成功栓塞病例数/总病例数)×100%。
1.3.2术后3个月疗效 分析两组患者术前及术后3个月的腹部CT增强扫描图像,采用改良实体瘤临床疗效标准mRECIST[7]评价疗效,分为完全缓解(complete response,CR,所有目标病灶动脉期无强化)、部分缓解[partial response,PR,目标病灶(动脉期强化)的直径总和缩小≥30%]、疾病稳定(stable disease,SD,缩小未达PR、或增加未到PD)以及疾病进展[progressive disease,PD,目标病灶(动脉期强化)的直径总和增加≥20%、或出现新病灶]。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。
1.3.3肿瘤标志物水平 于手术前及手术后3月时取两组患者外周静脉血,采用酶联免疫吸附法测定血清血管内皮生长因子(vascular endothelial growth factor,VEGF)、癌胚抗原(carcinoembryonic antigen,CEA)。
1.3.4血液指标 于术前及术后1周抽取静脉血,检测两组患者的肝功能指标,包括谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBil)、白蛋白(albumin,ALB);血常规指标包括白细胞(white blood cell,WBC)、血小板(platelet,PLT)。
1.3.5安全性 比较两组患者出现的不良反应及并发症,采用美国国家癌症研究所制定的常见不良反应事件评价标准(CTCAE)4.0 版进行评价[8]。
1.4 统计学分析
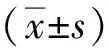
2 结果
2.1 一般资料
两组难治性乳腺癌术后肝转移患者的基线资料比较,差异无统计学意义(P>0.05)。见表1。

表1 两组难治性乳腺癌术后肝转移患者的基线资料比较
2.2 短期疗效
两组患者手术成功率100%。治疗后3个月,观察组ORR和DCR分值高于对照组,差异具有统计学意义(P<0.05)。见表2。

表2 两组难治性乳腺癌术后肝转移患者短期临床疗效比较[n(%)]
2.3 血清肿瘤标志物
两组难治性乳腺癌术后肝转移术前血清VEGF、CEA比较,差异无统计学意义(P>0.05);两组患者术后血清VEGF、CEA均低于治疗前(P<0.05),观察组治疗后血清VEGF、CEA均低于对照组,差异有统计学意义(P<0.05)。见表3。
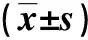
表3 两组难治性乳腺癌术后肝转移患者治疗前后血清VEGF、CEA水平比较
2.4 肝功能等血液学指标
与术前比较,两组难治性乳腺癌术后肝转移患者术后1周时静脉血AST、ALT、TBIL、WBC升高,而ALB降低,差异有统计学意义(P<0.05);而PLT变化不明显,差异无统计学意义(P>0.05)。见表4。
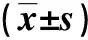
表4 两组难治性乳腺癌术后肝转移患者术后1周时手术前后静脉血AST、ALT、TBIL、ALB、WBC以及PLT比较
2.5 不良反应
两组难治性乳腺癌术后肝转移患者术后1周时患者术后不良反应为栓塞后综合征表现;而两组患者术后发热、腹痛、消化道反应比较,差异无统计学意义(P>0.05),予对症治疗后,症状明显缓解。术后所有患者均未出现肝肾功能衰竭、骨髓抑制以及胆管坏死等严重并发症,无与介入手术相关的死亡病例发生。见表5。
表5 两组难治性乳腺癌术后肝转移患者术后1周时患者术后不良反应比较[n(%)]
3 讨论
2020年国际癌症研究机构发布全球癌症数据:乳腺癌发病率超过肺癌,成为所有癌症发病率首位,严重威胁广大女性的身体健康。肝脏是晚期乳腺癌常见的转移器官之一,占50%~60%[9]。相关研究表明,相对于全身其他部位转移等因素,肝脏转移是影响晚期乳腺癌患者生存期的独立预测因素[10]。乳腺癌肝转移患者远期预后较差,中位生存期18~24个月,经治疗稳定后大部分患者1~2年内肿瘤仍会发生进展,5年生存率约27%[11]。与其他部位向比较,乳腺癌肝转移对放化疗反应较差,对于多线化疗或靶向治疗后的难治性肝转移瘤乳腺癌肝转移远期疗效更差。
根据ESO-ESMO国际晚期乳腺癌共识指南:对于仅有肝脏转移且一般状况较好的晚期乳腺癌患者,可以通过全身治疗联合局部治疗延缓肝脏肿瘤生长,从而延长患者的总生存期(overall survival,OS),提高患者的生活质量[12]。对于乳腺癌肝转移局部治疗方法包括局部手术、选择性体内放射治疗、经动脉导管栓塞术(TACE)、射频消融术以及微波消融术等。Ruiz等[13]报道,适合手术切除的乳腺癌肝转移,无论选择哪种手术方式(解剖型切除或非解剖性切除),手术治疗的效果均优于非手术治。刘瑞磊等[14]报道,乳腺癌肝转移患者采用消融治疗其疗效与外科手术治疗疗效相当,且具有微创、手术时间短、并发症低以及住院时间较短等优势。对于无手术切除或局部消融治疗指针的病人,TACE治疗能够为其提供一种有效的治疗方案,其原理是栓塞肿瘤供血血管导致其缺血坏死,最终达到杀死肿瘤细胞抑制肿瘤生长,其有效性及安全性已得到证实[15]。
近年来随着生物材料的创新,载药微球作为一种新的栓塞材料广泛应用于肿瘤的治疗[16-17],其主要作用是不仅精准栓塞肿瘤供血血管致肿瘤组织缺血坏死,又能作为载体在瘤体内缓慢释放加载的化疗药物,使瘤体内维持较高的化疗药物浓度,对肿瘤细胞进行持续性的杀伤,而外周血液中化疗药物浓度较低,患者不良反应发生率较低。CalliSpheres是我国独立自主研发的新型载药微球,与国外产品相比,具有易制备、载药速度快、栓塞效果好及可载多种药物等特点,尤其是在肝脏转移瘤中被广泛应用。王惠文等[18]报道,应用DEB-TACE对12例难治性肝转移患者治疗,术后3个月ORR、DCR分别为50%、91.7%,此与本研究术后3个月ORR、DCR分别为57.1%、90.4%相比较,两者疗效基本一致。Fiorentini等[19]报道,纳入74例结直肠癌肝转移患者,对比D-TACE与内科化疗的疗效,结果显示D-TACE组患者无进展生存期(progression-free survival,PFS)和总生存期均较放化疗组延长。以上两项研究进一步证实了应用 CalliSpheres载药微球治疗肝转移瘤的疗效确切,安全可行性。本研究结果表明,载药微球栓塞治疗肝转移瘤近期疗效明显优于碘化油。此外,Cucchetti等[20]表明D-TACE治疗能缩短术后住院时间,改善生活质量。
VEGF、CEA是临床常用的肿瘤标志物,其中VEGF能促进肿瘤新生血管的形成,在肿瘤形成和发育过程中起着重要的作用,能为肿瘤的复发转移评估提供一定的参考意义[21-22]。而CEA在乳腺癌、肝癌患者等多种恶性肿瘤中均有明显升高,能一定程度上反映出肿瘤的进展和转移情况[23-24]。本次研究中,两组患者经TACE治疗后,VEGF、CEA均低于治疗前(P<0.05),而观察组治疗后的VEGF、CEA均低于对照组(P<0.05)。提示相较碘化油栓塞,Callispheres载药微球栓塞治疗能更有效降低肿瘤标志物水平。Lin等[25]报道,23例难治性乳腺癌肝转移患者行D-TACE治疗,术中应用50~100μm粒径微球进行栓塞,术后3个月ORR83%、3例PR(57%)、6例SD(24%)、4例PD(17%),术后出现2例胆道坏死。本研究术后3个月ORR为84.5%、17例PR(53.7%)、7例SD(21.8%)、4例PD(14.6%),无严重并发症发生。两者相比较,局部疗效相当,但本研究未出现胆道坏死、感染,分析原因为Callispheres微球粒径>100 μm无法到达胆管毛细血管网,从而有效降低小胆管损伤。患者术后1周出现WBC、PLT、ALT、AST、TBIL指标上升,ALB指标下降,考虑为栓塞后肝细胞一过性损伤所致,术后予以积极保肝治。两组患者术后主要不良反应为栓塞后综合征表现,予以对症治疗后,明显缓解。上述表现分析原因为D-TACE通过提高肿瘤内部的化疗药物浓度,降低外周循环的药物浓度,进而减轻肝功能的可逆性损伤及术后严重不良反应的发生。
综上所述,Callispheres载药微球栓塞治疗对经化疗或靶向药物治疗后进展的晚期乳腺癌肝转移患者短期临床效果确切,能降低肿瘤标志物水平,安全性高,可能是治疗难治性乳腺癌肝转移较好的选择。但本研究样本量较小,远期疗效疗效不确切,还需大样本进一步研究。

