载药黏附性高分子水凝胶在创伤修复中的应用研究进展
王灵霜,肖波,杨潇
(西南大学蚕桑纺织与生物质科学学院 家蚕基因组生物学国家重点实验室,重庆 400715)
皮肤作为人体直接接触外界的最大器官,易受到外界机械性损伤,使得组织的完整性和功能性遭到破坏。遭遇创伤后组织会进行一系列复杂而有序的动态修复过程。纱布、绷带或海绵等传统伤口敷料通常只具备单一地吸收渗出物和物理屏障的简单功能,而促进愈合的能力较弱。理想的敷料不仅需要吸收伤口渗出物,保持伤口表面一定湿度,还需要避免伤口受到细菌感染,以及促进伤口愈合[1]。
用于创伤修复的黏附性高分子水凝胶是一类生物相容性良好的材料,且具有与人体细胞外基质相似的微环境、高含水量、高强度、高韧性等特点,是伤口敷料的理想选择。除了这些固有特性外,研究人员还开发了载药黏附性高分子水凝胶,能承载具有止血、抗菌、消炎作用的药物,加强创面治疗效果[2]。
高分子化合物根据来源不同可分为生物高分子化合物和合成高分子化合物。生物高分子化合物来源于自然界的动植物,如壳聚糖(chitosan)、丝素蛋白(silk fibroin)、明胶(gelatin)等。生物高分子化合物因其生物相容性好、可降解、可再生等特点而被广泛应用于伤口敷料研制[3-5]。合成高分子化合物是由小分子单体通过聚合反应形成的高相对分子质量化合物,常见的应用于医药行业的合成高分子化合物有聚乙二醇(polyethylene glycol)、聚乙烯醇(polyvinyl alcohol,vinylalcohol polymer)、聚 乙烯吡咯烷酮(polyvinyl pyrrolidone)等。相比于生物高分子,合成高分子有更加突出的力学强度,成为近年来伤口敷料的热门材料[6-8]。本文综述了以上6种常用载药黏附性高分子水凝胶的应用研究进展,介绍其用作创伤敷料时的黏附隔离、抗菌抗炎及愈合伤口的作用以及实现这些功能的策略。此外,还针对现存实际问题提出了该领域可能的发展方向。
1 生物高分子基载药黏附水凝胶
1.1 壳聚糖基载药黏附水凝胶
壳聚糖是广泛存在于自然界中唯一带正电荷的天然多糖,由乙酰化和去乙酰化的甘氨糖聚合而成。1859年,法国人Rouget将从动物甲壳中提取的甲壳素(chitin)放入氢氧化钾浓溶液中煮沸,首次获得壳聚糖;1934年,美国首次出现了关于壳聚糖制备的相关专利,并于1941年出现了由壳聚糖制备的手术缝合线及人造皮肤等医疗产品。此后,壳聚糖因其无毒、无味、无刺激性,且具有优良的安全性及生物相容性被广泛应用于医药领域。壳聚糖基于其固有的组织黏附性、抗菌性和止血性,是伤口敷料制备最常用的天然高分子。此外,壳聚糖中含有大量的羟基和氨基,便于进行化学修饰,有利于功能性高分子材料的开发[9]。
Ribeiro等[10]讨论了不同的脱乙酰度对壳聚糖成胶机制的影响,认为可以通过调节壳聚糖的脱乙酰度使其形成拥有多孔截面的黏附水凝胶,用其处理伤口时可快速吸收伤口渗出物并促进气体交换,是理想的载药伤口敷料。但单一壳聚糖作为伤口敷料时仍存在黏附力不足、力学性能差等问题,从而限制了其临床使用。复合型多功能化的壳聚糖伤口敷料成为目前的研究热点。
Zhang等[11]将壳聚糖与羧基改性后的聚乙烯醇交联,制备了一种新型壳聚糖水凝胶膜,用作创伤敷料。交联后的网状结构使水凝胶膜具有良好的水分子和氧分子透过性,可防止创面脱水;水凝胶膜在干燥和浸润状态下都表现出优异的黏附性能和力学性能,能有效覆盖伤口并防止创面溢出物积累;承载庆大霉素(gentamicin)后水凝胶膜能持续释放药物,有效抑制金黄色葡萄球菌(Staphylococcus aureus)和大肠埃希菌(Escherichia coli)的生长,促进伤口愈合。Du等[12]将咖啡酸改性的壳聚糖与疏水改性的壳聚糖乳酸盐结合,制备了一种新型改性壳聚糖基水凝胶胶黏剂。如图1所示,该水凝胶用作伤口敷料时展现出促进凝血、原位抗出血、抗感染等多种功能。此外,该水凝胶还能无缝合性地闭合创面,黏附组织后该水凝胶的黏附力可达8.2 kPa,爆破压力可达71 mmHg(1 mmHg = 0.133 kPa),并能有效递送药物、促进创面愈合。Lee等[13]研发了一种以壳聚糖为基础,结合银纳米粒子(silver nanoparticle)包裹表皮生长因子(epidermal growth factor)的复合水凝胶。糖尿病大鼠模型的伤口愈合实验结果表明,水凝胶能紧密黏附组织并提高药物递送效率。与其他治疗方法相比,该复合水凝胶能加快伤口闭合的速率,以及更快地恢复组织的完整性和功能性。

图1 改性壳聚糖黏附性水凝胶在伤口愈合中的应用[12]Figure 1 Application of modified chitosan-based adhesive hydrogel in wound healing
除了抗菌消炎,止血也是创伤修复中极为重要的一环。Zhou等[14]将碳酸钙掺杂到醋酸壳聚糖中形成创面敷料。醋酸壳聚糖吸水后,氢离子与碳酸钙反应释放钙离子,生成的钙离子和残余物碳酸钙与壳聚糖交联形成坚韧的水凝胶。体外实验结果表明,在醋酸壳聚糖中掺入碳酸钙后形成的水凝胶的力学性能和凝血性能均有提高;动物实验表明该水凝胶可以通过促上皮再生和胶原沉积来加速伤口愈合。
1.2 明胶基载药黏附水凝胶
明胶是一种生物高分子但并不直接存在于自然界中,它是存在于皮肤和结缔组织中的胶原水解后得到的。明胶相对分子质量分布较宽,且制备工艺、原料来源、杂质含量以及pH值等多种因素均会影响明胶的理化性质,因此其性能也具有多样性。现有研究已证实明胶具有良好的生物相容性、可降解性、可逆转变性、可修饰性以及黏附性等诸多优异性能,被广泛用作载药的伤口敷料[15]。
Abdalla等[16]采用京尼平法交联明胶水凝胶并装载乳铁蛋白(lactoferrin)功能化银纳米粒子,制备了一种抗菌伤口敷料,用于治疗创面感染。通过改变明胶浓度可对水凝胶的溶胀能力、力学性能和黏附强度进行调节,得到能紧密贴合创面并高效释放功能化纳米银粒子的水凝胶。该水凝胶对金黄色葡萄球菌和铜绿假单胞菌(Pseudomonas aeruginosa)均有良好的抗菌作用,可加速慢性创面愈合。明胶虽具有成膜能力,但由于机械强度低、热稳定性差,很少单独使用。提高聚合物材料性能的一种简单有效的方法是共混聚合物。Fan等[17]采用一锅法合成了明胶/聚丙烯酰胺(polyacrylamide)互穿双网络水凝胶。通过改变凝胶中明胶的含量,可以调节水凝胶的力学性能、溶胀性能和药物释放性能。更重要的是,该双网络水凝胶具有良好的黏附能力和合适的力学强度,其黏附强度高达570 kPa。释药实验结果表明,双网络水凝胶具有缓释特性,生理条件下大部分负载的模型药物可在24 h内释放。Mao等[18]以明胶为基础,添加了细菌纤维素(bacterial cellulose)和硒(selenium)纳米粒子,构建了一系列具有显著抗菌、抗氧化和抗炎功能的多功能纳米黏附水凝胶。该水凝胶具有优异的力学性能、良好的溶胀能力和生物降解性,同时还能紧贴伤口缓释硒纳米粒子,对常见细菌如大肠埃希菌和金黄色葡萄球菌及多种耐药菌均具有突出的抗菌活性。此外,大鼠全层缺损模型中的创伤修复实验证明该水凝胶能显著减少炎症反应,增强创面闭合、肉芽组织形成、胶原沉积、血管生成以及成纤维细胞激活和分化。
1.3 丝素蛋白基载药黏附水凝胶
丝素蛋白是存在于蚕丝中的一种天然高分子蛋白,占蚕丝纤维的70% ~ 80%,主要含有甘氨酸、丙氨酸、丝氨酸等18种氨基酸。目前,丝素蛋白已被广泛应用于各种生物材料的开发,包括薄膜、支架、海绵、人工纺丝纤维等。此外,基于丝素蛋白的水凝胶作为一种新开发的材料,具有良好的保水能力和类似细胞外细胞基质的特性,被认为是组织工程和再生医学最有前途的候选材料之一[19]。
Ju等[20]在丝素蛋白中添加海藻酸钙(calcium alginate)和羧甲基纤维素(carboxymethyl cellulose),制备了一种新型丝素基水凝胶。与医用纱布和胶黏剂的比较研究结果表明,该丝素基水凝胶具有最为合适的黏附力,既可以紧密黏附伤口,又不会因为黏附力过强对伤口造成二次创伤;丝素蛋白对细胞生长的促进作用能加速大鼠背部创面的胶原沉积和真皮形成。Tang等[21]在丝素水凝胶中引入了甲基丙烯酸(methacrylic acid)和光敏剂Ce6。用该水凝胶黏附创伤组织后,通过控制近红外辐射方式开启光动力疗法,再联合丝素水凝胶的巨噬细胞募集能力,有效地抑制了创面的金黄色葡萄球菌感染,从而显著增强伤口愈合的效果。
与大多数生物高分子材料相同,单一丝素制备的水凝胶在黏附力以及力学性能方面不能完全满足其在创伤敷料领域的应用。Liu等[22]在丝素分子上接枝多巴胺(dopamine)并与聚乙二醇交联,以增强水凝胶的黏附能力和力学性能。通过优化多巴胺的用量和凝胶化的程度,该水凝胶在干燥条件下的拉伸强度可达到(460.44±18.45)kPa,潮湿条件下拉伸强度可达到(503.32±16.54)kPa,黏合性能比临床使用的纤维蛋白密封剂更好。
2 合成高分子基载药黏附水凝胶
2.1 聚乙烯醇基载药黏附水凝胶
聚乙烯醇是一种有机化合物,其理化性质受化学结构、醇解度和聚合度影响。聚乙烯醇因其具有较高生物安全性成为药物输送和组织工程等领域广泛研究的合成聚合物之一。此外,聚乙烯醇作为一种黏弹性聚合物还具有生物相容性、可加工性、透明性和强黏附性等诸多特性,在伤口敷料中也被广泛应用[23]。
聚乙烯醇可以通过反复冻融的方法制备物理交联水凝胶,然而这种水凝胶普遍存在力学性能较差的问题,严重限制了其广泛应用。因此研究人员利用聚乙烯醇富含羟基的特性,在水凝胶网络中引入交联剂或利用互穿网络结构提升力学性能,以扩大其在创伤修复中的应用范围。Li等[24]采用“一锅法”将聚乙烯醇与聚丙烯酰胺结合,制备了聚乙烯醇-聚丙烯酰胺互穿网络水凝胶,在提高聚乙烯醇水凝胶机械强度的同时保留了聚乙烯醇水凝胶的黏附能力。测试结果表明该互穿网络水凝胶具有优异的黏附性能,最大黏附力可达3.14 kPa。将聚六亚甲基胍(polyhexamethylguanidine)抗菌剂引入该互穿网络水凝胶后,水凝胶既能无刺激地黏附于皮肤又可以达到优异的抗菌性能。Shamloo等[25]发现,采用冻融法制备聚乙烯醇水凝胶时,加入明胶、壳聚糖和蜂蜜能将水凝胶的极限拉伸强度增加约2倍。在大鼠背部创面愈合治疗中,水凝胶体现出了对伤口良好的覆盖能力和促愈合能力。Li等[26]将改性氧化石墨烯(graphene oxide)加入到聚乙烯醇溶液后,再反复冻融,制备了氧化石墨烯-聚乙烯醇杂化水凝胶。氧化石墨烯的无机网络渗透入聚乙烯醇的多孔结构中,显著地提高了水凝胶的力学性能,使其黏附力达400 kPa。此外,氧化石墨烯在550 nm光照射下可产生活性氧(reactive oxygen species),结合光热效应,仅需要10 min就能产生良好的抗菌活性,加速伤口愈合。近期,Hu等[27]基于贻贝水下黏附机制采用3,4-二羟基苯基丙氨酸对聚乙烯醇进行改性,制备了拥有优异生物组织黏附能力的聚乙烯醇-多巴胺黏附水凝胶,其黏附力可达39.0 kPa,能在大鼠湿润的口腔中黏附8 h不脱落。在加入装载地塞米松(dexamethasone)的聚乳酸-羟基乙酸共聚物(polylactic acid-glycolic acid copolymer)纳米粒子后,水凝胶表现出更持久的药物释放行为;相比于市面上的口腔溃疡贴,该水凝胶在治疗大鼠口腔溃疡的过程中展现出更优越的效果。
2.2 聚乙二醇基载药黏附水凝胶
聚乙二醇由乙二醇在高温高压条件下聚合而成,是一种两亲性聚醚。聚乙二醇具有较好的稳定性,与许多化学药品不发生反应且遇热不水解、不变质,不会刺激皮肤和眼睛,具有良好的生物相容性,目前已被美国FDA批准,成为被世界普遍认可的药用大分子之一。聚乙二醇具有可塑性,加入到片剂药物和创伤敷料中可提高药物释放的能力。此外,高相对分子质量的聚乙二醇也具有优秀的黏附性和吸水性,因此成为制备载药黏附水凝胶的热门材料[28]。
Masood等[29]以壳聚糖-聚乙二醇-硝酸银为基础,制备了一种能持续缓释纳米银颗粒、且具有优秀的体外抗菌和抗氧化能力的水凝胶。通过糖尿病家兔的创面愈合实验证明了该水凝胶具有较好的黏附性和较高的孔隙率,可隔离创面并持续给药;可促进糖尿病家兔的创面愈合,是一种非常有前景的创面愈合敷料。Sun等[30]制备了一种聚多巴胺(polydopamine)纳米颗粒偶联四臂聚乙二醇水凝胶。该水凝胶可在喷涂后通过酰胺化反应快速固化;通过聚多巴胺纳米粒子传递活性氧,并诱导光热效应杀菌;此外,该水凝胶还可提供亲水表面防止伤口感染,有望用于大面积急性创面或不可见出血部位的封闭,保护创面免受病原菌感染,其机制如图2所示。
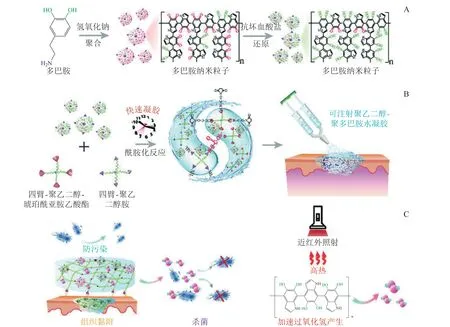
图2 聚多巴胺纳米粒子偶联四臂聚乙二醇水凝胶制备原理及创伤修复机制[30]Figure 2 Preparation principle of polydopamine nanoparticles coupled with four-arm PEG hydrogel and its wound healing mechanism
2.3 聚乙烯吡咯烷酮基载药黏附水凝胶
聚乙烯吡咯烷酮是乙烯吡咯烷酮通过本体聚合得到的一种非离子型高分子化合物,在常温常压下稳定,且具有优秀的生理惰性,对人体皮肤黏膜无任何刺激,在人体内不参与任何新陈代谢。目前因其具有优良的成膜性、黏结性和凝胶作用,被广泛应用于组织工程、药物控释和伤口敷料等领域。尽管聚乙烯吡咯烷酮在这些领域的应用得到了广泛认可,但其机械性能较差,溶胀能力较低,一定程度上限制了应用。基于此,研究者通常将聚乙烯吡咯烷酮与多糖类物质混合以改善力学性能,以及提高其生物降解性[31]。
Poonguzhali等[32]采用浇铸的方法将聚乙烯吡咯烷酮、壳聚糖和纳米纤维素(nano-cellulose)溶液制备成一种新型高分子生物纳米复合水凝胶。结构表征显示,聚乙烯吡咯烷酮和壳聚糖的羰基、氨基和羟基之间存在氢键相互作用;当纳米纤维素加入共混体系中时,纳米纤维素中的羟基能与壳聚糖的氨基和羟基以及聚乙烯吡咯烷酮的羰基进一步形成额外的氢键,使聚乙烯吡咯烷酮-壳聚糖纳米复合水凝胶的组织黏附性能和力学性能得到很大的改善,热稳定性和溶胀性也得到了一定的提高。此外,水凝胶细胞相容性良好,对革兰阳性和革兰阴性病原菌均具有较好的抗菌活性,在载药创伤敷料领域具有潜在的应用前景。Archana等[33]采用共混法制备了聚乙烯吡咯烷酮-壳聚糖水凝胶,并在其中添加了氧化银纳米粒子。所制备的水凝胶可紧密贴合创面,黏附力达36.0 kPa,能保护创面不受感染并降低创面脱水的风险。该水凝胶可对纳米氧化银起到缓释作用,在成年大鼠背部创伤治疗研究中,表现出比纱布更好的促伤口愈合性能。Lima等[34]以聚乙烯吡咯烷酮、聚乙二醇、琼脂和羧甲基纤维素为原料,制备了一种水凝胶基创面敷料膜,并将银纳米粒子分散在水凝胶基体中,再利用60Co γ-射线增强敷料的抗菌性能。所制备的水凝胶可无间隙贴合伤口,并具有高度的溶胀性,对银纳米粒子的粒径和释放也可起到良好的控制。课题组用该水凝胶治疗兔子背部创伤后进行组织病理学分析,结果表明水凝胶对伤口愈合有促进作用。
3 黏附性水凝胶常用载药
黏附性水凝胶作为一种创伤敷料,能起到物理隔离和保持创面湿润的作用。细菌感染是伤口愈合过程中最常见和不可避免的挑战。当伤口被感染时,细菌可能会在感染部位引起持续的炎症反应,这将延迟愈合的过程。面对创面修复的临床问题,黏附性水凝胶需要具备多重功能,这样的需求促进了载药黏附水凝胶的研究[35]。
根据承载药物类型的不同,可将载药黏附性水凝胶分为抗菌、抗炎及止血3种类型。止血发生在伤口愈合的最初阶段,所以具有止血功能的水凝胶对伤口愈合具有积极意义。研究表明,水凝胶的止血性能不仅依靠物理封闭,还通过吸收伤口渗出液富集凝血因子。带一定正电荷的高分子化合物(例如壳聚糖),可通过静电相互作用增强与生物组织的黏附,从而封闭创面达到止血作用。此外,一些金属离子也有激活止血通路的作用,如钙离子作为一种凝血因子,能促进血液凝固。
减少炎症反应也是创伤修复中极为重要的一环,严重的炎症反应往往会导致伤口愈合不成功,甚至可能导致败血症等并发症。因此在黏附水凝胶中添加抗炎药物也是极为有必要的,例如壳聚糖、蜂蜜等具有抗炎功效的成分能在水凝胶黏附创面后持续作用于创面,从而促进伤口愈合。
细菌感染是引起炎症反应的主要因素之一,因此在水凝胶中添加抗菌成分是目前的热门研究方向。黏附性水凝胶所承载的抗菌药物又可分为以下4类。一是所选用的材料本身具有抗菌作用,例如壳聚糖这一类聚阳离子化合物(cationic polymer),因其表面带有正电荷,容易吸附带负电荷的细菌,并进一步通过破坏细菌细胞膜杀死细菌。二是添加抗菌分子(例如抗生素、银离子、抗菌肽等),它们的加入可增强黏附性水凝胶的抗菌性能,同时水凝胶也对药物起到缓释作用并维持长时程抗菌。目前抗生素是临床治疗感染创面的首选,已有多种药物被包埋在水凝胶中制备抗菌创面敷料。此外,金属及金属化合物纳米粒子作为一种抗菌剂,同样也被广泛用于黏附性水凝胶中。据报道,金属纳米粒子的加入能有效减少伤口的细菌含量并减轻炎症反应,并且水凝胶中的聚合物可增强纳米粒子的分散,防止团聚。近年来,在黏附性水凝胶中加入光敏剂,通过近红外光的照射产生高温的光热疗法(photothermal therapy)或活性氧的光动力疗法(photodynamic therapy)备受关注。通过高温损伤或氧化应激,导致细胞成分的变性、氧化等,从而快速杀灭细菌[36-37]。表1总结了本文所述几种黏附性水凝胶的载药类型。
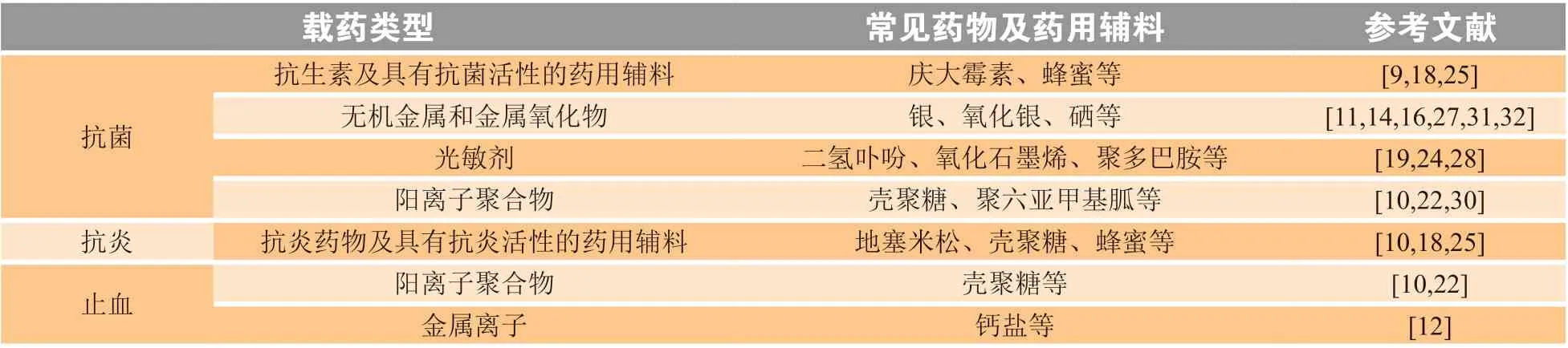
表1 载药黏附性高分子水凝胶中的常见药物及药用辅料Table 1 Common drugs and pharmaceutical excipients used in drug-loaded polymeric adhesive hydrogels
4 结语与展望
在近几十年中,黏附水凝胶成为伤口敷料中最具竞争力的候选材料。随着临床需求的不断深化和细化,黏附性水凝胶的功能从单一的伤口覆盖隔离转变为负载各种药物的多功能化水凝胶。本文综述了几种常见的基于高分子材料的载药黏附水凝胶,介绍了其黏附隔离、抗菌抗炎和愈合伤口的能力以及实现这些功能的策略。虽然此类水凝胶存在力学强度差、易断裂和难以除去等问题,但通过物理交联网络和添加纳米粒子等方法可以有效增强水凝胶基体强度。此外,创伤修复的过程面临诸如细菌感染、创面愈合和疤痕产生等问题。为此,进一步将药物与水凝胶结合所构建的多功能敷料为解决这些瓶颈问题创造了可能。不仅如此,新开发的金属或金属氧化物纳米粒子、光敏剂和抗菌肽等功能成分也逐渐被添加于黏附性水凝胶中,从而获得新型多功能敷料体系,这类新型多功能黏附性水凝胶有望在临床获得更广泛的应用。

