基于人血清白蛋白的药物递送系统研究进展
陈重,野庆松,吴锦慧
(南京大学医学院,江苏 南京 210093)
近几十年来,各种药物递送系统已得到广泛的研究。一些药物递送系统因具有提高药物溶解性、靶向性、半衰期,以及减少全身副作用等优势被应用于临床。常见的用于药物递送的材料有蛋白质、聚合物、脂质类、胶束等[1]。以人血清白蛋白(human serum albumin,HSA)为基础的药物递送系统因其可生物降解性、非免疫原性、生物相容性和较长的半衰期而受到越来越多的关注[2]。
HSA是肝脏合成的最丰富的内源性多功能血浆蛋白,在机体中的半衰期约为19 d。HSA作为血液中的天然运输载体,其能够在生理环境中可逆地与各种内源性物质和外源性分子结合,然后转运到各种组织。HSA的内部结合位点和表面活性基团使其能够同时携带多种治疗分子,从而实现联合治疗。这些表面活性基团也可以被配体修饰以提高HSA的靶向能力。此外,在温和的条件下,HSA能够通过多种方法被制备成不同大小的载药纳米颗粒。HSA的这些内在特性使其成为一种具有吸引力的药物载体,可用于递送各种治疗药物和诊断试剂。一些基于HSA的制剂已被FDA批准用于各种疾病,如癌症、糖尿病、血友病的治疗以及肿瘤成像等[3]。
本文综述了HSA的载药策略和HSA纳米颗粒的制备方法,以及HSA药物递送系统在临床中的应用情况,并对HSA制剂在治疗和诊断中的未来前景进行了展望。
1 人血清白蛋白的结构及结合位点
HSA是人血浆中最丰富的蛋白(35 ~ 50 g · L-1),占血浆总蛋白的40% ~ 60%。它由肝实质细胞合成,在血浆中的半衰期约为19 d。HSA是体内物质(如脂肪酸、激素、胆红素、脂溶性维生素等)运输的重要载体,此外,它还能运输体内大多数脂溶性药物,从而可提高药物在血浆中的溶解性和半衰期[4]。因此,HSA作为一种药物载体被广泛应用。
HSA由585个氨基酸组成,相对分子质量约为66 500。在结构上,HSA由3个结构相似的结构域组成:结构域Ⅰ、结构域Ⅱ和结构域Ⅲ(见图1)。每个结构域又进一步细分为子结构域A和B。根据HSA的结构,其主要有2个对多种分子具有高亲和力的多配体结合位点,分别称为Sudlow位点Ⅰ和Sudlow位点Ⅱ。此外,还鉴定出9个脂肪酸(fatty acid,FA)结合位点(其中2个与Sudlow位点重合)。HSA还具有4个金属结合位点,分别称为N端结合位点(N-terminal binding site,NTS),34位半胱氨酸(Cys34)位点,金属结合位点(metal binding site,MBS)-A和MBS-B(位置未知),它们能够结合不同的金属离子[5](见表1)。
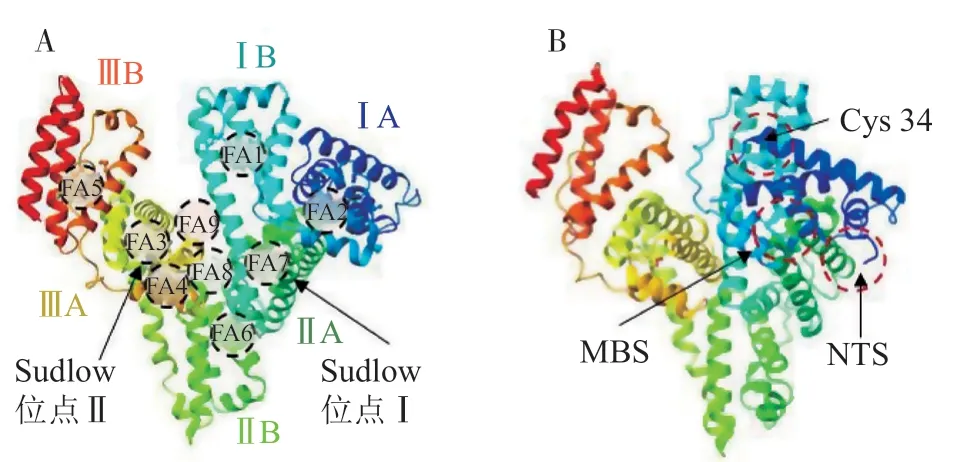
图1 人血清白蛋白结构示意图及相关结合位点的位置Figure 1 Schematic diagram of human serum albumin structure and locations of the related binding sites
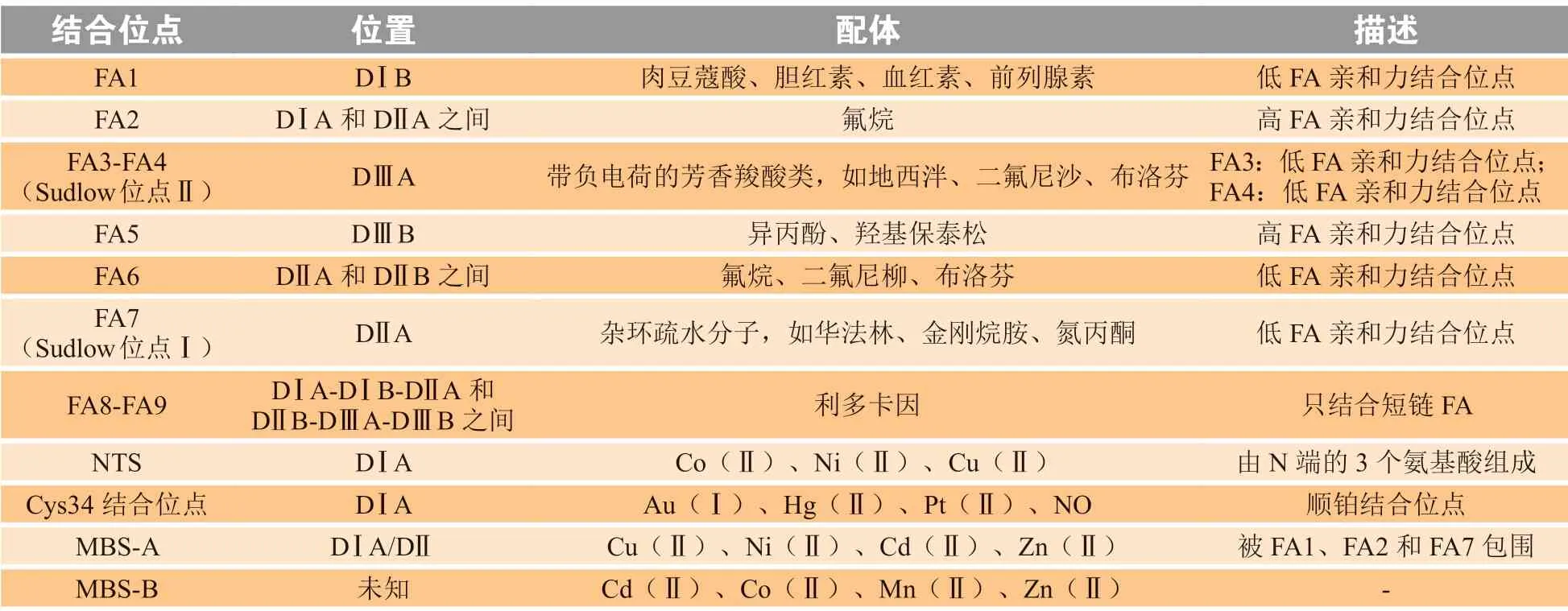
表1 人血清白蛋白结合位点的分布情况Table 1 Distribution of binding sites of human serum albumin
2 人血清白蛋白的载药方式
在各种药物递送系统中,HSA药物体系因其可生物降解、非免疫原性、半衰期长等特点,被广泛应用于小分子化药、多肽、蛋白、核酸等多种治疗药物的递送。HSA能够以单分子的形式载药,如将治疗药物通过非共价、共价、基因融合的方式连接到HSA分子上,也可以通过制备成纳米粒子的形式载药。
如前所述,HSA具有2个多配体结合位点,9个FA结合位点和4个MBS。非共价连接就是利用HSA的这些固有的结合位点连接药物。在这种载药方法中,选择适合的连接基团和连接位点对延长药物的半衰期尤为重要。共价连接可形成一种更稳定的HSA-药物复合物。理论上,每个HSA分子含有1个N端羧基、1个Cys34和全部的赖氨酸残基(59个)可用于连接药物。但在HSA表面连接过多的分子会改变HSA的天然性质,使其迅速从血液循环中清除[6]。因此,药物与HSA连接的比例对药效非常重要。化学方法常用于制备小分子药物-HSA偶联物,而基因融合主要用于递送蛋白质和肽类,其基本原理是将HSA基因与目的基因融合,然后表达目的蛋白/肽-HSA偶联物。虽然这种方法提高了蛋白质和多肽的治疗效果,但融合HSA依然降低了其对HSA受体的结合能力,从而降低体内循环半衰期。因此,通过改造HSA的结构,使其与HSA受体具有更好的亲和力可能是延长融合HSA半衰期的一种有前景的策略。以上制备HSA-药物结合物的主要缺点是载药效率低,适用性有限,因为每个HSA分子只能连接少量药物分子,并且HSA的载药能力很大程度上受限于药物的理化性质。因此,还可以将药物包裹在HSA内制备成HSA纳米颗粒[7]。该载药方法的适用性广泛,可用于各种不能与HSA非共价/共价连接或进行基因融合的治疗性分子,还可以包裹多种药物进行联合治疗。此外,制备的纳米粒子可以通过在表面修饰配体提高靶向能力。药物被包裹在HSA纳米颗粒中,直到在靶标部位被响应性释放,从而提高了治疗效果。
3 载药人血清白蛋白纳米粒子制备方法
迄今为止,人们已经开发了多种HSA纳米粒子的制备方法,如去溶剂法、乳化法、热凝胶法、自组装法、Nab技术等。这些制备方法已经被详细综述[8],在此不再赘述。总的来说,以上几种制备方法中,去溶剂法和乳化法都需要加入有机溶剂和交联剂,但有机溶剂的用量和种类不同。热凝胶法、自组装法和Nab技术都不需要交联剂,因为它们都是采用自交联的方法:首先,HSA分子内的二硫键分别通过加热、还原剂和高压均质展开;然后HSA分子内部以及分子之间重新生成的二硫键可以将HSA交联成纳米颗粒。
除了上述制备方法,笔者所在课题组一直致力于HSA制剂的开发[9-11]。课题组首次提出了一种绿色的“单水相”制备系统(single aqueous phase technology,Sap-technology)。该技术利用HSA的特性一步法制备了HSA纳米药物。简单地说,在最佳温度、离子强度、pH和超声强度下,将HSA溶解在水溶液中,然后将溶于乙醇的疏水药物滴入HSA溶液中,搅拌后将疏水药物包裹在HSA的疏水口袋中,经进一步纯化后冻干保存。不同于其他方法,该方法制备的药物-HSA可以形成复合物,而不是交联纳米粒子,没有二硫键的破坏和交联。在不破坏蛋白结构的基础上,将药物大量地装载到HSA内部,最大程度保留了HSA的天然性质。该制备方法简单,整个过程避免了毒性有机溶剂的使用,耗时短,可工业化生产。该技术已获得3项国际专利。课题组利用该技术实现了注射用HSA紫杉醇的连续、大规模生产,建立了一条符合国家GMP要求的HSA紫杉醇生产线。注射用HSA紫杉醇已在我国上市(国药准字:H20213539)。此外,HSA多西他赛(已进入临床试验阶段)和HSA雷帕霉素正在开发中。
4 人血清白蛋白在体内的调控
不同于其他载体,以HSA为基础的制剂在体内的循环和分布可能受到多种HSA结合蛋白(albumin binding protein,ABP)的共同调控。其他纳米制剂在体内的长循环只能通过不被肾脏滤过和不被网状内皮系统捕获来实现,是一种“被动”的长循环。而以HSA为基础的制剂可以通过与ABP结合而“获救”,这是一种“主动的”的长循环。此外,其他纳米制剂主要被动地跨内皮细胞进入目标组织,而以HSA为载体的药物可以通过ABP介导的跨内皮细胞转运到靶组织。几种ABP已被鉴定,包括细胞表面糖蛋白Gp18、Gp30、Gp60(albondin),一种酸性且富含半胱氨酸的分泌蛋白(SPARC),新生儿Fc受体(FcRn)和Cubilin/Megalin复合物。了解HSA与这些ABP相互作用的机制对于HSA制剂靶向给药至关重要(见表2)。

表2 人血清白蛋白结合蛋白的类型和分布Table 2 Types and distribution of human serum albumin-binding proteins
4.1 通过Gp60进行调控
Gp60是一种血管内皮膜蛋白,其相对分子质量为60 000。Gp60作用是介导体内天然HSA在内皮细胞的内吞,然后将HSA完整地运输到血管外空间而不受溶酶体降解。这种HSA运输机制约占人体内总HSA运输的50%。因此,以HSA为药物载体的优势在于其可完整地跨过内皮细胞,将药物运输到靶点[12]。现有研究认为,Gp60在肿瘤血管内皮细胞上大量表达,并介导了载药HSA在肿瘤的蓄积[13],但仍没有直接证据表明,药物-HSA复合物是否和天然HSA一样能够通过Gp60转运。因此,载药HSA的跨内皮转运并蓄积在肿瘤组织的机制还有待进一步研究。
4.2 通过Gp18/Gp30进行调控
Gp18和Gp30的相对分子质量分别为18 000和30 000。它们在多种细胞中表达,如巨噬细胞、成纤维细胞和内皮细胞。Gp60主要结合天然HSA并防止HSA被溶酶体降解;与其不同的是,Gp18和Gp30优先结合化学修饰的、氧化的、老化的、变性的HSA,并被胞内溶酶体进一步降解。这是一种去除损坏和有害HSA的安全保护机制[14]。因此,保留HSA的天然结构,防止其被Gp18/Gp30吞噬降解,对于维持HSA药物在体内的长循环非常重要。
4.3 通过SPARC进行调控
SPARC也被称为骨黏连蛋白,是一种位于细胞外基质的分泌性糖蛋白。其也在多种细胞中表达,如成纤维细胞和内皮细胞。与健康组织相比,SPARC广泛在恶性肿瘤细胞和肿瘤微环境中高表达。在多种癌症组织中,SPARC过表达提示预后不良,与生存期呈负相关。有文献表明,SPARC可以促进肿瘤对HSA制剂的摄取[15]。然而,临床试验和基因实验并没有显示出一致的结果[16]。因此,尚不清楚SPARC在载药HSA递送中的作用。
4.4 通过FcRn进行调控
FcRn最初被发现是因为它能够将IgG从母体转移到胎儿体内。此外,FcRn也参与保护HSA,使其不被溶酶体降解,在延长HSA半衰期方面起着关键作用。当HSA通过胞饮作用被内吞到早期核内体后,其与位于酸化核内体中的FcRn结合,然后被运送到细胞外以避免溶酶体降解[17]。与野生型小鼠相比,FcRn缺陷小鼠的血清HSA水平下降了30%~50%。因此,HSA制剂能否被FcRn结合并重新循环到细胞外决定了其在体内的半衰期。
4.5 通过Cubilin/Megalin进行调控
Cubilin和Megalin为内吞性糖蛋白,相对分子质量分别为460 000和600 000。它们共同实现了配体的内化,已被证实参与HSA、IgG等多种配体的胞吞和胞间运输。Cubilin和Megalin在肾脏主要负责多种物质的重吸收。由于HSA的流体动力学直径(约7.2 nm)小于肾小球滤过屏障(约10 nm),HSA可以被肾小球滤过进入肾小管并重吸收回血液。肾脏每天可以生成约180 L的原尿,这意味着至少7 kg的HSA在肾小管中被重吸收[18]。当Cubilin/Megalin表达不足时,近端小管表现出不同程度的HSA重吸收减少、血液HSA水平降低和尿蛋白升高。因此,通过Cubilin/Megalin受体介导,将HSA类药物转运至肾小管可能是一种潜在的治疗肾小管相关疾病的策略。
4.6 通过RAS突变诱导的巨胞饮进行调控
除了受体介导的转运外,HSA也可通过非特异性识别被肿瘤细胞摄取。巨胞饮是一种不依赖受体的液相内吞途径,在从细胞外液获取营养物质的过程中起关键作用。一般情况下,HSA在体内不被正常细胞作为能量物质吸收和代谢。然而,在RAS突变的肿瘤细胞中,HSA通过巨胞饮作用被摄取作为氨基酸来源,这是载药HSA在肿瘤中大量积累的重要机制[19]。RAS突变是最常见的癌症(尤其是胰腺癌、结肠癌和肺癌)相关基因突变之一[20]。这可能解释了Abraxane(HSA结合型紫杉醇)的临床适用范围。进一步的研究表明,肿瘤细胞的巨胞饮水平可以通过营养剥夺的方式上调,这增加了HSA药物在肿瘤中的累积并提高了治疗效果[21]。
5 基于人血清白蛋白的递送系统的临床应用
在过去的几十年里,HSA已成为最重要的多功能药物载体之一。如前所述,HSA递送系统具有的诸多优点,使其成为一种有吸引力的药物载体,被用于递送各种治疗药物和诊断试剂。一些基于HSA的药物制剂已被FDA批准用于临床。Abraxane是FDA于2005年批准的首个用于治疗癌症的HSA类化疗药物。该制剂通过Nab技术将HSA与紫杉醇制备成纳米颗粒,用于治疗乳腺癌、非小细胞肺癌和胰腺癌[22]。此后,用于治疗糖尿病和血友病以及成像的基于HSA的制剂陆续成功获批上市[23]。最近,基于Nab技术的第2款药物FararrotmTM也已于2021年上市,用于治疗局部晚期不可切除或转移的恶性血管周围上皮样细胞瘤。此外,大量HSA制剂的临床前和临床试验正在进行中(见表3)。

表3 已获批上市的基于人血清白蛋白的药物递送系统Table 3 The human serum albumin-based drug delivery systems approved for marketing
6 结语与展望
HSA递送系统具有良好的生物相容性、生物降解性和较长的半衰期。其有多种载药方式,如共价、非共价、基因融合、载药纳米粒子等。HSA表面的活性基团也可以通过多种靶向配体修饰来增强递送系统的靶向性和穿透能力。刺激敏感的HSA递送系统还可以在特定的内源性或外源性条件下分解并释放药物,减少药物在非靶器官的积累。因此,以HSA为基础的药物递送系统引起了广泛关注。它们正成为各种治疗药物(如小分子药物、蛋白质、核酸、成像剂等)的重要载体,显著提高了各种疾病的治疗效果。到目前为止,一些HSA制剂已被批准用于临床,还有更多的正在进行临床试验。
尽管HSA递送系统表现出许多独特的优点,但仍有一些问题需要解决。1)众所周知,高通透性和滞留效应(EPR)被认为在将纳米颗粒递送到实体肿瘤的过程中起着至关重要的作用,但一直存在争议。研究表明,在皮下和原位肿瘤模型中EPR效应确实能增强纳米颗粒在肿瘤组织中的积累,但在更接近人类癌症的转基因小鼠的自发癌症中,尚未观察到这种增强效应[24]。另一项研究表明,只有3% ~ 25%的纳米颗粒通过EPR效应渗入肿瘤组织[25]。因此,有必要进一步确定EPR效应对HSA纳米粒子摄取的贡献。2)Gp60主要负责体内天然HSA的转运,而载药HSA是否依然通过Gp60被摄取,并没有直接的证据。载药HSA(160 mg · L-1)在体内高浓度HSA(50 g · L-1)存在的情况下仍可在肿瘤中积聚而不被竞争性抑制[26]。因此,除Gp60外,载药HSA被转运的分子机制仍有待研究。3)HSA本身具有生物相容性和较长的半衰期,但HSA与药物结合、配体修饰、制备成纳米颗粒后是否会影响其正常生理行为,如被Gp60转运以及被FcRn结合并避免降解,目前还没有完全的答案。澄清上述问题对我们理解HSA制剂的生物学作用具有重要价值,也是进一步开发HSA递送系统的重要前提。
天然HSA在体内的运输和分布已被广泛研究,其半衰期约为19 d。但目前上市的HSA制剂尚未达到如此高的半衰期,说明HSA类药物与天然HSA在体内的运输方式不完全相同。因此,深入研究HSA与药物结合后HSA的结构变化、分布和运输,将对加快HSA类药物的研发起到关键作用。此外,结构改变的HSA也具有靶向递送药物的能力[27]。笔者所在课题组发现,不同于天然HSA,经诱导后结构变化的HSA具有靶向血小板的能力[28]。因此,通过调节HSA的结构来靶向不同位点可能是一个新的研究方向。基于HSA制剂的研究仍在继续,我们期待在不久的将来,更多新的基于HSA的治疗和诊断产品将被批准用于临床,造福患者。

