抗组织纤维化药物递送系统研究进展
王兴欢,邓文琦,邢磊,姜虎林
(中国药科大学药学院,江苏 南京 211198)
组织纤维化是慢性炎症期间组织损伤修复失调的结果,其进一步发展将导致器官功能下降、衰竭甚至死亡[1]。组织纤维化可以发生在身体的任何部位,如肝、肺、肾、心脏、血管、眼睛、胰腺、皮肤、骨骼等。在各种类型的纤维化中,肝、肺和肾纤维化的发病率和死亡率尤其高,严重威胁人类健康。组织纤维化的病理微环境十分复杂,当组织发生纤维化时,受损部位过度自愈,导致细胞外基质(extracellular matrix,ECM)大量沉积[2],其中的胶原发生共价交联,使纤维化基质更加稳定,难以降解和渗透;同时,成纤维细胞和巨噬细胞等被激活,释放多种炎症因子,加重炎症反应。复杂的纤维化病理微环境阻碍了药物的有效递送,降低了疗效。此外,目前用于治疗纤维化的药物存在生物利用度低、特异性差和副作用大等问题。为提高药物疗效,大量纳米药物递送系统和靶向治疗策略被学者们广泛关注。本文重点针对肝、肺、肾三大组织纤维化,综述了近年来用于纤维化治疗的药物递送系统和主动靶向策略,旨在为设计安全有效的抗纤维化药物递送系统,实现组织纤维化的高效治疗提供参考。
1 肝纤维化发病机制及治疗药物递送系统
肝纤维化是由多种因素(包括病毒感染、酒精滥用、自身免疫性疾病等)引起的慢性肝损伤。肝纤维化是一个动态且持续的过程,即肝细胞的持续坏死和细胞外基质的逐渐沉积,最终导致肝脏对损伤部位修复过度而形成瘢痕[3]。如果不加干预,肝纤维化会发展为终末期肝病甚至肝硬化[4]。肝硬化的死亡率很高,且往往会伴随某些致命并发症,如肝功能丧失、腹腔积液、门脉高压、食管静脉曲张和肝癌等。流行病学数据显示,肝硬化影响全球数亿人,是全球第14位常见疾病的死因[5-6]。因此,在肝纤维化阶段实施有效的干预以防进展到肝硬化尤为重要。目前治疗肝纤维化的药物包括肝细胞保护药物、肝星状细胞(hepatic stellate cell,HSC)活化和增殖抑制剂[7-8]、ECM降解剂[9-10]和中药[11-12]。
肝实质细胞、HSC和肝巨噬细胞在肝纤维化的进展中发挥着重要作用。其中肝实质细胞占肝细胞数量的60%,占肝脏体积的80%[13],承担着糖、蛋白质和脂质代谢,以及肝脏解毒等重要功能。肝纤维化会使肝实质细胞受损,严重影响肝功能。而肝星状细胞是肝实质细胞和肝窦内皮细胞之间的常驻肝非实质细胞,占肝细胞总量的5% ~ 8%,是产生ECM的主要效应细胞。一旦肝实质细胞发生凋亡或坏死,就会释放活性氧和其他纤维化介质,同时招募免疫细胞,进一步释放炎性细胞因子和趋化因子[14]。这一过程使肝脏中静息的HSC活化为肌成纤维表型,并刺激胶原的分泌。活化的HSC产生过量的ECM和组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMP),最终导致肝纤维化。另外,Kupffer细胞(Kupffer cell,KC)是肝脏的常驻巨噬细胞,可以分泌细胞因子导致HSC的激活和增殖。KC的激活会导致NF-κB通路活性增强,进而分泌多种促炎细胞因子,包括肿瘤坏死因子(tumor necrosis factor,TNF)-α和单核细胞趋化蛋白(monocyte chemotactic protein,MCP)-1等,最终导致HSC的激活和增殖[15]。其他调节纤维化产生和消退的细胞还包括NK细胞(natural killer cell)、T淋巴细胞(T-lymphocyte)、树突细胞等[16]。
1.1 肝实质细胞靶向药物递送系统
去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGP-R)是位于肝实质细胞表面的胞外糖蛋白受体,半乳糖是其特异性配体,半乳糖修饰的给药系统是一种常见的肝实质细胞靶向递送系统,可以选择性地靶向肝实质细胞,提高药物递送效率[17]。Mandal等[18]使用半乳糖修饰的载槲皮素脂质体(QC)来治疗砷诱导的肝纤维化。槲皮素有助于减少NaAsO2诱导的氧化损伤,对NaAsO2诱导的肝细胞损伤具有抑制作用。结果证明QC脂质体能改善肝实质细胞的药物蓄积,达到抗纤维化的效果,该研究验证了半乳糖在肝实质细胞靶向给药系统中的重要作用。Nair等[19]证明小干扰RNA(small interfering RNA,siRNA)与N-乙酰半乳糖胺衍生的ASGP-R配体结合有助于在体外和体内将siRNA靶向递送至肝实质细胞,疗效比未修饰的siRNA提高了5倍。此外,ASGP-R还可用于判断肝纤维化的程度和阶段,以便于精准治疗。Zhang等[20]证实,体内SPECT/CT成像和ASGP-R靶向示踪剂的定量,可用于预测纤维化治疗效果以选择更合适的治疗方案。尽管ASGP-R肝靶向药物的研究取得了许多成果,但由于ASGP-R的密度和结合活性会随着生理和病理条件的变化而改变,载体的靶向效果并不总能满足临床需要。因此,在研究ASGP-R介导的肝靶向药物时,有必要综合分析机体的生理和病理状况,密切考虑药物与载体材料的相互作用、体内物质对药物载体的影响等。
1.2 肝星状细胞靶向药物递送系统
HSC分布于肝小叶中,并含有人体约80%的维生素A(vitamin A,VA)[21]。视黄醇结合蛋白受体(retinol binding protein receptor,RBPR)在HSC表面过表达,利用RBPR可以选择性地将VA转运到HSC中[22],因此,基于VA修饰的载体被广泛用于HSC递送系统。Zhang等[23]将VA与低相对分子质量聚乙烯亚胺(polyethyleneimine,PEI)缀合,进一步与核苷酸结合形成纳米粒。这种纳米粒可以主动招募血浆蛋白并在表面形成蛋白冠,将负载反义寡聚核苷酸的载体靶向递送至HSC。Qiao等[9-10]开发了2种新型载体,将VA作为一种共递送系统,可协同抑制纤维形成过程中Ⅰ型胶原的积累。结果表明,2种共递送系统都具有特异的HSC靶向性,可以在纤维化肝脏中蓄积,有效地减少Ⅰ型胶原的生成,改善肝纤维化。Fan等[24]报道了VA和胶原酶共修饰的负载酪氨酸激酶抑制剂尼罗替尼的ECM穿透“纳米钻”胶束,可以消融胶原屏障,增强药物摄取和抗肝纤维化疗效。因此,VA是一种很有前途的配体,可用于靶向活化的HSC从而治疗肝纤维化。此外,HSC还表达甘露糖6-磷酸/胰岛素样生长因子Ⅱ(mannose 6-phosphate/insulin-like growth factor II,M6P/IGFII)受体,当HSC被激活时,该受体会上调,因此也可以作为一种潜在的靶向受体。Beljaars等[25]对M6P在白蛋白上进行不同比例的修饰,结果表明,随着M6P修饰量的增加,白蛋白在肝组织和HSC中的积累增加。此外,CD44受体在活化的HSC上特异性过表达。作为CD44受体的配体,透明质酸(hyaluronic acid,HA)和硫酸软骨素(chondroitin sulfate,CS)常被用于靶向活化的HSC。Li等[26]报道,负载水飞蓟宾的HA纳米胶束可以避免被巨噬细胞吞噬,同时选择性杀伤活化的HSC。Luo等[7]报道,CS纳米胶束可以作为一种靶向HSC、治疗肝纤维化的给药系统。值得一提的是,活化的HSC对CS胶束的摄取效率比相对分子质量相同的HA胶束更高[7]。此外,低相对分子质量HA还会通过Toll样受体4诱导组织损伤和炎症,促进纤维化的发展。因此在CD44受体靶向载体的构建中,HA相对分子质量的选择需要被关注[27]。
1.3 肝巨噬细胞靶向药物递送系统
巨噬细胞能特异性识别凋亡细胞发出的信号,如磷脂酰丝氨酸(phosplipid serine,PS)。PS通常位于细胞质膜的内小叶中,在细胞凋亡的早期阶段被转移到细胞质膜的外小叶,PS的暴露提供了一个“吞噬我”的信号,因此PS修饰的颗粒可以被巨噬细胞识别为凋亡细胞,增强载体靶向巨噬细胞的能力。Wang等[12]设计了一种PS修饰的脂质体,负载具有抗炎、抗氧化和调节胆固醇代谢作用的姜黄素。结果证明PS包被的脂质体具有高效的巨噬细胞靶向能力,提高了姜黄素的生物利用度和肝脏递送效率,从而缓解了肝纤维化[28]。此外,基于葡聚糖的材料,如酵母葡聚糖,可以通过病原体相关分子模式(pathogen associated molecular patterns,PAMP)被巨噬细胞识别并主动内化,已被用于向病变组织中浸润的巨噬细胞递送药物和显影剂。Zhang等[29]开发了一种以葡聚糖为基础的siRNA载体系统,用于靶向巨噬细胞的基因递送。葡聚糖壳和siRNA核心结构有助于在体外和体内有效地将基因递送到巨噬细胞,在蛋白质和mRNA水平上有效降低了巨噬细胞中巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)的表达。
2 肺纤维化发病机制及治疗药物递送系统
肺纤维化,尤其是特发性肺纤维化(idiopathic pulmonary fibrosis,IPF),是一种病因不明的慢性进行性间质性肺病,是各种肺部疾病发展的必经阶段,其发病率呈逐年上升趋势[30]。随着年龄的增长,IPF死亡率显著升高,其患者平均生存期仅为3年[31],且男性死亡率一直高于女性。IPF患者主要表现为长期不断咳嗽、痰液黏稠、肺实质瘢痕样改变和肺泡气体交换能力丧失等,最终因呼吸衰竭死亡。
随着肺纤维化病情的发展,肺泡上皮细胞受损,促进骨髓源性单核细胞增殖,进而分化为促炎巨噬细胞。肌成纤维细胞、上皮细胞和内皮细胞产生基质金属蛋白酶(matrix metalloproteinase,MMP),破坏基底膜,招募大量炎症细胞,包括中性粒细胞、巨噬细胞和嗜酸性粒细胞,产生多种细胞因子[TNF-β和白细胞介素(IL)-4、-13、-1β],促进损伤和修复过程[32]。炎症细胞因子的释放促进成纤维细胞和循环成纤维细胞分化为肌成纤维细胞,在损伤部位产生胶原[33]。在异常情况下,肌成纤维细胞分泌大量ECM,过表达的ECM充满肺泡,减少肺泡空间,导致患者呼吸衰竭,最终死亡[34]。迄今为止,美国FDA仅批准吡非尼酮和尼达尼布2种药物用于肺纤维化的治疗[35]。
2.1 巨噬细胞靶向药物递送系统
巨噬细胞作为肺部最丰富的免疫细胞(约占免疫细胞的70%),在肺纤维化的气道重塑中起着至关重要的作用[36]。根据局部微环境的不同,巨噬细胞表现出两种不同的表型——经典激活表型(M1)和代替激活表型(M2)[37]。M1巨噬细胞负责肺泡上皮损伤后的伤口愈合,而M2巨噬细胞则负责阻止伤口愈合过程和抑制肺部的炎症反应。M1巨噬细胞通过诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)产生反应性一氧化氮(nitric oxide,NO),并释放促炎细胞因子和趋化因子,如IL-1β、IL-12、IL-23、CCL2和TNF-α,促使静息的成纤维细胞转化为肌成纤维细胞,从而产生过量的ECM,破坏正常组织结构。而M2巨噬细胞通过产生抗炎细胞因子和趋化因子,如CCL17和CCL18等来抑制炎症和伤口愈合反应[38-39]。因此,通过靶向巨噬细胞改变M1和M2细胞的极化来影响疾病的持续时间和严重程度是一项可行的策略。Pan等[40]制备了靶向肺部巨噬细胞的脂质体,负载Sart1-siRNA,通过沉默Sart1阻断信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)6/过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)-γ信 号 轴 来抑制巨噬细胞的促炎极化,改善肺部的炎症浸润情况,显著保护小鼠免受博来霉素(bleomycin,BLM)诱导的肺损伤和肺纤维化。Liu等[41]合成了负载富马酸二甲酯(dimethyl fumarate,DMF)的活性氧(reactive oxygen species,ROS)响应性脂质体,其在高ROS环境中具有快速释放DMF的能力,可以通过激活巨噬细胞中的Nrf2-HO-1信号来抑制TGF-β和ROS的产生,从而减轻肺纤维化的发展。Chang等[42]开发了一种新型MMP-2反应肽(E5)修饰的工程脂质体(PNCE),E5是一条由氨基酸残基组成的直链,包含MMP-2特异性可切割序列和趋化因子受体(chemokine receptor,CXCR)4靶向部分,可特异性靶向CXCR4并在MMP-2过表达组织中断裂。负载了尼达尼布(nidanib,NIN)和秋水仙碱(colchicine,COL)的PNCE首先黏附在内源性单核细胞衍生的多能细胞(monocyte-derived multipotent cell,MOMC)上,然后借助MOMC的归巢能力有效地将纳米粒输送到IPF肺中,并在IPF组织中高表达的MMP-2响应下释放。在纤维化病灶内选择性积聚后,COL可以温和地调节M1巨噬细胞向M2巨噬细胞的极化,以平衡固有免疫反应,从而增强NIN对成纤维细胞活化的抑制作用,进一步改善IPF治疗。
2.2 肌成纤维细胞靶向药物递送系统
在肺泡损伤过程中,成纤维细胞和肌成纤维细胞在受损组织的修复中起着重要作用,肌成纤维细胞是损伤部位ECM的主要来源,将ECM作为支架,促进受损组织的修复和再生。在IPF的病理环境中,常驻成纤维细胞会分泌大量炎症因子,包括IL-1β、TNF-α、IL-10、IL-13和血小板衍生生长因子(PDGF)等,引起肺泡上皮细胞受损,外周纤维细胞在趋化因子高表达的情况下迁移到受损肺部[43],进一步刺激成纤维细胞分化为肌成纤维细胞,分泌大量ECM。Codullo等[44]合成了抗CD44功能化并负载伊马替尼的金纳米粒GNP-HCIm,一旦进入细胞,GNP-HCIm能够比游离药物更持久且有效地降低肺部肌成纤维细胞的活力和增殖,诱导细胞凋亡,改善BLM诱导的实验性肺纤维化。Chang等[45]合成了负载虾青素(astaxanthin,AST)和曲美替尼(trimetinib,TRA)的表面工程纳米粒,将其黏附在MOMC上,形成程序化疗法。由于MOMC的归巢特性,这些纳米粒可以直接靶向到肺部,并通过MMP-2响应性释放,释放的AST可以协同增强TRA抑制肌成纤维细胞激活的作用,MOMC也可以修复受损的Ⅱ型肺泡上皮细胞(AEC II),促进受损的肺再生。这种“搭便车”策略,可以实现精确的靶向递送。然而生物载体存在生产质量控制困难和递送过程容易失去活性等问题,导致制剂的生产、贮存和使用条件需要严格控制[46]。而且干细胞具有多向分化的能力,无法确保治疗结果完全符合预期,这些问题仍有待解决。
3 肾纤维化发病机制及治疗药物递送系统
肾纤维化是从慢性肾病(chronic kidney disease,CKD)发展到终晚期肾病的主要阶段,发病率和死亡率都很高[47]。肾纤维化的特征是肾小球硬化和肾小管间质纤维化。多项流行病学研究表明,全球CKD患病率约为8% ~ 16%,且呈逐年上升趋势[48]。肾纤维化治疗失败可能会导致晚期肾功能衰竭,最终需要透析或肾移植。目前,治疗肾纤维化的药物包括促纤维化因子抑制剂[49]、胶原合成抑制剂[50]和中药[51-52]。
ECM的大量产生和过度沉积是肾纤维化发生发展的主要事件[53]。过量的ECM产生的瘢痕组织仅能维持器官的完整性,这是机体对组织损伤持续修复的结果[54]。当正常组织被瘢痕组织取代时,会导致肾功能丧失[55]。随着ECM的持续沉积,肾小管和管周毛细血管丢失,最终导致肾功能障碍[56]。肾纤维化中沉积的ECM主要来源于肌成纤维细胞[57],当暴露于TGF-β1等促纤维化因子时,常驻成纤维细胞可转化为肌成纤维细胞[58]。其中关键的促纤维化因子包括TGF-β1、PDGF、成纤维细胞生长因子(fibroblast growth factor,FGF)、结缔组织生长因子(connective tissue growth factor,CTGF)和血管紧张素(angiotensin II,ANG II)。同样,促纤维化细胞因子和下游细胞之间的信号级联传导和基因表达也受多种微小RNA的调控[59]。
3.1 近端肾小管上皮细胞靶向药物递送系统
波形蛋白是一种中间丝状体,主要表达于发育的肾小管上皮细胞和再生的肾上皮细胞。Kers等[60]发现波形蛋白参与肾纤维化进展,可作为晚期间质纤维化和肾小管萎缩的标志物,因此靶向波形蛋白受体是将基因递送到肾脏的有效策略,Kim等[61]报道,N-乙酰氨基葡萄糖(N-acetylglucosamine,GlcNAc)修饰的PEI可与表达波形蛋白的细胞(如293FT和HeLa细胞)特异性相互作用以实现基因递送。这种基因递送系统还可用于靶向其他表达波形蛋白的细胞,如肾小管上皮细胞。基于此,Singh等[62]开发了一种基因递送聚合物载体PADPG,以阐明GlcNAc配体在基因递送中的有效性。结果表明,PADPG的高效转染归因于聚合物载体中的GlcNAc,这为靶向波形蛋白治愈CKD提供了可能性。
3.2 肌成纤维细胞靶向药物递送系统
肾成纤维细胞在肾纤维化进程中维持着间质基质和邻近组织的稳态。当被细胞因子、氧化应激等因素激活时,它倾向于分化为肌成纤维细胞表型,并有助于基质沉积[63]。因此,靶向肌成纤维细胞可有效抑制肾纤维化。Xu等[64]利用阳离子牛血清白蛋白(cBSA)来制造带正电的cBSA纳米粒,与带负电的miR-29b通过静电作用结合,得到纳米复合物(cBSA/miR-29b)。该纳米复合物能够克服miRNA的血浆半衰期短,以及脂溶性和膜通透性较差的特点,使纳米粒子更容易内化到肌成纤维细胞中。Poosti等[65]将聚乙二醇(PEG)化的干扰素(IFN)-γ与PDGF受体(PDGFR)β特异性环状肽结合制备了PDGFRβ识别肽(PPB)-PEG-IFN-γ,并在体内和体外测试了抗纤维化能力。结果显示,与游离的IFN-γ相比,该载体具有特异的肾肌成纤维细胞靶向性,并使纤维化进程明显减缓。Zhou等[51]用五肽cRGDfC修饰PEG化的脂质体,构建了负载雷公藤红素的脂质体。其中五肽cRGDfC对整合素αvβ3有很高的亲和力[66],而整合素αvβ3对间质肌成纤维细胞的特异性识别能够将药物靶向递送到肾间质肌成纤维细胞。结果表明,将cRGDfC连接到脂质体上可显著增加活化的肾肌成纤维细胞对雷公藤红素的摄取。Li等[52]根据纤维连接蛋白在纤维化肾脏中的高表达,用特异性结合纤维连接蛋白的五肽CREKA偶联脂质体,使其被肌成纤维细胞特异性内化。特殊肽段的靶向效果近年来受到越来越多的关注和研究,靶向效果不断得到验证,在药物递送领域和疾病检测方面都得到充分的应用。
4 结语与展望
近年来,随着组织纤维化分子机制的深入研究,许多抗纤维化药物不断被发现,并显示出较强的抗纤维化活性。然而组织纤维化的病理环境以及复杂的发病机制极大地限制了药物在体内的抗纤维化作用。因此,开发安全有效的抗纤维化药物递送系统是十分必要的。尽管组织纤维化治疗的靶向给药系统取得了很大进展(见表1),但仍然存在一些挑战,例如递送的药物种类单一、靶向性和渗透性低以及疗效有限等。鉴于目前的研究,笔者所在课题组有以下几点建议和考虑。1)由于组织纤维化发病机制复杂,单一靶点治疗难以达到预期效果,可以考虑多药协同递送共同抑制胶原分泌。但是需要考虑不同药物递送的协同性和序贯释药。2)胶原酶的修饰可以解决组织纤维化病理环境中ECM过度积累的问题,促进药物有效地渗透并递送至作用部位。但胶原酶有可能破坏机体其他正常的胶原组织,因而存在一定安全风险。3)利用细胞联合给药技术可以实现更有效的递送。比如利用干细胞的归巢效应或炎症趋向性,将药物携带至靶部位,不仅可以提高药物递送效率,还能有效修复受损细胞。不过,由于干细胞具有多向分化潜能,在体内是否会导致异位组织分化或癌变,以及干细胞分泌的细胞因子是否会加速纤维化的进展尚需进一步探讨。4)可以利用外泌体进行药物递送。外泌体具有生物相容性好、易于修饰等特点。使用工程化修饰的外泌体包载药物,不仅可以使其免受免疫系统清除,还能起到调节细胞通讯的作用,如促进巨噬细胞表型转变,下调促炎介质等。但是目前外泌体的生产和纯化方法缺乏标准和质量控制,并且外泌体的内容物和功能各不相同,使用之前需要进行判断和选择。总之,与传统药物相比,针对组织纤维化关键细胞进行靶向递送,可实现更精确、有效的纤维化治疗。
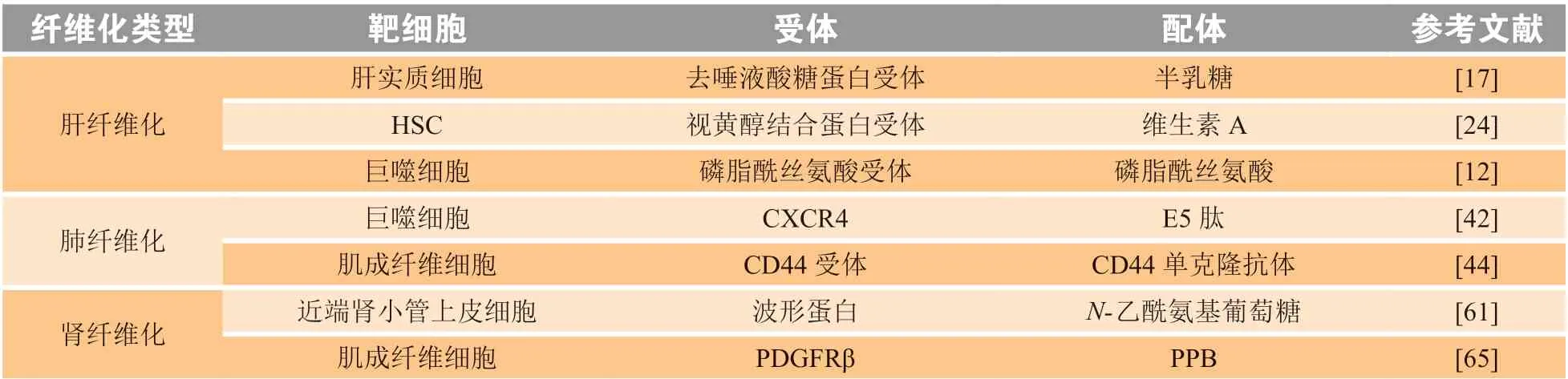
表1 治疗肝、肺和肾纤维化的代表性靶点汇总Table 1 Summary of representative targets for the treatment of liver fibrosis, lung fibrosis and kidney fibrosis

