皮肤微生态与皮肤疾病研究进展
杨沛峥,程宇豪,汤晓雷,管运才,胡一桥*
(1. 南京大学医学院,江苏 南京 210093;2. 江苏君隽生物科技有限公司,江苏 南京 210033;3.江苏中天药业有限公司,江苏 泰州 225316)
皮肤是人体最大的器官,总质量约占体质量的16%,成人皮肤面积约为1.2 ~ 2.0 m2,厚度约0.5 ~ 4 mm,其结构从内到外依次为皮下组织、真皮层和表皮层。皮下组织以脂肪为主;真皮层厚度约为0.2 cm,主要由胶原蛋白、弹性蛋白及成纤维细胞、巨噬细胞、肥大细胞组成;表皮层不含血管,包括角质形成细胞和树枝状细胞,最外层是由5 ~ 20层死亡细胞构成的角质层;角质层外部还覆盖有一层皮脂膜,包含水分、脂质和一些蛋白;此外,皮肤中还含有毛囊、皮脂腺、汗腺等附属器官,其组成和分布为体表微生物提供了多种生长环境。皮肤是仅次于肠道的人体第二大微生态系统,其中微生物数量约40万亿个[1],占人体共生微生物总数的16%(肠道占78%,其他占6%)[2]。每平方厘米皮肤上大约有10亿个微生物覆盖,主要分布在表皮层、皮脂膜、毛囊和腺体当中。另有研究表明,在真皮层甚至皮下脂肪中也有共生菌的存在[3]。皮肤微生物可按滞留时间的不同,分为常驻菌与暂驻菌;也可按细菌对宿主作用分为致病菌和非致病菌[4];而按丰富度排序,不同干湿度、不同部位的皮肤菌群丰富度也有所不同[4]。本文将概述介绍皮肤微生态的结构,并针对皮肤微生态引发的疾病及治疗对策展开介绍。
1 皮肤微生态系统概述
1.1 结构与分布
不同位置的皮肤由于皮脂含量、温湿度、褶皱等特征的不同,引起菌群分布的差异。面部、胸部和背部通常是油性皮肤,适合亲脂性的丙酸杆菌生长繁殖;葡萄球菌和棒状杆菌则优先在潮湿的皮肤上大量存在,如肘部的弯曲处;而足部则由马拉色菌、曲霉、隐球菌、红酵母和其他25种真菌组合定植[5]。不同种族的受试者在皮肤相同部位,其菌群是相似的[6],其中真菌群落稳定性较高,同一皮肤部位真菌间隔3个月检测无较大差异[7]。汗腺分泌的汗液会使皮肤酸化且含有可抑制微生物定植的抗菌分子,不利于某些微生物的生长和定植;皮脂腺分泌富含脂质的皮脂,会促进丙酸杆菌等亲脂类的细菌来定植;而温度和湿度都较高的区域会促进棒状杆菌和金黄色葡萄球菌等细菌的生长[4]。
表皮层中基底层到角质层的氧含量呈“富氧-乏氧-富氧”变化。由于表皮外层和内层分别与空气和丰富的毛细血管接触,表皮外层和内层均为富氧区域;而表皮层中心的棘层、颗粒层和角质层下部由于代谢耗氧,以及来自外环境和毛细血管的氧扩散难以到达,形成了乏氧区域。此外,毛囊、皮脂腺、汗腺由于细胞包裹和缺失毛细血管,其内部同样处于相对乏氧的状态。乏氧区域主要分布着痤疮丙酸杆菌这类兼性厌氧菌,主要通过水解皮肤的脂质获取营养物质并在皮脂腺中生长[8]。Lange-Asschenfeldt等[5]发现,85%的细菌存在于前6层角质细胞内,大多数细菌菌群最深可达到14层胶质细胞,玻璃状菌群不超过第10层。皮肤上四分之一的细菌来自毛囊,其余来自前6层角质层(见图1)。
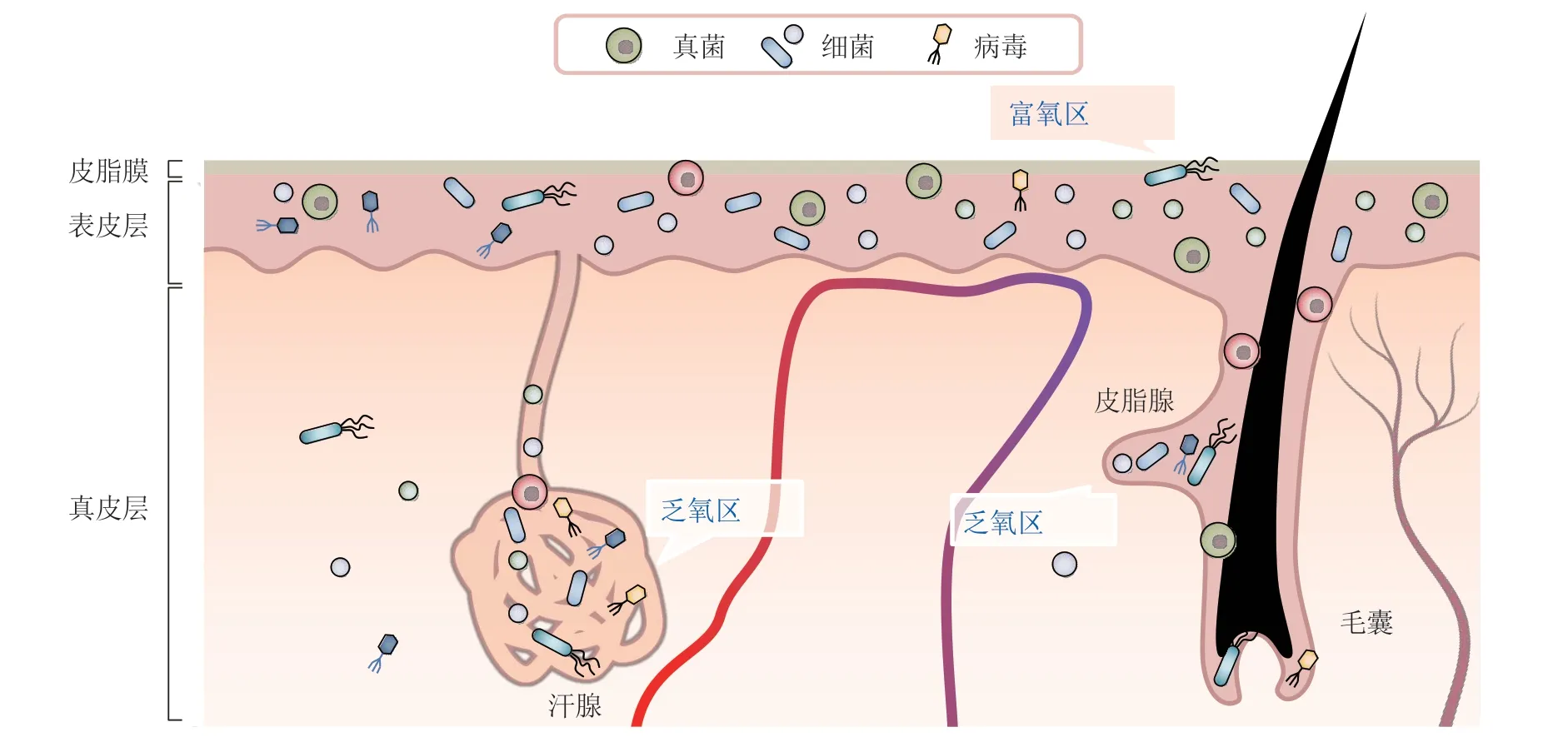
图1 皮肤微生物分布Figure 1 Distribution of skin microorganisms
新生儿生产方式的不同将影响皮肤菌群,并随年龄增长而变化。Dominguez-Bello等[9]研究表明,顺产的婴儿皮肤表面菌群与母亲阴道菌群高度相似,主要含有乳杆菌、普雷沃菌等。而在剖腹产婴儿中,由于缺乏阴道接触,婴儿皮肤表面第一批微生物群落与成年人类皮肤微生物群相似,含有大量葡萄球菌、棒状杆菌等。因此,新生儿耐甲氧西林金黄色葡萄球菌(MRSA)皮肤感染病例中有64% ~ 82%发生在剖腹产婴儿中。Lehtimäki等[10]发现,年龄是皮肤微生物组成的主要决定因素,在人类生长发育的前8年,皮肤表面的微生物多样性随年龄不断增长而增加,这与乳杆菌在皮肤上的优势降低有关;当发育到14岁时,皮肤微生物已经基本成型,此时皮肤微生物群的多样性与成年人基本接近。
日常生活环境及习惯的不同会使得个体间皮肤菌群种类逐渐产生差异。Lambers等[11]发现,表皮葡萄球菌在pH为4.7的乳酸缓冲液中生长活力增强,而金黄色葡萄球菌的生长受到显著抑制;将前臂掌侧皮肤用乳酸酸化至pH 4.0,从皮肤表面分离出的细菌数为24 CFU(colony forming units,菌落形成单位),且分离出的常驻细菌如表皮葡萄球菌的占比较低;而碳酸盐处理使同样位置pH为9.0时,分离出的皮肤细菌数为428 CFU。由此可知,在酸性条件下,常驻细菌不易从皮肤上分离。Urban等[12]发现,当停止使用除臭剂或止汗剂时,皮肤表面细菌密度增加,接近不使用任何产品的个体的细菌密度;恢复使用除臭剂或止汗剂时,细菌密度急剧下降。16S rRNA测序表明,习惯性使用止汗剂或除臭剂的人其腋窝细菌群落以葡萄球菌为主,而不使用这类产品的个体腋窝细菌群落以棒状杆菌为主。
1.2 调控与失衡
皮肤微生态通过多种相互作用进行内部调节和对外反馈,从而维持稳定并行使功能。其中涉及的相互作用主要包括菌群-菌群相互作用、菌群-宿主相互作用以及环境-菌群相互作用(见图2)。
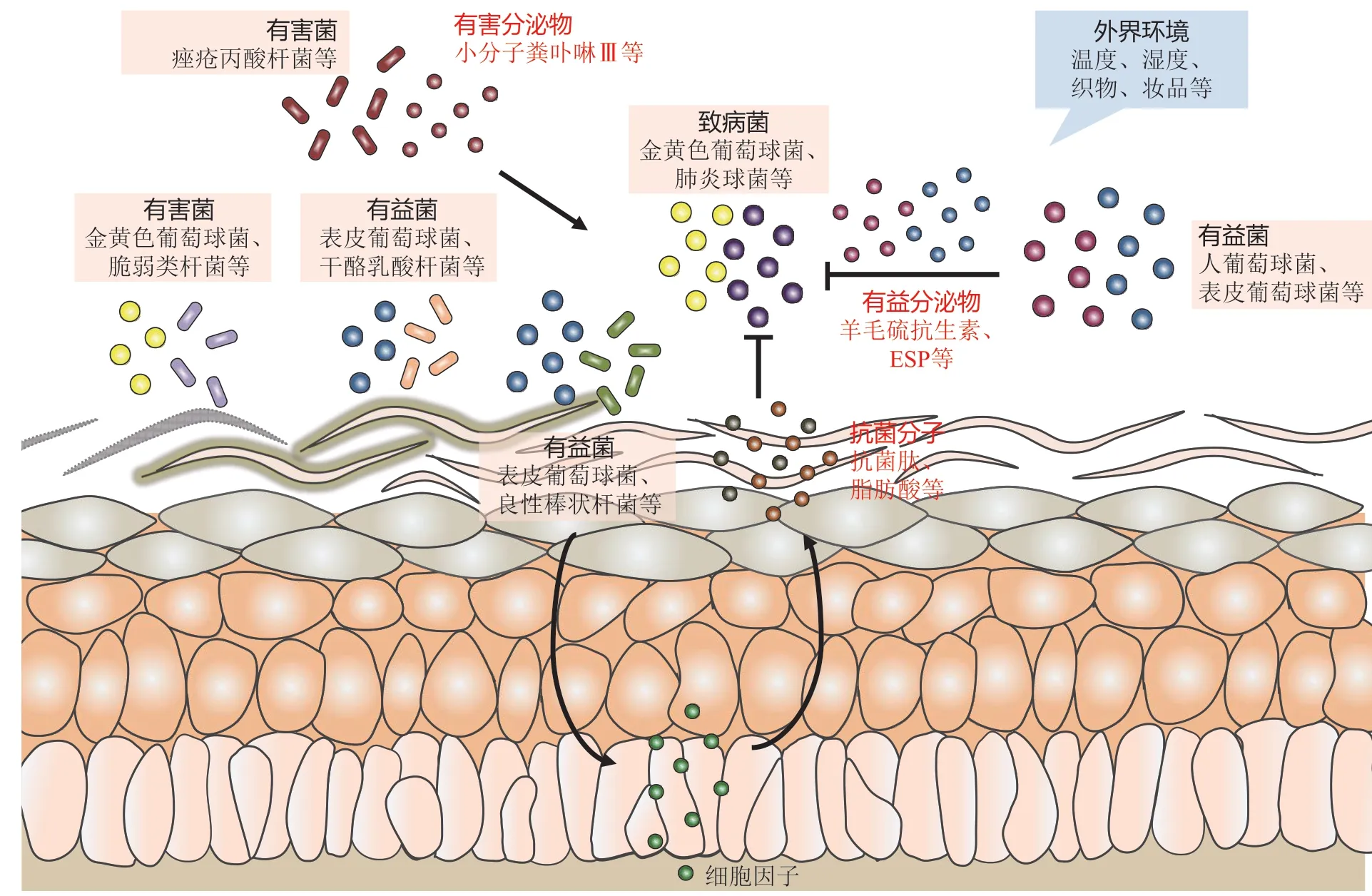
图2 皮肤微生态中的相互作用Figure 2 Interactions within skin microecology
菌群与菌群相互作用即皮肤微生物群内部各种细菌、真菌间的相互作用,以及定植菌群与外来菌群间的相互作用。Sugimoto等[13]发现,由共生表皮葡萄球菌分泌的ESP,可通过降解对生物膜构建和宿主-病原体相互作用至关重要的特定蛋白质来抑制金黄色葡萄球菌定植及其生物膜形成,可降解至少75种蛋白质,包括11种生物膜形成和定植相关蛋白,如细胞外黏附蛋白和细胞外基质蛋白结合蛋白;ESP还选择性地降解人体内的纤连蛋白、纤维蛋白原和玻连蛋白等,这些蛋白在金黄色葡萄球菌的定植或感染中起主要作用。
皮肤表面的微生物通过与宿主的相互作用影响皮肤微生态。菌群与宿主的相互作用包括两方面:一方面,皮肤的生理特性与免疫网络调节皮肤菌群的组成与分布;另一方面,微生物通过其菌体成分与代谢产物作用于宿主细胞,从而影响人体局部和系统免疫。Bomar等[14]将C.accolens与S. pneumoniae在含有三酰甘油(TAG)的培养基上进行体外共培养时,发现C.accolens可抑制S. pneumoniae的生长,这种抑制作用依赖于C.accolens生长所必需的TAG脂肪酶LipS1。C.accolens通过LipS1水解皮肤表面的TAG,释放游离脂肪酸(FFA),从而抑制S. pneumoniae。Chehoud等[15]发现,抑制补体C5a受体(C5aR)的信号传导可改变皮肤微生物群的组成和多样性,使编码皮肤抗菌肽、模式识别受体和促炎症介质的基因下调。炎性细胞浸润的免疫组织化学染色显示,C5aR信号传导受抑制的小鼠其巨噬细胞和淋巴细胞数量减少。通过比较无菌小鼠和常规饲养小鼠皮肤的基因表达,发现皮肤共生微生物群可显著上调皮肤补体基因如C1qa、Cd59a、Crp的表达。
皮肤菌群会随着外界环境的变化发生改变。Mcbride等[16]分别从高湿高温、低温高湿、中温低湿的环境中各选择10名受试者,进行手、背、腋窝、腹股沟和脚5个皮肤部位取样。与中温低湿环境相比,高温高湿环境下个体背部、腋窝和脚部的细菌数量显著增加;低温高湿组从背部和脚部分离的真菌和革兰阴性菌的数量较高,表明环境湿度的增加导致革兰阴性菌的分离率增加。Teufel等[17]对比了聚酯纤维、聚酰胺、聚丙烯、天丝、溶解性纤维、棉这6种材料接触皮肤对表面汗液中微生物的影响,发现聚酯纤维和聚酰胺组的细菌数量最高,聚丙烯组细菌数量最低,再生纤维中细菌多样性显著降低,棉织物组的细菌种类更接近于自然条件下汗液中的细菌类型。
2 皮肤微生态与疾病的关系
当人体免疫力下降、生活环境改变或微生物群失调时,会引发宿主内源性感染。特别是近年来由于大量抗菌药物的使用,导致致病菌耐药性逐渐增强甚至出现“超级细菌”,后果是疾病易复发、细菌感染情况日益严重。随着研究不断深入,人们发现多种疾病与皮肤微生态密切相关,并开发了一些可抑制病原菌增殖、促进益生菌的生长、恢复人体微生物群动态平衡的新方法,从而达到有效治疗这些疾病的目的。
2.1 肿瘤
皮肤表面微生物组不仅与皮肤肿瘤相互影响,与其他部位肿瘤也有一定关联。Nakatsuji等[18]发现,表皮葡萄球菌可产生6-N-羟基氨基嘌呤(6-HAP),6-HAP是一种DNA聚合酶抑制剂,可选择性地抑制黑色素瘤细胞的增殖,但不抑制原代角质形成细胞;紫外线诱导下,给小鼠静脉注射6-HAP可抑制其皮肤黑色素瘤细胞的生长,且无全身毒性证据;将可产生6-HAP的表皮葡萄球菌菌株涂抹于无毛小鼠背部(实验组),与不产生6-HAP的对照组相比,实验组紫外线诱导肿瘤的发生率降低。可见,皮肤表面微生物有助于宿主防御,如抑制肿瘤生长。Li等[19]对癌症恶病质患者和健康人群的腋窝皮肤微生物进行了拭子检测,结果发现恶病质患者皮肤微生物的多样性低于健康人群;与健康组相比,恶病质组的棒状杆菌明显减少,提示癌症恶病质会改变人体皮肤细菌群落。
2.2 特应性皮炎
特应性皮炎(atopic dermatitis,AD)是一种慢性皮肤病,通常伴随局部炎症及瘙痒,且极易复发。AD发病率高、病因较多、机制不完全明确,现阶段仍缺乏特效治疗手段[20]。Byrd等[21]通过宏基因组测序分析了儿童AD患者的微生物变化,发现病情较重的患儿中金黄色葡萄球菌占优势,病情较轻的患儿中表皮葡萄球菌占优势;进一步将从AD患儿和非AD患儿皮肤中分离的菌株局部定植小鼠,发现从AD患儿皮肤中分离的金黄色葡萄球菌可诱导表皮增厚,以及皮肤中的辅助性T细胞(T helper cell,Th)2和Th17大 量 增 殖。Laborel-Préneron等[22]发现,金黄色葡萄球菌导致AD患者皮肤中Th1和Th2失衡,促炎性细胞因子白细胞介素(interleukin,IL)-4水平增多,血清总免疫球蛋白E(immunoglobulin E,IgE)升高,且抑制调节性T细胞(regulatory T cell,Treg)生长,进而引起炎症,但表皮葡萄球菌等共生菌可通过诱导皮肤树突状细胞释放IL-10来抵消促炎作用。
2.3 痤疮
痤疮是一种常见的慢性皮肤炎症,发病机制相对复杂,多与皮脂腺分泌过旺、痤疮丙酸杆菌增殖异常、皮脂腺角化过度及遗传有关。痤疮通常发生在面部、背部等人体皮脂腺活跃的部位。研究表明,保持皮肤表面多种微生物的动态平衡是治疗痤疮的关键[23]。Christensen等[24]发现,大多数表皮葡萄球菌菌株能够抑制痤疮丙酸杆菌,课题组对具有抑制活性的表皮葡萄球菌菌株的基因组进行测序后发现,抗性菌株的可移动基因元件可编码表皮素等抗菌蛋白或多肽,使抗性菌株具有抗生素耐药性、促进细菌荚膜形成等多种重要功能;通过对具有强抗痤疮丙酸杆菌活性的表皮葡萄球菌菌株进行聚丙烯酰胺凝胶(SDS)电泳分析,发现该菌株含有早期分泌性抗原靶6(ESAT-6)分泌系统,通过分泌EsxA蛋白等物质参与抑制痤疮丙酸杆菌。Graham等[25]将角质形成细胞与痤疮丙酸杆菌进行共培养,发现活性痤疮丙酸杆菌可刺激角质形成细胞产生IL-1α、肿瘤坏死因子-α(TNF-α)和粒细胞-巨噬细胞集落刺激因子(GM-CSF),其中稳定期的角质形成细胞相比于对数期的角质形成细胞,被刺激后会产生更多的TNF-α和GM-CSF,表明痤疮丙酸杆菌通过诱导角质形成细胞产生炎性细胞因子,使皮肤产生炎症。
自1956年开始生产成型加工机床,兹默曼一直致力于复杂曲面的高效高速加工,现已形成完整的五轴联动高速龙门加工中心系列产品,不仅在铝合金、铸铁、钢件、镁合金和钛合金以及高温合金的加工中引领技术方向,在非金属材料的加工中也独领风骚。在汽车整车设计研发、车身模型制造、汽车检具制造、保险杠仪表盘等深型腔模具精密制造和大型模具精密制造等领域,兹默曼公司FZ系列龙门加工中心得到广泛应用。
2.4 玫瑰痤疮
玫瑰痤疮主要发生于面部皮脂分泌旺盛区域,如鼻子、下巴和前额,其临床表现为持续性红斑、毛细血管扩张、脓包、水肿等。玫瑰痤疮主要表现为酒渣鼻,同样与皮肤微生物息息相关,油性芽孢杆菌、蠕形螨等都会刺激皮肤产生炎症,形成酒渣鼻[26]。Rainer等[27]对红斑型酒渣鼻(erythematotelangiectatic rosacea,ETR)或脓包型酒渣鼻(papulopustular rosacea,PPR)患者及两者兼有的患者的鼻部皮肤拭子进行了测序分析,发现ETR患者皮肤中黏液玫瑰单胞菌缺失,PPR患者皮肤中富含溶脲弯曲杆菌、柯氏棒状杆菌,同时具有这2种类型的患者皮肤中柯氏棒状杆菌含量最高。Gravina等[28]通过幽门螺杆菌粪便抗原(HpSA)检测发现,酒渣鼻患者的幽门螺杆菌感染率明显高于未患酒渣鼻的健康志愿者;克拉霉素治疗幽门螺杆菌后,90%以上的酒渣鼻患者皮肤损伤消失或明显减少。Thompson等[29]认为,酒渣鼻或与过敏性疾病、胃肠道疾病、心血管疾病和神经系统疾病等多种全身性疾病相关。
2.5 急性创面
通常情况下,创面存在一定量的微生物并不足以引起创面感染等负面作用。为了将微生物正常定植与感染区分开来,通常将每克组织细菌数高于105CFU定义为感染开始的微生物含量临界阈值[30]。皮肤细胞通过皮肤模式识别受体(pattern recognition receptor,PRR)对细菌入侵作出反应,包括Toll样受体(toll-like receptor,TLR)、NOD样受体(nucleotide oligomerization domain-like receptor,NLR)[31]。其中NOD2(nuleotide oligomerization domain 2)是一种细胞内受体,可识别革兰阳性和革兰阴性细菌的细菌肽聚糖的胞壁酰二肽[32]。Williams等[33]发现,NOD2缺陷的小鼠皮肤中铜绿假单胞菌含量显著增加,且伤口愈合迟缓。Linehan等[34]将小鼠创面涂抹表皮葡萄球菌培养液,发现伤口部位愈合加速;进一步研究发现,表皮葡萄球菌分支A20菌株的抗原由非经典的主要组织相容性复合体I(MHC-Ib)递呈,激活细胞毒性T淋巴细胞(CD8+T细胞),引起IL-17A基因、IFN-γ基因等免疫调节基因的表达,最终促进伤口愈合。
2.6 慢性创面
慢性创面也叫慢性难愈合创面,是指愈合过程不能正常进行,且在约4周内无法实现皮肤的功能完整性。通常由于血管功能不全和感染,伤口床微生物增殖,导致长期过度炎症反应、胶原合成延迟、组织损伤等。目前,统称糖尿病足溃疡、压疮或褥疮、下肢静脉溃疡和无法愈合的手术部位感染等为慢性创面[35]。Gardiner等[36]对糖尿病患者足溃疡皮肤和正常志愿者足部皮肤进行16S rRNA测序,发现糖尿病患者皮肤的微生物多样性明显低于正常患者皮肤,丰富度较低的菌种有显著的群落差异。Kalan等[37]对糖尿病足溃疡患者的创面细菌进行了检测,丰富度依次为金黄色葡萄球菌、铜绿假单胞菌、纹状体棒状杆菌和产碱杆菌;其中在不良愈合创面上极易存活的菌株SA10757,包含多种抗生素耐药基因和葡萄球菌肠毒素基因,这些基因表达的抗原通过对大量T细胞的非特异性刺激,导致持续性炎症,延缓愈合进程。
3 皮肤疾病的微生态治疗
传统抗生素的使用不仅使得致病菌产生耐药性,且易发生抗性基因横向转移并扩散,对微生态中的有益菌产生破坏作用,导致失衡等问题。激素类、免疫类药物虽通过作用于皮肤细胞起到快速消炎和抑菌效果,但不能有效改善微生态中益生菌缺失和致病菌感染问题,导致病情容易复发,且致病菌对药物治疗逐渐产生耐受。
利用菌群移植、靶向给药等手段治疗皮肤疾病,在有效恢复微生态平衡、缓解症状的同时,还尽可能避免了不良反应的产生,一定程度上降低了复发的概率(见图3)。在很多与皮肤菌群密切相关的适应证中,如特异性皮炎、痤疮及湿疹等,已有一些微生态治疗相关的临床经验和产品管线。

图3 皮肤微生态在疾病治疗中的应用Figure 3 Application of skin microecology in disease treatment
3.1 次级代谢产物
微生物次级代谢产物包括酶抑制剂与诱导剂、免疫调节剂与细胞功能调节剂及其他具有药理活性的物质,通过调节皮肤细胞信号传导通路,对微生态产生影响。皮肤表面某些微生物通过次级代谢产物来修复皮肤屏障。Lee等[38]从人体皮肤中分离出一种新菌种EPI-7,并在EPI-7培养液中分离出一种新的化合物1,1'-双尿嘧啶。使用EPI-7培养液处理被紫外线照射的Hs68人纤维细胞,发现EPI-7培养液增加了Ⅰ型前胶原和纤维蛋白mRNA的表达;而在未加入EPI-7培养液的细胞中,紫外线照射后上述2种抗衰老成分的mRNA表达被抑制。进一步研究发现,1,1'-双尿嘧啶能够降低基质金属蛋白酶-3(matrix metalloproteinase-3,MMP-3)的表达,对紫外线辐射引发的皮肤衰老有抑制作用。Cogen等[39]发现,表皮葡萄球菌产生的酚溶性调节蛋白(phenol-soluble modulin,PSM)具有α-螺旋结构,可与体表的抗菌肽(antimicrobial peptide,AMP)LL-37产生脂膜相互作用,二者在功能上相互配合可提高抗菌效果。
3.2 噬菌体
3.3 益生元
益生元通常指选择性发酵的非消化性食品成分,这些物质可促进益生菌代谢增殖,主要是指功能性低聚糖[42]。益生元用在皮肤表面可提高有益菌活性,进而修复因药物、激素或其他因素导致的菌群失衡。相比药物治疗,益生元大多是由天然物质提取,安全且无细胞毒性。Al-Ghazzewi等[43]在体外研究了乳酸菌和魔芋葡甘聚糖水解物(GMH)对痤疮丙酸杆菌的抑制能力,发现GMH和乳酸菌联合给药可增强对痤疮丙酸杆菌的抑制效果,表明益生元的配合使用加强了乳酸菌的生物活性。与抗生素相比,益生元治疗过程温和,抑菌的同时对皮肤微生态进行修复,有效降低了痤疮的复发率。Hong等[44]给无毛小鼠经口使用低聚半乳糖(GOS)12周后,连续4 d用紫外线照射。结果显示,与未服用GOS的小鼠相比,服用GOS的小鼠的皮肤保水能力提升且经皮水分流失减少,红斑形成减少16.8%,调节小鼠角质形成细胞增殖的CD44基因表达显著增加。
3.4 益生菌
益生菌移植是指将单株或多株治疗相关的菌种,经培养提纯后施用于皮肤,从而对局部皮肤微生态进行有益替换或整体强化,达到改善并治愈皮肤疾病的目的。Nodake等[45]将冻干的表皮葡萄球菌与凝胶混合后涂于人体皮肤表面,发现不仅能抑制金黄色葡萄球菌,还可增加皮肤的脂质含量,抑制水分蒸发,改善皮肤的保湿性,维持皮肤低酸性环境。此外,皮肤红斑和黑色素含量并无显著变化,表明表皮葡萄球菌导致不良反应的风险较低。Vågesjö等[46]将趋化因子12(CXCL12)乳酸杆菌表达载体施用于小鼠伤口,发现伤口周围真皮细胞和巨噬细胞的增殖水平增加,巨噬细胞中TGF-β表达水平提高;同时产生的乳酸降低了局部pH值,抑制了二肽基肽酶Ⅳ(CD26),提高了CXCL12的利用率。趋化因子CXCL12在受伤组织中内源性上调,招募更多的免疫细胞促进伤口愈合,而在全身循环中未检测到细菌及趋化因子,说明局部应用的转化细菌只对伤口产生影响。
3.5 日化产品
日常生活中会接触到种类繁多的皮肤护理产品,它们通过改变皮肤表面的pH值、潮湿度和皮脂含量等理化性质,从而影响皮肤菌群的多样性,使皮肤整体状态发生变化。Glatz等[47]对有AD家族史的婴儿脸颊施用润肤剂后发现,润肤剂组皮肤pH值较低,而细菌类群的数量和唾液链球菌比例均高于未用润肤剂组。对正常婴儿采样发现,其唾液链球菌比例比有AD风险的婴儿更高;长期使用润肤剂后,有AD风险的婴儿皮肤pH值降低,唾液链球菌比例增加,表明润肤剂对高AD风险婴儿具有预防作用。Seite等[48]使用含有乳木果油、温泉水和烟酰胺的润肤剂对AD患者进行试验,发现该润肤剂可以缓解AD患者70%以上的症状,增加皮肤表面微生物的多样性,减少葡萄球菌属的数量。可见,润肤剂不仅能帮助维持皮肤菌群的健康,在治疗皮肤病方面也起到一定的辅助作用。
4 结语与展望
皮肤表面上有丰富的褶皱和纹路,适合多种微生物的定植,形成了皮肤特有的微生态系统。其中占据不同生态位的组分,形成宿主和微生物之间的微妙平衡,任何一方的紊乱都可能导致问题产生或引发病变。影响宿主-微生物关系的可以是内源性的微生物群落遗传变异、宿主内分泌及免疫系统变化,或是外源性的护肤品、药品等影响。
皮肤疾病与皮肤微生态存在密切联系,如金黄色葡萄球菌失调引起AD、油性芽孢杆菌刺激形成酒渣鼻、痤疮丙酸杆菌大量繁殖引起痤疮等。现阶段治疗该类皮肤疾病主要依靠抗生素等抑菌产品,但忽略了微生态系统平衡的重要性,因而引起致病菌产生耐药性,使得疾病复发风险变高,后续治疗难度加大,甚至造成全球的耐药性扩散问题。而通过微生态角度给药,可在缓解症状的同时减少疾病复发的可能。
随着对皮肤微生态系统的了解不断加深,基于微生物治疗皮肤疾病的新方案正逐渐成型。除正在进行的人类微生物组计划外,欧美日等国还不同程度地制订了用生物治疗逐渐取代化学治疗的战略。针对各大微生态系统的生物学疗法,范围覆盖到了工业微生物学、合成生物学和基因组学等多种前沿技术,将在未来医药发展过程中占据重要地位。起步较早的肠道微生态领域已经形成了涵盖个性化组学诊断、益生元补剂、菌群移植等的全面治疗策略,并且正快速地替代传统类型的广谱性药物。其中积累的药物开发经验,在后续皮肤微生态与皮肤疾病关系的研究中也具有高度的参考价值。

