纳米胶束药物介导基于化疗的肿瘤联合治疗研究进展
赵昌顺,温苏晨,万雨晴,敖裕利,陈维
(中国药科大学工学院,江苏 南京 211198)
癌症是全世界最致命的医疗难题之一,目前临床治疗手段主要有手术治疗、化疗和放疗。在全身系统性的肿瘤治疗中,化疗仍是首选,通过化学药物抑制肿瘤细胞的增殖和转移,最终杀死肿瘤细胞。然而,单一化疗治疗效率低,难以克服肿瘤复杂的微环境,如异质性的血管异常、淋巴引流障碍、肿瘤间质压增加和致密的细胞外基质等[1]。此外,长期单一化疗也会造成肿瘤细胞P-糖蛋白(P-gp)表达增加、细胞凋亡机制异常、药物作用靶点改变以及细胞膜组成结构变化,从而减少肿瘤对药物的摄取量,产生多药耐药性(MDR)。
随着科技的进步,基因治疗、光热治疗、光动力治疗、免疫治疗等一系列新型肿瘤治疗手段被应用于临床,不同作用机制的治疗手段为肿瘤耐药和复发转移等问题带来了解决方案。肿瘤联合治疗通过多种不同类型药物的联用或不同治疗方式的结合,对肿瘤细胞的多种信号通路进行抑制,极大程度地提高肿瘤对抗癌药物的敏感性以及药物的杀伤能力,延长癌症患者生存期[2-3]。尽管联合治疗具有众多优势,但在实际使用过程中不同治疗药物的药动学和生物分布等性质不同,很难控制不同治疗药物的比例和到达病灶部位的时间,造成其在临床应用中常常收效甚微,甚至在治疗过程中带来毒副作用的叠加[4-5]。
近年来纳米技术的出现为解决联合治疗中剂量方案复杂、患者依从性差、疗效不佳等问题提供了有力工具。两亲性聚合物胶束(PM)是众多疾病治疗研究中的常用载体,其系由两亲性嵌段共聚物在水溶液中自组装形成的具有“核-壳”结构的纳米载体[6]。胶束的疏水核可以包载多种疏水性化疗药来增加药物的溶解度,亲水性壳层利用水合作用形成保护性屏障,从而减少血液循环过程中蛋白的吸附和网状内皮系统的清除,延长药物的半衰期。PM的粒径通常较小(10 ~ 100 nm)、分布较窄且可通过控制亲疏水嵌段的长度来调节粒径大小。已上市的Genexol®PM基于甲氧基化聚乙二醇-聚(D,L-乳酸)(mPEG-b-PDLLA)两亲性嵌段共聚物形成球形胶束并包载了紫杉醇(PTX),在临床上用于卵巢癌和非小细胞肺癌的治疗[7]。结构明确、便于改性是PM的一个特点。在聚合物合成中通过增加靶头配体(如抗体片段[8]、肽[9]和小分子[10]等)和敏感型化学键/基团设计多功能型PM,来提高PM在肿瘤部位的富集和特定细胞的内化,并针对肿瘤部位内源性/外源性的刺激(pH、酶、氧化还原、缺氧、光、热、超声波等)作出响应,完成药物在特定区域的快速释放[11]。先进的PM递送系统为肿瘤化疗联合治疗策略提供了更多的选择。目前对PM的综述主要集中在PM的普遍性介绍,如制备、载药和应用,单独对PM用于化疗联合治疗的介绍较少[12-13]。本文综述了纳米胶束药物介导基于化疗的肿瘤联合治疗的研究进展,为纳米胶束药物的设计提供参考。
1 胶束在多种化疗药物联合治疗中的应用
目前,多种化疗药物联用策略已被广泛应用于临床抗肿瘤治疗。相比于单一化疗药,2种或2种以上化疗药物的联合使用可以同时调控肿瘤细胞中的不同信号通路,起到协同杀伤作用,有效克服肿瘤MDR并降低单个药物使用剂量来减少全身毒性[14]。例如,阿霉素(DOX)和顺铂的联合应用可通过特异性干扰DNA分子带来良好的协同抗癌效果[15]。然而,传统的多药联用疗法中常存在各药物成分之间生物利用度不同和药代动力学半衰期变化等问题[16]。PM具有独特的核壳结构,疏水内核可以有效装载多种难溶性化疗药,有望实现药物在药代动力学和药效学体内分布上的统一。Zhang等[16]设计了基于杯芳烃大环两亲物的自组装纳米粒子(MASN),其能够精确地装载多种药物并将它们按比例递送至肿瘤。在体外将PTX与吲哚胺2,3-双加氧酶(IDO)抑制剂NLG919分别以1∶4和4∶1的物质的量比值装载到MASN中,经静脉注射24 h后,肿瘤部位的药物比基本不变(PTX与NLG919的物质的量比值分别为1∶4.14和4.09∶1),有效保证了肿瘤部位的最佳药物比例。值得注意的是,PM在载药时也会因为药物分子之间较强的分子间疏水作用,带来药物的聚集而导致药物装载困难,载药量降低且药物比例不可控。可以通过增加PM与药物之间的相互作用力来改善对药物的装载能力,如供体-受体相互作用[17-18]。Wu等[19]制备了苯基硼酸(PBA)修饰的两亲性聚合物聚乙二醇-聚[(N-2-羟乙基)-天冬酰胺](mPEG-PHEA/PBA),利用疏水链段中PBA(作为电子受体)与伊利替康和DOX之间的供体-受体相互作用,实现了超高的载药量(约50%)和载药效率(高于95%),且载药胶束粒径分布均一。在Lewis肺癌异种移植荷瘤小鼠中进行的研究显示,经载药胶束治疗后16 d的观察期内,肿瘤几乎停止生长。
胶束通过物理作用包载药物在体内循环过程中可能出现药物泄露等问题。聚合物前药策略,即利用对肿瘤微环境(TME)敏感的化学键将化疗药连接到PM,有效提高了药物在血液循环中的稳定性。聚合物前药可自组装形成前药胶束,同时包载另一种化疗药进行联合治疗。Lin等[20]制备了包载多西他赛(DTX)的pH/谷胱甘肽(GSH)双响应miR-34a调节剂Rubone(RUB)前药胶束,有效解决了RUB载药效率低(低于7%)的问题。在被细胞内吞后溶酶体低pH的条件下氨基质子化带来DTX快速释放,进而前药聚合物暴露在GSH下,发生二硫键的断裂并释放RUB,实现了RUB和DTX细胞内的共同递送。聚合物前药胶束还可通过敏感键将多个药物键连,有效解决药物泄露问题,实现药物定点控制释放。Zhang等[21]设计了GSH响应型顺铂和喜树碱(CPT)双重前药胶束。前药胶束在血液循环中保持稳定结构,被肿瘤细胞摄取后,响应pH变化发生电荷反转,实现溶酶体逃逸,随后在GSH刺激下顺铂和CPT快速释放,Chou-Talalay联合指数为0.389,双前药胶束中2种化疗药在人乳腺癌MCF-7细胞中表现出优异的协同抑制作用(见图1)。
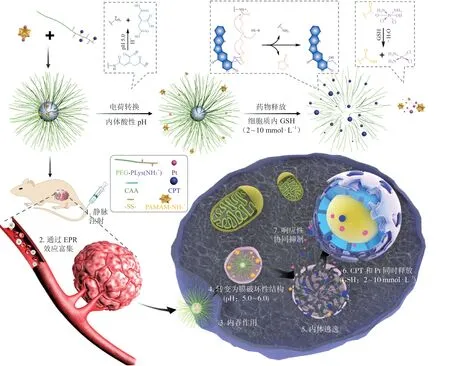
图1 刺激响应型双前药胶束用于多种化疗药物联合治疗的示意图[21]Figure 1 Schematic diagram of stimuli-responsive dual-prodrug micelles used in combination therapy of multiple chemotherapeutic drugs
2 胶束在化疗联合光疗中的应用
光疗是一种新型的非侵入性肿瘤治疗方法,包括光动力疗法(PDT)和光热疗法(PTT)。与传统化疗相比,光疗具有时空高度选择性、易于操作、微创/无创伤性、低全身毒性以及肿瘤缺乏相应耐药机制等特点。PM的核壳结构可以有效地实现化疗和光疗的整合,凭借不同的治疗机制来克服传统单一化疗手段的不足[22-24]。
2.1 化疗和光动力疗法联用
PDT是利用光动力效应来进行肿瘤治疗的新方法,其技术包含3个关键要素:光源、组织氧和光敏剂。在特定波长激光的照射下,光敏剂吸收能量传递到周围的氧分子上,产生活性氧自由基(ROS),如过氧化氢(H2O2)、羟自由基、单线态氧(1O2)和超氧阴离子,从而造成细胞内线粒体、DNA等损伤,进而诱导肿瘤细胞的坏死和凋亡。此外,PDT在杀伤肿瘤细胞过程中还会释放出大量肿瘤抗原,引起急性炎症和白细胞浸润,增强肿瘤部位免疫反应[25]。
在化疗和PDT联合治疗中,通过控制化疗药与光敏剂的剂量比可以有效提高协同治疗效果。Gao等[26]通过酸敏感的腙键和还原响应性二硫键将DOX和光敏剂酞菁锌(ZnPc)连接到两亲性嵌段共聚物甲氧基聚乙二醇-聚(L-天冬氨酸-β-苄酯)(PEG-PBLA)上形成双前药胶束,来减少载体体内循环过程中药物比例的变化。通过设计不同比例化疗药和光敏剂的双前药胶束,在DOX/ZnPc物质的量比值为3.8∶1时表现出协同细胞毒性且主要通过凋亡途径来诱导细胞死亡。PDT过程中会产生大量ROS,可有效促进肿瘤细胞内药物的释放并提高肿瘤对PDT的敏感性[27]。Uthaman等[28]用ROS敏感的硫缩酮连接PEG和硬脂胺(C18),构建ROS响应的两亲性PM,共载化疗药DOX和光敏剂脱镁叶绿素A(PhA),用于增强局部化学光动力治疗。在肿瘤细胞内较高浓度的内源性ROS作用下实现PhA和DOX的初始释放,随后在激光照射下PhA产生大量ROS,连接亲疏水单元的硫缩酮被快速解离,导致纳米胶束结构破坏,加速肿瘤微环境中DOX的释放,表现出化疗和光动力治疗协同抑制肿瘤生长,以及抗肿瘤免疫效果的增强。目前PDT使用的光敏剂大多被可见光甚至紫外光激发,低波长激光的组织穿透深度较差,使PDT使用受到限制。上转换纳米粒子(UCNP)具有独特的将近红外光(700 ~ 1 100 nm)转换为短波长光的能力,已成为提高PDT治疗效果的有效手段[29]。Chen等[30]构建了一种基于聚乙二醇-聚(4,5-二甲氧基-2-硝基苄基甲基丙烯酸酯)(PEG-PNBMA)和玫瑰红(RB)光敏剂的功能化的UCNP PM,胶束内部装载组蛋白脱乙酰酶(HDAC)抑制剂AB3,用于神经内分泌肿瘤的化疗与PDT联合疗法以及生物成像。近红外光照射下激活UCNP产生紫外光以及波长为460 nm、540 nm和650 nm的发射光,紫外光造成结构中 PNBMA 由疏水性向亲水性转变,从而加速药物释放;540 nm发射光激发光敏剂RB产生活性氧,此外650 nm发射光可用于体内外的成像。小鼠抑瘤实验显示,基于UCNP的化疗和PDT的联合治疗表现出优异的抗肿瘤效果,治疗后22 d内小鼠肿瘤体积基本未增加。
2.2 化疗和光热疗法联用
PTT是一种广泛应用的无创性实体肿瘤消融疗法,利用光热剂的热转化效应使靶点处产生局部高温(50℃以上的温度),进而导致蛋白质变性、机械性膜损伤,甚至是细胞碎裂,造成肿瘤细胞死亡[31]。常见的光热剂包括近红外有机染料[如吲哚菁绿(ICG)、IR-780和IR-808]和无机纳米材料(如纳米金、氧化石墨烯、碳纳米管和Fe3O4纳米载体)[32]。PTT不需要氧分子的参与,同时具有侵袭性小、对健康组织损伤小、治疗准确率高、恢复时间短、并发症发生率低、可远程智能控制等优点,是一种极具潜力的肿瘤治疗策略[33]。
与单独化疗相比,PTT诱导的高温不仅可以杀死肿瘤细胞,还会带来细胞通透性的增加,提高肿瘤细胞对纳米颗粒的吸收,并促进纳米颗粒中化疗药物的释放,诱导细胞内药物浓度增加,从而增强药物细胞毒性[34]。药物释放充分和有效药物保留是逆转肿瘤MDR的2个关键因素。Deng等[35]利用N-丙烯酰甘氨酰胺和丙烯腈制备了一种上限临界溶解温度(UCST)为44℃、载有光热剂IR780和化疗药DOX的热敏纳米胶束,其可表现出多重协同效应。首先,IR780在近红外光照射下产生光热效应,诱导胶束解离,药物快速释放。光热效应不仅直接杀伤肿瘤细胞,同时下调了P-gp的表达,有效抑制了对DOX耐药的人乳腺癌细胞(MCF-7/DOX)中的药物外排,在MCF-7/DOX荷瘤小鼠模型中的肿瘤抑制率高达94.4%。PTT治疗过程中,肿瘤相关成纤维细胞、高间质液压力和致密的细胞外基质等因素的影响,常常使得纳米载体分布不均匀而导致肿瘤细胞杀伤不完全,尤其是在药物或热的遗漏区域[36]。Shi等[37]利用β环糊精骨架的CPT前药(β-CD-PCPTss-NH2)通过正负电荷相互作用包载IR820形成单分子胶束。胶束具有出色的肿瘤渗透效果以及还原响应性药物释放行为。Song等[38]制备了超灵敏pH响应的尺寸可变DOX前药胶束,进一步利用DOX和IR780之间的π-π堆积相互作用实现对光热剂的有效包载,用于A549荷瘤小鼠的化疗和光热联合治疗(见图2)。稳定的胶束结构在静脉注射后可以在肿瘤部位有效富集并滞留长达6 d,在肿瘤细胞外基质pH条件下叔胺质子化造成胶束解体,分解为12 nm的超小颗粒和游离IR780并深入渗透到肿瘤中,在光声成像中IR780的信号遍布整个肿瘤。高效的肿瘤富集以及化疗药与光热剂对肿瘤的深度渗透使得药物在低剂量下也表现出显著的肿瘤抑制作用,抑制率高达97.6%。

图2 尺寸可变PM用于化疗与光热联合治疗的示意图[38]Figure 2 Schematic diagram of size variable PMs used in combination of chemotherapy and photothermal therapy
3 胶束在化疗联合免疫治疗中的应用
癌症免疫治疗通过激活患者肿瘤部位的免疫系统,增强机体的免疫应答,实现对原发肿瘤的抑制与清除,并可帮助机体形成免疫记忆来抑制肿瘤的复发和清除肿瘤转移灶。然而,在临床治疗中由于肿瘤组织免疫原性低(冷肿瘤)、免疫抑制微环境和免疫逃逸等问题的存在,使得只有大约20%的癌症患者对免疫治疗有应答。
化疗能激活肿瘤免疫原性细胞死亡(ICD),释放肿瘤抗原、发生钙调蛋白到细胞表面的转移,实现肿瘤由“冷”到“热”的转变[39-40]。Dai等[41]利用二硫键将姜黄素结合到带聚乙烯亚胺(PEI)的聚合物骨架上形成前药胶束,并用其包载免疫检查点IDO抑制剂NLG919,在黑色素瘤模型小鼠中进行的研究表明,该胶束药物可高效抑制肿瘤生长、转移和复发。胶束对化疗药物和免疫检查点抑制剂的共递送中,因作用位点不同常带来空间分布的差异需求,如化疗药物需要在细胞内发挥作用而抗体类检查点抑制剂如PD-1/PD-L1的抗体需要在细胞外释放,因此载体要能实现级联智能响应肿瘤微环境而释放药物。Su等[39]制备了一种pH和基质金属蛋白酶(MMP)双敏感胶束纳米载体,在肿瘤细胞外微环境MMP-2和微酸性(pH 6.5)条件的刺激下PEG外壳脱落并释放PD-1抗体(aPD-1),随后在细胞内更低pH的内涵体中释放化疗药物PTX,完成aPD-1和PTX的时空控制释放(见图3)。PTX诱导肿瘤细胞发生ICD来暴露相关肿瘤抗原,激活抗肿瘤免疫,进而aPD-1阻断PD-1/PD-L1轴以抑制因PTX诱导的PD-L1上调而带来的肿瘤免疫逃逸。化疗联合免疫治疗增加了细胞毒性T淋巴细胞的肿瘤浸润,γ干扰素(IFN-γ)和肿瘤坏死因子(TNF)-α等细胞因子分泌也明显增多,表现出显著的抗肿瘤效果。
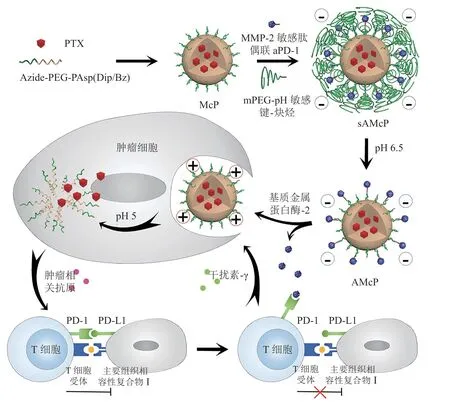
图3 pH和基质金属蛋白酶双敏感PM用于化疗与免疫疗法联合治疗的示意图[39]Figure 3 Schematic diagram of pH and MMPs responsive PMs used in combination of chemotherapy and immunotherapy
PM对化疗药物和基因分子的共传递也可实现化疗免疫联合治疗。Sun等[42]构建了一种基于聚二甲双胍(PMet)的纳米胶束,共递送DOX和编码IL-12基因(pIL-12)的质粒,用于转移性乳腺癌的化学免疫联合治疗。透明质酸(HA)修饰的胶束通过肿瘤部位高通透性和滞留效应(EPR)被动靶向和CD44受体介导的主动靶向,实现胶束在肿瘤部位的有效积累和细胞内化,并在内涵体/溶酶体中除去HA外壳,重新暴露出阳离子PMet胶束,利用质子海绵效应实现溶酶体逃逸并促进DOX释放和pIL-12的成功转染。研究显示,DOX诱导肿瘤细胞凋亡并抑制细胞增殖,结合IL-12细胞因子的大量表达进一步增加了自然杀伤细胞(NK细胞)和细胞毒性T淋巴细胞的肿瘤浸润,调节M2巨噬细胞向M1巨噬细胞转型,同时降低了免疫抑制调节性T(Treg)细胞数量,在4T1乳腺癌肺转移小鼠模型中显示出更高的肿瘤抑制效果和抗转移活性。
4 胶束在化疗联合基因治疗中的应用
单一化疗通常只阻断肿瘤生长进程的一条信号通路,很难实现持续和完全的抗肿瘤效果。与单一化疗相比,化疗和基因疗法的联用,如化疗药和质粒DNA(pDNA)、miRNA或siRNA的联合可以有效抑制肿瘤MDR、减少药物使用剂量、降低致癌蛋白表达,带来显著的抗肿瘤效果。其中,带有疏水性内核和亲水性阳离子片段的PM是化疗和基因治疗联用中常用的载体形式[43-44]。
4.1 化疗药物与pDNA联用
pDNA是一种经典的基因疗法,能纠正人体自身基因结构或功能上的紊乱,抑制致病遗传物质的复制,达到治疗目的。比如,p53基因是一类重要的肿瘤抑制基因,作为“基因组卫士”对细胞分裂起着减慢或监视的作用。p53基因受损或突变会导致癌症的发生和肿瘤MDR。Chen等[45]制备了一种两亲性双功能淀粉衍生物(PDP),用于DOX和pDNA的共同递送,从而修复p53基因并抑制MCF-7肿瘤的生长。PDP胶束以普鲁兰多糖作为主要骨架材料,修饰了疏水的脱氧胆酸和带正电荷的低相对分子质量PEI,分别用于DOX和pDNA的负载。PDP胶束在脱氧核糖核酸酶Ⅰ(DNase I)和血清存在下能有效保护pDNA不被降解,并在MCF-7细胞中成功实现p53基因的转染。在荷瘤小鼠治疗中,DOX和p53基因的联合使用表现出显著增强的抗肿瘤效果。肿瘤细胞表面通常过表达某些特异性受体,对载体进行靶向设计,将进一步增加治疗效果。MCL-1蛋白作为一种抗凋亡蛋白在多种肿瘤组织中高表达,使肿瘤细胞逃避凋亡并产生抗药性。叶酸(FA)修饰的PTX和shMCL-1质粒双转运复合胶束可以有效主动靶向肿瘤部位,增加载体的肿瘤富集并恢复耐药性卵巢癌对PTX的敏感性[46]。
4.2 化疗药物与miRNA联用
miRNA是一类长度约为22个核苷酸的非编码微小RNA,能结合目标mRNA的互补序列,导致mRNA翻译抑制或降解,进而参与肿瘤细胞的发生、发展、凋亡等过程的调控[47]。特定序列的miRNA能逆转肿瘤细胞上皮-间质转化,下调三磷酸腺苷结合盒转运蛋白的表达,进而提高肿瘤细胞对化疗药的敏感性,与化疗联用表现出协同效果[48-49]。
为提高异种移植胰腺癌对化疗药吉西他滨(GEM)的化学敏感性,Uz等[50]开发了一种生物相容性的五嵌段聚合物纳米胶束,用于同时递送GEM和miR-345,协同治疗胰腺癌。该嵌段聚合物结构中间为温度敏感的聚合物泊洛沙姆(Pluronic F127),两端为pH响应性阳离子聚甲基丙烯酸二乙氨基乙酯(PDEAEM),通过疏水和电荷作用共同装载GEM和miR-345。在肿瘤细胞摄取胶束后,胶束中的叔胺基发生质子化,实现内涵体的逃逸,并释放miR-345,完成对细胞的有效转染,下调sonic hedgehog信号从而减少结缔组织增生,改善GEM在胰腺癌肿瘤组织的灌注和化疗敏感性,实现对胰腺癌的有效抑制。miRNA 到达靶细胞后有效的解离和释放是成功转染和治疗的先决条件。Xin等[51]基于聚(乙二醇)-聚[天冬酰胺乙基(对硼苄基)二乙基溴化铵](PEG-B-PAEBEA)设计了ROS响应型胶束,利用结构中季铵,通过静电作用完成对核酸药物和ATP激酶抑制剂volasertib的装载,聚合物骨架中季铵与硼酸进一步发生氮-硼(N-B)配位,形成稳定的胶束结构。在肿瘤部位高浓度ROS作用下,胶束中硼酸基团被氧化,发生胶束的解离,快速释放内部装载的miR-34a和volasertib。Salzano等[52]设计了MMP-2和GSH敏感型双前药胶束。分别利用MMP-2敏感肽连接DOX和PEG2k,二硫键连接miR-34a和磷脂(PE),进而前药聚合物和细胞穿透肽(TAT)修饰的PEG-PE混合自组装形成双敏感型前药胶束。其在过表达 MMP-2 的 HT1080 细胞中表现出3倍细胞毒性,并在胞内GSH环境下释放miR-34a,下调Bcl2、survivin和notch1。
4.3 化疗药物与siRNA联用
siRNA通常是一段长度约为21个核苷酸的双链RNA,能阻碍特定基因的翻译或转录,从而抑制基因表达,如siRNA在体内可降解肿瘤过度表达或突变基因序列的特异性mRNA。化疗药和siRNA联用可以带来更强的细胞杀伤效果,减少药物使用剂量,减轻副作用,达到协同治疗效果[53]。
Polo样激酶1(Plk1)是在纺锤体形成和中心体成熟等细胞分裂活动中起关键作用的致癌基因之一,在多种癌细胞中高表达,其表达水平与癌症的预后相关。Yin等[54]设计了一种氧化还原响应两亲性壳聚糖基复合物胶束,用于疏水性化疗药物和亲水性Plk1 靶向 siRNA(si-Plk1)的肿瘤细胞特异性快速共递送(见图4)。结构中二硫键连接的疏水性辛胺和阳离子小分子 PEI,分别用于装载PTX和静电吸附si-Plk1。通过HA涂层来屏蔽胶束表面正电荷,利用CD44靶向作用有效增加了胶束药物在A549肿瘤中的富集。在肿瘤细胞质高浓度GSH作用下发生二硫键断裂,实现PTX和si-Plk1的快速释放,加强了si-Plk1的转染能力,有效降低Plk1蛋白的表达。体内抗肿瘤实验显示,化疗和siRNA联合治疗表现出协同抗肿瘤效果,达到86.63%的肿瘤抑制率。
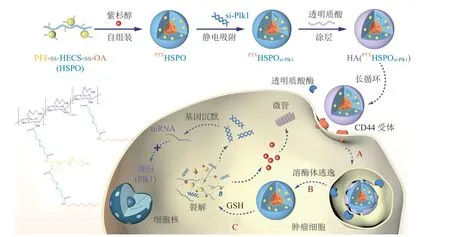
图4 GSH响应型PM用于化疗与基因疗法联合治疗的示意图[54]Figure 4 Schematic diagram of GSH responsive PMs used in combination of chemotherapy and gene therapy
5 结语与展望
多种化疗药物联用或化疗与其他治疗策略的结合有望克服传统化疗中常见的肿瘤异质性、复杂性、耐药性等问题,在达到协同抗癌效果的同时最大限度地降低毒副作用。聚合物纳米胶束系统因其特有结构,具有易于功能化、载药量大、药物可控释放、尺寸较小和肿瘤部位高富集等优势,被认为是肿瘤化疗与其他疗法联合治疗策略中的有效工具。尽管基于PM的化疗联合治疗在体外和体内试验中表现出很好的治疗效果,但也面临着一些挑战。例如在实际使用过程中,PM大多只通过疏水作用力来装载药物,在静脉注射后被稀释,当其浓度低于临界胶束浓度(CMC)时发生胶束解体,造成快速血液清除和过早的药物释放,从而严重影响PM在临床上的转化。对于胶束稳定性和药物保留时间问题可以通过增加氢键、π-π堆积、配位或主客体相互作用等非共价作用力以及通过二硫键、腙键、点击化学、游离自由基聚合等化学交联手段来尽量解决。在胶束抵达肿瘤组织后又面临着致密的细胞外基质和较高的组织间渗透压等问题,阻碍PM药物在肿瘤中的渗透,无法有效杀伤肿瘤细胞,这些问题的存在都制约着PM的进一步应用。随着纳米医学技术的发展,PM的设计也将不断完善,智能递送药物从细胞水平、亚细胞水平甚至分子水平来调控肿瘤生长,这也将为更多的联合治疗手段(如肿瘤血管疏导、肿瘤微环境重塑等)提供有效工具。纳米胶束药物有着广阔的应用前景,但仍面临着许多难点,需运用多学科交叉融合的方法来进一步推动胶束药物的临床转化。

