高危神经母细胞瘤患儿骨髓中PHOX2B及GD2的表达及临床意义
刘江华 臧博伦 刘炜 李彦格
神经母细胞瘤(Neuroblastoma,NB)起源于肾上腺髓质或椎旁交感神经节,发病率约为1.01/10万,是儿童期最常见的颅外实体肿瘤,占相关儿童肿瘤死亡的15%[1]。NB起病隐匿,超过50%的患儿诊断时即为高危,其长期生存率不足50%[2],因此探讨影响高危NB疗效的危险因素具有重要意义。配对同源异型盒蛋白2B(paired-like homebox 2B,PHOX2B)是一种在外周交感神经系统中具有高度特异性的转录因子,最初在NB细胞株中被发现,研究表明PHOX2B参与了NB的发生发展[3]。双唾液酸神经节苷脂(disialoganglioside,GD2)是NB细胞上广泛表达的高度特异性抗原,可作为NB诊断的敏感特异标志物[4]。本研究通过检测高危NB患儿骨髓中PHOX2B及GD2的表达,分析其与临床指标及预后的关系,探讨其临床意义。
1 材料与方法
1.1 研究对象 选取我院2019年1月~2021年12月收治的新诊高危NB患儿为研究对象。纳入标准:符合NB诊断标准,危险度分组符合美国儿童肿瘤协作组(COG)高危标准[5]。排除标准:外院接受过治疗者。共60例患儿纳入本研究。收集患儿的临床资料,包括初诊年龄、性别、NSE、LDH、24h尿VMA、原发部位、转移部位、骨髓转移情况(常规骨髓涂片或流式细胞术检测阳性)、MYCN基因、1p36缺失、11q23缺失、分期、危险度等。本研究经我院伦理委员会批准及患儿家属知情同意。
1.2 方法
1.2.1 PHOX2B基因检测 采用定量RT-PCR(qPCR)法检测患儿骨髓中PHOX2B基因的表达水平。PHOX2B基因检测试剂盒购自上海源奇生物医药科技有限公司,按试剂盒使用说明书进行操作及结果判定。PCR扩增条件:反应体系为30μl,第一步:42℃,30min;94℃,5min。第二步:94℃,15s;60℃,1min,40个循环。在PCR循环第二步60℃时收集荧光信号。结果判定:将PHOX2B CT值≤34,21≤内参CT值≤36判定为PHOX2B基因阳性。
1.2.2 GD2蛋白检测 采用免疫细胞化学染色法检测患儿骨髓标本中GD2蛋白表达水平。采集患儿EDTA~K2抗凝骨髓液3~5ml,用淋巴细胞分离液分离出单个核细胞层,通过制片机甩片获得4~6张细胞涂片,每张玻片约含细胞5×105个,采用两步法进行GD2染色[6]。阳性细胞判定及计数:抗GD2抗体结合位点主要在细胞膜上,故将围绕细胞膜出现红色颗粒样沉淀(胞质或可染色)判为阳性,对阳性细胞进行计数。
1.3 治疗及疗效评估 参照儿童NB诊疗专家共识进行治疗和疗效评估[5]。高危患儿先化疗(约4个疗程)后择期手术,术后化疗至VGPR后4个疗程,总疗程不超过8个,常规化疗结束后行自体干细胞移植和瘤床放疗。化疗结束后口服13-顺式-维甲酸维持治疗6个月。
1.4 随访 通过门诊、电话或再入院方式随访,随访终点截至发生事件的时间或末次随访时间。事件包括疾病进展、复发、转移、死亡,超过6个月未随访定义为失访。随访时间截至2022年3月31日。
1.5 统计学分析 采用SPSS 21.0软件进行统计分析,非正态分布的计量资料采用中位数(P25,P75)表示,计数资料用率(%)表示,样本率的比较用卡方检验。生存率计算采用Kaplan Meier法,各组生存率比较应用Log-Rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共60例高危NB患儿纳入本研究,其中男32例,女28例,男女之比为1.14:1;中位年龄29个月(10~120个月),患儿的临床特征见表1。
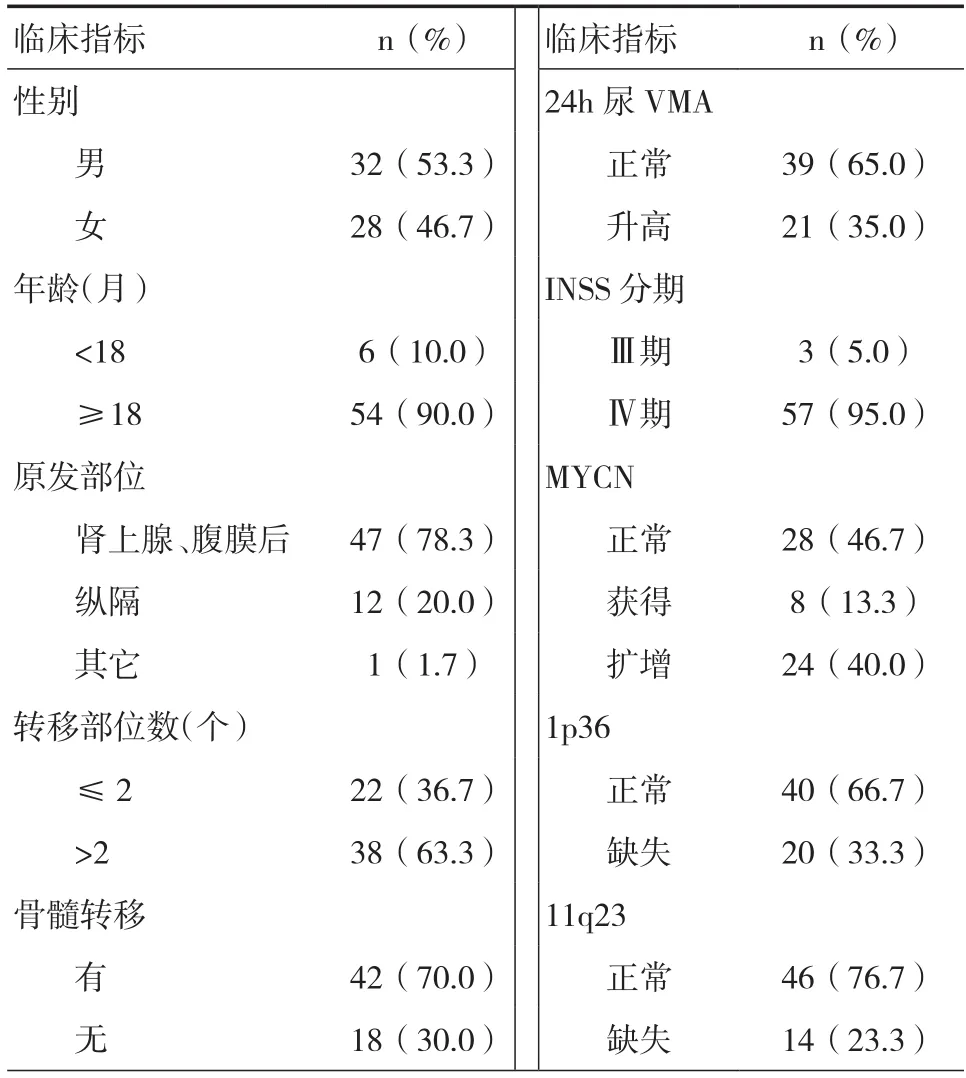
表1 60例高危NB患儿的临床特征
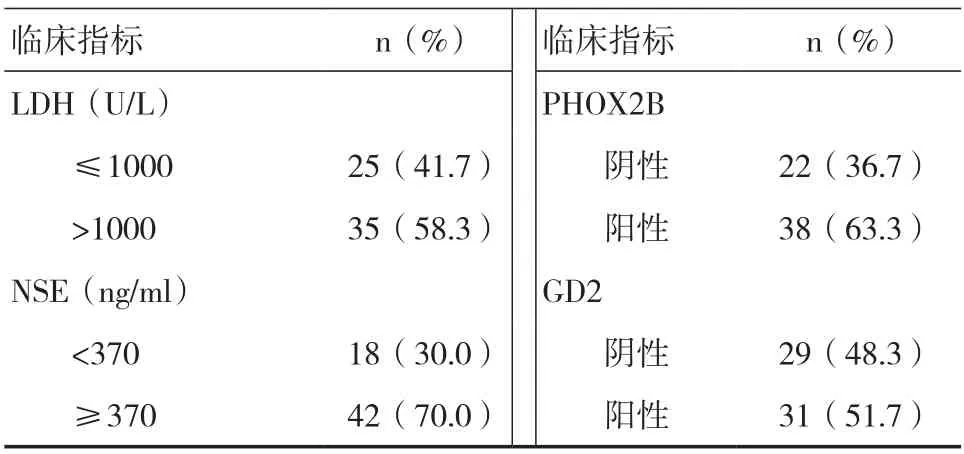
续表1
2.2 PHOX2B、GD2与临床指标的关系 PHOX2B基因阳性组原发部位为腹部者(33/38,86.8%)比例显著高于PHOX2B基因阴性组(14/22,63.6%),PHOX2B基因阳性组肿瘤转移部位数>2个(30/38,78.9%)患儿比例显著高于PHOX2B基因阴性组(8/22,36.4%),差异均具有统计学意义(P<0.05)。GD2蛋白阳性组原发部位为腹部者(28/31,90.3%)比例显著高于GD2蛋白阴性组(19/29,65.5%),GD2蛋白阳性组肿瘤转移部位数>2个(24/31,77.4%)患儿比例显著高于GD2蛋白阴性组(14/29,48.3%),GD2蛋白阳性组24h尿VMA升高患儿比例(15/31,48.4%)显著高于GD2蛋白阴性组(6/29,20.7%),差异均具有统计学意义(P<0.05)。PHOX2B基因阳性组与PHOX2B基因阴性组在年龄、性别、LDH、NSE、24h尿VMA、INSS分期、MYCN基因扩增方面差异无统计学意义(P>0.05)。GD2阳性与阴性标本免疫细胞化学染色见图1。GD2蛋白阳性组与GD2蛋白阴性组在年龄、性别、LDH、NSE、INSS分期、MYCN基因扩增方面差异无统计学意义(P>0.05),见表2。
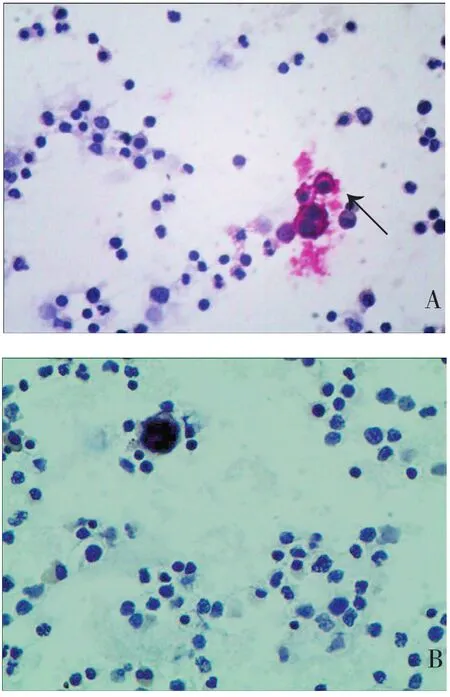
图1 GD2免疫细胞染色图(×400)

表2 PHOX2B及GD2的表达与高危NB临床特征的关系[n(%)]
2.3 PHOX2B及GD2与高危NB预后的关系PHOX2B基因阳性组2年无事件生存率(EFS)显著低于基因阴性组(χ2=6.208,P=0.013),GD2蛋白阳性组2年EFS显著低于蛋白阴性组(χ2=4.012,P=0.045),差异均有统计学意义。各组患儿的生存曲线见图2。
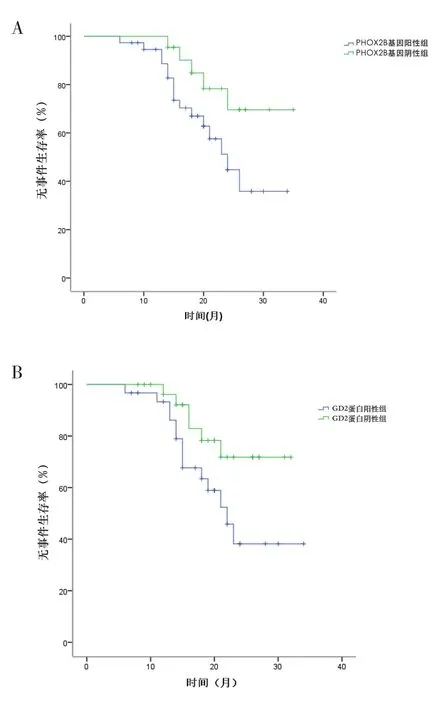
图2 不同组别患儿的生存曲线
3 讨论
NB占婴幼儿恶性肿瘤的8%~10%,具有很强的异质性,可自行消退,也可迅速进展至多发转移甚至死亡。目前经过以危险度分层为依据的个体化治疗,低危至中危NB患儿生存率可达85%,但高危患儿即使经过化疗、手术、放疗、自体造血干细胞移植、免疫治疗等综合治疗,仍有60%的复发率[7],复发后患儿的中位生存期仅为11个月[8]。骨髓微小残留病(MRD)的存在及初诊时不精准的危险度分层是NB复发的重要原因,因此尽早发现骨髓MRD并依此调整危险度分层指导治疗至关重要。
PHOX2B是一种特异表达于外周交感神经系统的转录因子,其编码基因位于染色体4p13,有研究表明,NB小鼠模型中PHOX2B的高表达能促进肿瘤的增殖和转移,这种作用是通过诱导酪氨酸羟化酶及多巴胺羟化酶的表达调控原始神经嵴细胞向成熟神经细胞发育实现的[9]。PHOX2B在外周NB患者骨髓中高表达,在其它类型小圆蓝细胞肿瘤及正常组织中无表达,可作为区分外周神经系统肿瘤和中枢神经胚胎性肿瘤的指标[10]。既往PHOX2B检测多用于病理免疫组化中,体液标本中应用qPCR方法检测少见。本研究通过实时定量PCR法检测骨髓中PHOX2B的表达,发现高危NB患者骨髓中PHOX2B阳性表达占63.3%,为研究PHOX2B在NB中的作用提供了不同的检测方法,有望推广应用于临床。另有研究表明[11]在高危NB中PHOX2B基因的阳性表达率高达80.8%,随着原发瘤灶的减小,PHOX2B基因拷贝数也明显降低。本研究发现PHOX2B基因阳性表达组肿瘤转移部位数>2个者患儿比例显著高于基因阴性组(χ2=10.880,P=0.001),EFS显著低于基因阴性组(χ2=6.208,P=0.013),提示PHOX2B可能参与了肿瘤的转移过程并可作为评判预后的指标,与上述报道一致,有望作为NB转移防治的靶点。
GD2主要在神经外胚层肿瘤中表达,在NB细胞中100%高表达,正常组织中几乎不表达,检测骨髓GD2的表达对诊断NB骨髓转移有较高的敏感性和特异性[12]。目前国际NB危险度分级协作组(International neuroblastoma risk group,INRG)推荐使用免疫细胞学检测GD2抗原[13]。本研究利用免疫细胞化学法检测高危NB患儿骨髓标本中GD2的表达,发现GD2阳性表达组较阴性组原发灶为腹部者多,可能与腹部起病隐匿,诊断时即发生远处转移者多、腹部NB发病率高、本研究其它部位NB病例数较少等因素有关,有待扩大样本量进一步研究证实。另外,本研究发现GD2阳性表达组肿瘤转移部位数>2个(χ2=5.480,P=0.019)、24h尿VMA升高(χ2=5.053,P=0.025)患儿比例显著高于GD2蛋白阴性组,上述两种指标反映了肿瘤的恶性程度及负荷,提示骨髓GD2的表达量可作为评估NB增殖和转移的指标。通过生存分析发现,GD2蛋白阳性组较阴性组有更低的EFS,提示骨髓GD2检测可作为NB预后监测的指标。
综上,本研究检测了高危NB患儿骨髓PHOX2B及GD2的表达,并分析其与NB临床特征及疗效的关系,发现PHOX2B及GD2阳性组较阴性组有更低的EFS,提示骨髓PHOX2B及GD2检测有望作为高危NB微小残留病监测及预后评估的指标。本研究的局限性在于骨髓穿刺为有创操作,建议在初诊、评估及考虑复发时使用,如肿瘤负荷较高,可尝试采用外周血标本替代。

