多配体聚糖结合蛋白在胃癌中的表达及临床意义
谭秋芬 许芳怡 温坤
胃癌是全球最常见的恶性肿瘤之一,为了寻找胃癌的治疗靶点、监测病情及预测预后,需开展大量的胃癌基础研究,以期找到敏感、特异的分子标志物。多配体聚糖结合蛋白(Syndecan binding protein,SDCBP)又称黑色素瘤分化相关蛋白-9(MDA-9),近年研究表明,其参与了多种癌症的侵袭和转移信号传导,除了在黑色素瘤转移和肿瘤进展中发挥作用,还在乳腺癌、尿路上皮细胞癌、肠癌、肝癌等多个肿瘤中高度表达[1]。但其与胃癌之间的关系尚缺乏研究,为此,本研究检测不同胃组织中SDCBP的表达情况,并分析其与胃癌临床病理特征及预后的关系。
1 材料与方法
1.1 研究对象 随机抽取2017年1月~2020年10月在我院行胃癌根治术患者的癌组织及对应的癌旁组织各60份,均经手术病理证实。所有患者在手术前均未接受过放化疗、中药、免疫疗法等治疗,其中男31例,女29例;年龄42~77岁,平均(58.23±7.62)岁;肿瘤直径1.3~7.6cm;浸润深度:T0~T2 38例,T3~T4 22例;按2016年AJCC胃癌分期标准:Ⅰ~Ⅱ期23例,Ⅲ期37例;肿瘤分化程度:低分化39例,中、高分化21例;淋巴结转移22例。所有标本收集后即刻放入10%中性福尔马林中保存。
1.2 检测方法 采用免疫组化染色法检测SDCBP表达水平。组织切片包埋入石蜡,4μm连续切片,脱蜡、3%H2O2孵育后用磷酸盐缓冲液反复冲洗,之后进行EnvisionTM二步法,试剂盒为北京中衫金桥生物技术有限公司产品,严格按照试剂盒说明书进行操作。其中所用的兔抗人、鼠抗人抗体均为SantaCruz公司产品,DAB显色试剂盒为南京博奥生物科技公司产品。
1.3 结果判定 由两位观察者采用双盲法对结果进行判定,随机观察5个高倍视野,SDCBP为细胞浆染色,按半定量积分方法:①染色强度评分:无着色记0分,黄色记1分,棕黄色记2分,棕褐色记3分;②细胞阳性率评分:视野中阳性细胞所占的比例≤5%计0分,占6%~25%计1分,占26%~50%计2分,占51~75%计3分,>75%计4分。最后将①和②相乘,0~1分为-,2~5分为+,6~8分为++,9~12分为+++。根据Fromowitz标准:-和+为低表达,++、+++为高表达。
1.4 随访 本组患者随访最短11个月,最长50个月,平均随访(32.72±6.52)个月,无一例患者死于胃癌以外原因。无病生存期定义为自确诊日起至疾病复发转移之间的时间。总生存期定义为自确诊日起至末次随访之间的时间。
1.5 统计学方法 采用SPSS 23.0统计软件分析处理数据,计量资料进行正态和方差齐性检验,符合正态分布的数据用±s表示,多组间比较采用多因素方差分析,计数资料以率表示,行χ2检验,等级资料采用秩和检验。采用Log-rank进行生存分析,采用Cox比例风险模型分析影响胃癌预后的相关因素。P<0.05表示差异有统计学意义。
2 结果
2.1 不同胃组织中SDCBP的表达情况 SDCBP在胃癌组织中的高表达率为55.0%(33/60),在癌旁组织中的高表达率为3.3%(2/60),差异具有统计学意义(P<0.05)。见表1。

表1 不同胃组织中SDCBP的表达情况(n)
2.2 SDCBP表达与胃癌临床特征的关系 SDCBP在胃癌组织中的表达水平与患者的性别、肿瘤直径、TNM分期、肿瘤分化程度无关(P>0.05),与年龄、浸润深度、淋巴结转移有关(P<0.05)。见表2。

表2 SDCBP表达与胃癌临床特征的关系[n(%)]
2.3 SDCBP不同表达水平患者的生存情况 SDCBP高表达组的中位无病生存时间和中位总生存时间分别为19个月、28个月,无病生存率和总生存率分别为15.15%(5/33)、36.36%(12/33);SDCBP低表达组的中位无病生存时间和中位总生存时间分别为21个月、34个月,无病生存率和总生存率分别为29.63%(8/27)、66.67%(18/27)。经Log-rank检验,SDCBP高表达组与低表达组的无病生存率比较差异无统计学意义(P>0.05),而SDCBP高表达组的总生存率明显低于低表达组(P<0.05)。
2.4 影响胃癌预后的Cox比例风险模型分析 单因素Cox回归分析显示,浸润深度、TNM分期、淋巴结转移是影响胃癌患者无病生存期的危险因素,经进一步多因素Cox回归分析显示,TNM分期是影响胃癌患者无病生存期的危险因素。见表3。
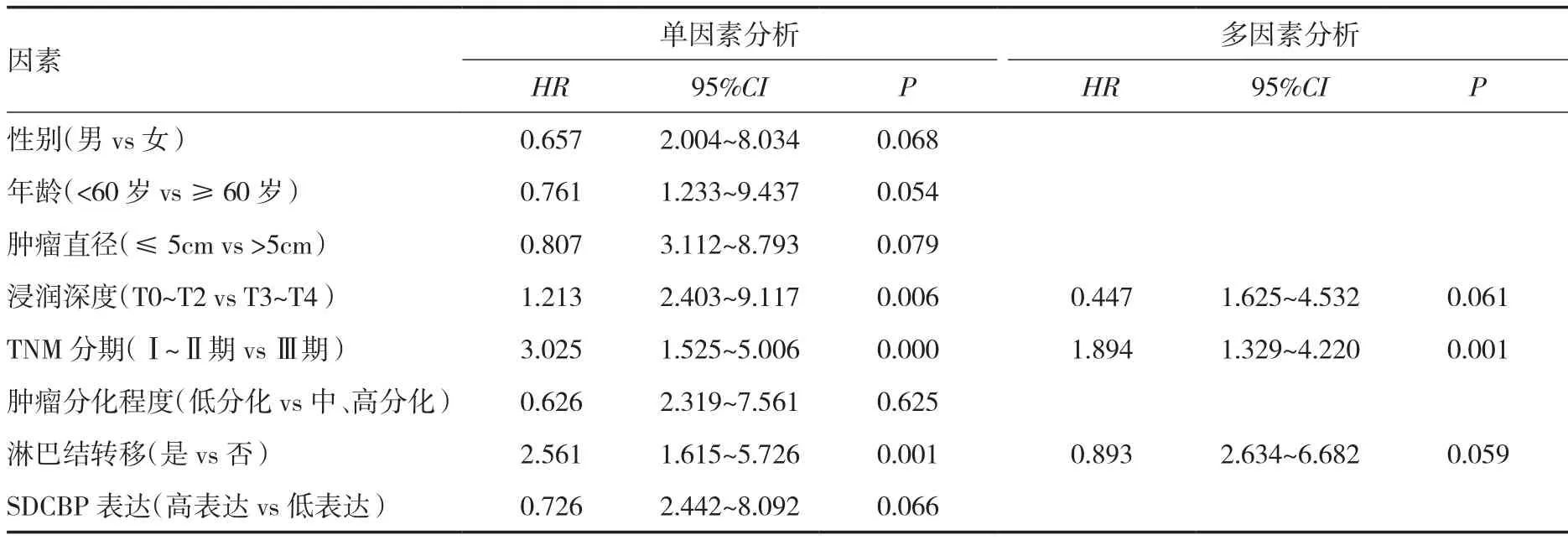
表3 胃癌患者无病生存期的单因素及多因素Cox回归分析
单因素Cox回归分析显示,浸润深度、TNM分期、肿瘤分化程度、淋巴结转移、SDCBP表达是影响胃癌患者总生存期的危险因素,经进一步多因素Cox回归分析显示,TNM分期、淋巴结转移是影响胃癌患者总生存期的独立危险因素。见表4。
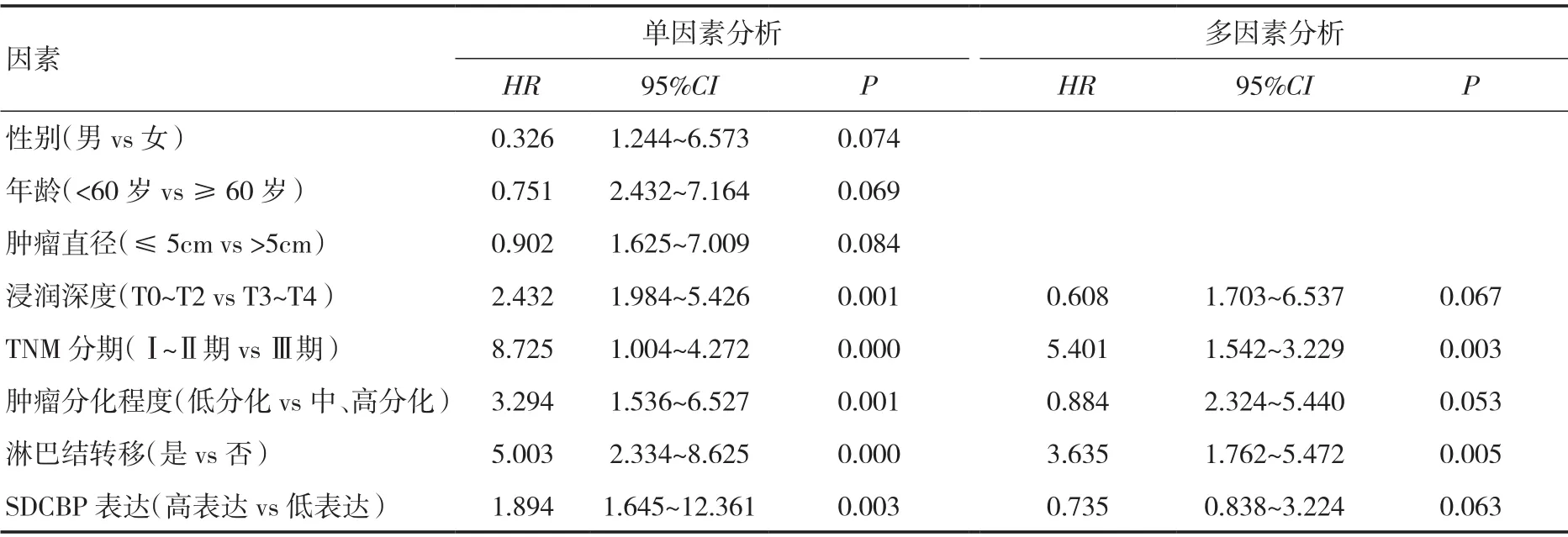
表4 胃癌患者总生存期的单因素及多因素Cox回归分析
3 讨论
早期胃癌经规范治疗一般预后较好,但临床上确诊时多为局部进展期胃癌,预后不佳,术后易复发,5年生存率不到15%[2]。我国有超过70万的胃癌患者在诊断时已进入进展期[3],因此患者不得不面临肿瘤复发、转移及死亡风险。近些年人们一直在探索新的分子标志物,以期提高胃癌早期诊断、靶向治疗及预后判断的水平。
SDCBP是一种具有多种生物活性的支架-PDZ结构域蛋白。PDZ结构域是许多支架蛋白的共同结构域,可促进蛋白质支架和蛋白复合物组装,不同的蛋白复合物构型可形成很多信号和调控通路,对很多细胞过程发挥重要作用。SDCBP在细胞质中可与多种跨膜蛋白C-末端的结构域结合,从而影响细胞形状及蛋白质的转运和转录因子的激活等。SDCBP的高表达与多种恶性肿瘤相关,可通过与细胞膜受体蛋白的结合和分离,参与细胞内蛋白质的运输、细胞骨架的构建和转录因子的激活,从而提高肿瘤细胞的增殖、黏附、侵袭、转移和肿瘤血管形成能力。有研究表明SDCBP在正常人类细胞和不同来源的人类癌细胞中表达时是一个前转移基因,具有诱导侵袭和转移的能力[4]。癌症基因组图谱(The cancer genome atlas,TCGA)数据库显示,与SDCBP低表达的肿瘤相比,SDCBP高表达的患者预后较差,生存率较低[5]。也有研究显示SDCBP在调节细胞与细胞、细胞与细胞外基质的黏附过程中起核心作用,且SDCBP还参与细胞内信号转导、细胞表面的靶向作用、神经突触传递和轴突生长[6]。
本研究结果显示,SDCBP在胃癌组织与癌旁组织中的表达差异有统计学意义,证明SDCBP与胃癌关系密切。目前SDCBP对肿瘤影响的机制尚未完全清楚,在黑色素瘤和胶质瘤中,SDCBP可通过原癌基因酪氨酸蛋白激酶Src/p38 MAPK信号通路参与NF-κB活化,从而上调基质金属蛋白酶2(MMP-2)等NF-κB靶基因的表达,这是一种参与肿瘤细胞侵袭的关键分泌金属蛋白酶[7]。本研究发现≥60岁胃癌患者的SDCBP高表达比例明显高于<60岁者,同时有淋巴结转移、浸润深度为T3~T4期患者的SDCBP高表达比例明显高于无淋巴结转移、T0~T2者,而不同性别、肿瘤直径、TNM分期、肿瘤分化程度的胃癌患者SDCBP表达水平无显著性差异。提示SDCBP高表达对胃癌淋巴结转移发挥重要作用,胃癌导致的寿命损失随年龄增加呈现先升后降的趋势,在70~80岁达到高峰[8],而SDCBP在老年胃癌患者中的表达升高,促进肿瘤侵袭、转移,可能是老年患者寿命损失的一个潜在内因。
本研究结果显示SDCBP的表达对胃癌患者的总生存时间产生影响。经Cox比例风险模型分析,排除了SDCBP是影响胃癌患者无病生存期的独立危险因素,而单因素分析中SDCBP是影响胃癌患者总生存期的危险因素,说明SDCBP作为促基因在肿瘤转移中发挥作用,它可能成为评价胃癌发展、转移和预后的一个有价值的指标,为指导临床治疗提供新的靶点。本研究局限性,任何一种基因都不可能是决定肿瘤转移的唯一因素,且多因素分析排除了SDCBP是总生存期的独立危险因素。因此需要进一步的研究与探索,将SDCBP与其他相关因素结合起来,以提高临床诊断价值。
综上,本研究初步揭示了SDCBP在胃癌组织中的表达上调,且与淋巴结转移相关,由于样本数较少,其对胃癌高危预警、早期诊断、靶向治疗及预后判断的价值尚需大样本、高质量研究进一步探讨。

