血清TK1结合肿瘤标记物评估乳腺癌新辅助化疗疗效的价值观察
唐利娟,程智勇,门晓彦,韩猛,吕骥
(1.秦皇岛市第一医院教育处;2.秦皇岛市海港医院内分泌科;3.秦皇岛市第一医院乳腺外科,河北 秦皇岛 066000)
乳腺癌属于女性高发恶性肿瘤,且发病率呈现逐年升高趋势[1]。有调查[2]表明,女性恶性肿瘤中,约10%为乳腺癌。新型辅助化疗为当前乳腺癌常用辅助治疗方法,可于围术期加快肿瘤细胞凋亡,通过缩小病灶,提高临床疗效,还能够控制或消除微转移灶,评估癌细胞化疗敏感度,用于术后化疗指导[3-5]。但临床尚缺乏准确评估化疗疗效的指标,如何评估其疗效为当前重要课题。临床研究[6-7]认为,肿瘤标记物与乳腺癌诊断、预后及疗效密切相关,比如糖类抗原15-3(CA15-3)、糖类抗原125(CA125)、癌胚抗原(CEA)、肿瘤异常蛋白(TAP)等。其中,TAP属于新型肿瘤标记物,已在多种恶性肿瘤临床诊断中得到应用,包括膀胱癌、肝癌、乳腺癌、宫颈癌与结直肠癌等。胸苷激酶1(TK1)能够评估细胞增殖活性,随着癌细胞DNA复制,血清TK1水平明显升高[8]。本研究旨在分析血清胸苷激酶1(TK1)结合肿瘤标记物对乳腺癌新辅助化疗疗效的评估价值。
1 资料与方法
1.1 一般资料
选取2017年2月至2021年3月秦皇岛市第一医院收治的150例乳腺癌患者为研究对象,按照新辅助化疗临床疗效分为有效组(n=96)与无效组(n=54)。本研究符合《赫尔辛基宣言》原则。纳入标准:(1)穿刺活检为乳腺癌,且为局部晚期;(2)初发乳腺癌;(3)在本院接受新辅助化疗及手术治疗;(4)临床资料完整;(5)精神正常,意识清晰,签署知情同意书。排除标准:(1)合并严重心肝肾功能障碍;(2)合并内分泌系统、自身免疫系统或者血液系统疾病;(3)合并急性感染或者其他肿瘤病变;(4)远处转移患者;(5)贫血患者及月经期患者。
1.2 方法
1.2.1 新辅助化疗方法 所有患者均行AC-T方案:第1天,静脉滴注多柔比星(浙江海正药业股份有限公司)60 mg/m2+环磷酰胺(江苏盛迪医药有限公司)600 mg/m2,21 d/周期,行4个周期;序贯:静脉滴注紫杉醇(上海新亚药业有限公司)80 mg/m2,7 d/周期,行12个周期。化疗后予以手术治疗。
1.2.2 疗效评估 术后1周进行疗效评估,按照实体瘤反应评价标准(RECIST)[9]分为完全缓解(CR)、部分缓解(PR)、进展(PD)、稳定(SD)。CR:所有目标病灶完全消失,并连续4周没有检出新发病灶;PR:病灶最长径总和缩短达到30%,同时持续4周;PD:肿瘤最长径增加≥20%或产生新发病灶;SD:肿瘤最长径之和缩短却没有达PR或者有增加却没有达PD。
1.2.3 TK1、CA15-3、CA125、CEA水平检测 分别在化疗前与化疗12个周期后抽取受试者空腹静脉血样本3 mL,3 000 rpm离心15 min分离血清,采用酶联免疫吸附法检测TK1、CA15-3、CA125、CEA水平,相关试剂盒购自上海恒远生物科技有限公司;TAP的测定则需制作血涂片,并于显微镜下进行凝聚物颗粒观察,同时测量其面积。
1.3 统计学分析
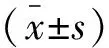
2 结果
2.1 两组患者临床资料比较
两组患者年龄、体重指数(BMI)、月经状态、肿瘤大小、淋巴结状态、组织学分型、分子分型比较,差异无统计学意义(P>0.05)。化疗前两组患者血清TK1、CA15-3、CA125、CEA水平、TAP及化疗后血清CA125、CEA水平比较,差异无统计学意义(P>0.05)。化疗12个周期后,两组患者血清TK1、CA15-3水平及TAP比较,差异有统计学意义(P<0.05)。 见表1。
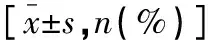
表1 两组患者临床资料比较
2.2 影响乳腺癌新辅助化疗疗效的因素
回归分析显示,化疗12个周期后,血清TK1、CA15-3水平及TAP是影响乳腺癌新辅助化疗疗效的因素(P<0.05)。见表2。
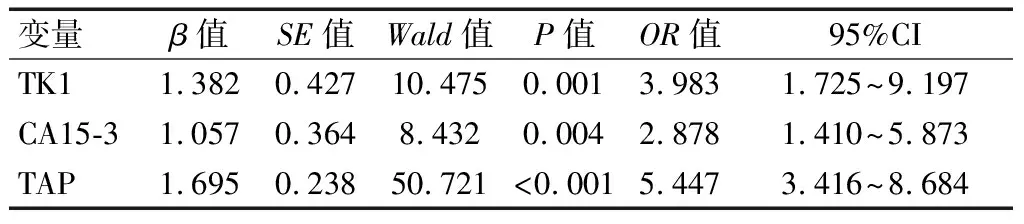
表2 影响乳腺癌新辅助化疗疗效的因素
2.3 TK1、CA15-3、TAP对乳腺癌新辅助化疗疗效的评估价值
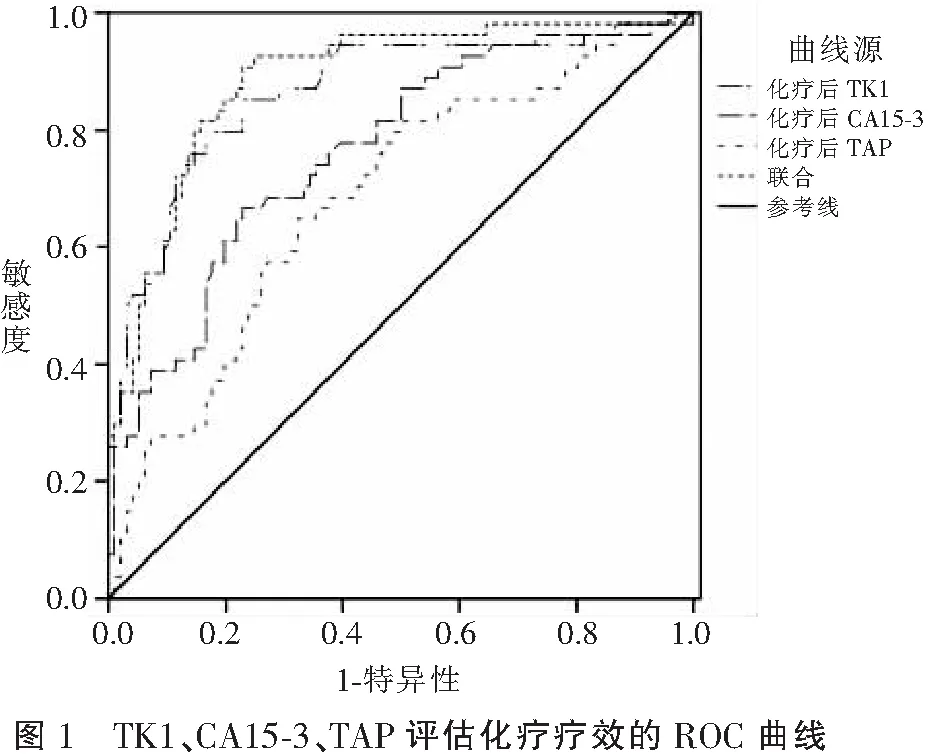
ROC曲线分析显示,化疗12个周期后,血清TK1、CA15-3水平与TAP联合评估新辅助化疗疗效的曲线下面积(AUC)最大,敏感度和特异度最高。见表3及图1。
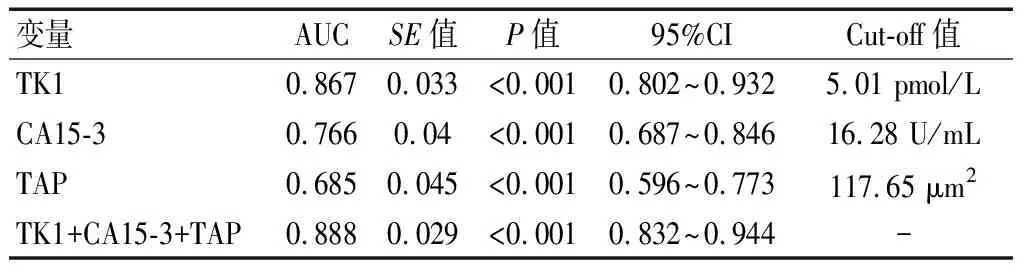
表3 曲线下面积
3 讨论
现阶段,主要采取临床评估法与病理学评估法进行新辅助化疗疗效评价,其中临床评价分为触诊与影像学检查两种,触诊易受医师个人主观影响,同时难以预估深部病灶;影像学评估操作便捷,并且可重复性好,应用较为广泛,但价格较高,尤其是乳腺核磁共振,且评估结果也非完全可靠;病理学检查虽然准确,但需要于术后进行,因此容易错失合理调整化疗方案最佳时机。
既往研究[10-11]指出,血清肿瘤标记物(CEA、CA125、CA15-3等)可在乳腺癌临床诊断与预后评估中发挥一定作用。CEA属于非特异性肿瘤抗原(主要提取于结肠癌组织与胎儿肠组织),于乳腺癌中也可检出一定程度表达,然而其对乳腺癌敏感性相对较低[12]。CA125属于卵巢癌病变特异性标记物,也可表达于乳腺癌。本研究中,两组治疗后CA125、CEA均降低(P<0.05),但组间差异无统计学意义(P>0.05),提示CA125、CEA在化疗疗效评估中的价值不高。CA15-3为人体乳腺癌相关抗原,主要分布在肿瘤细胞表面,一旦细胞癌变,将提高细胞膜蛋白酶以及唾液酶活性,损害细胞骨架,促使细胞表面抗原大量凋落,造成血清CA15-3水平提高。既往研究[13]认为,CA15-3能够用于乳腺癌复发与病灶转移监测。亦有报道[14]称,CA15-3水平提升和肿瘤负荷增加具有正相关性。本研究中,有效组化疗后CA15-3低于无效组(P<0.05),表明化疗后CA15-3水平检测可能在化疗疗效评估上有一定意义。TAP亦有异常糖链糖蛋白之称,为癌症病变初期体内致癌因子引起原癌基因以及抑癌基因突变所形成的复合物,一般癌细胞异常增生会有TAP水平升高变化[15]。本研究显示,有效组化疗后TAP水平更低(P<0.05),表明化疗后TAP可能对化疗评估具有一定指导作用。有研究[16]表明,血清TK1水平变化和细胞增殖生长存在紧密联系,能够用于判断细胞增殖活性,同时亦可反映恶性肿瘤增殖度,用于疗效判定。本研究中,有效组化疗后血清TK1水平更低(P<0.05),与上述研究观点相符,主要可能是由于化疗有效的患者病灶明显缩小,细胞增殖活性降低,因此血清TK1表达水平更低。回归分析发现,化疗后TK1、CA15-3、TAP水平与乳腺癌新辅助化疗疗效密切相关,可作为独立预测因子。ROC分析显示,化疗后TK1、CA15-3、TAP及三者联合评估化疗疗效的AUC依次为0.867、0.766、0.685、0.888,联合评估AUC最大,效能最高,敏感度90.7%,特异度77.1%。考虑到虽然血清TK1、CA15-3、TAP水平变化能够在一定程度反映乳腺癌进展状况及疗效,但不能完全通过其检测进行判定,还应该结合影像学结果进一步明确,以作出更准确的评估。
综上,化疗后血清TK1、CA15-3、TAP水平与乳腺癌新辅助化疗疗效密切相关,属于独立预测因子,三者结合在化疗疗效评估中的应用价值更高,可更好辅助疗效评估。

