门冬胰岛素30注射液联合利拉鲁肽皮下注射治疗2型糖尿病效果观察
孙静,王冬,马立云,邵亮,刘重梅
邢台市第五医院内三科,河北邢台 054000
胰岛β 细胞功能损伤是2 型糖尿病(T2DM)发生、发展的决定性因素,改善残存胰岛β 细胞功能、增加胰岛β 细胞数量是T2DM 的治疗关键[1-2]。研究表明,胰岛素强化治疗可快速降低高血糖对胰岛β细胞的毒性作用,从而改善其功能,对口服常规降糖药物失效的T2DM 患者具有良好疗效[3]。但胰岛素强化治疗无法修复胰岛β 细胞,因此不能长期有效控制血糖。利拉鲁肽是新型胰高血糖素样多肽1(GLP-1)受体激动剂,具有血糖依赖性的促胰岛素分泌作用,并可直接诱导胰岛β细胞增殖和分化、抑制细胞凋亡、改善其功能[4]。另有研究证实,25-羟基维生素D[25-(OH)D]、分泌型卷曲相关蛋白5(SFRP5)均参与了T2DM 患者糖脂代谢、胰岛素抵抗(IR)、胰岛β细胞功能损害、炎症反应等病理生理过程[5]。因此,本研究观察了2型糖尿病患者采取门冬胰岛素30 强化降糖后联合利拉鲁肽治疗后的糖脂代谢及血清25-(OH)D、SFRP5水平变化。现报告如下。
1 资料与方法
1.1 临床资料 选取2019 年12 月—2021 年12 月我院收治的T2DM 患者94 例,随机分为观察组和对照组,每组47 例。纳入标准:①符合《中国2 型糖尿病防治指南(2017 年版)》[6]中的T2DM 诊断标准;②近期血糖控制欠佳;③无甲状腺功能亢进。排除标准:①有糖尿病酮症酸中毒病史;②有活动性肝病史,或天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)高于正常值上限的两倍;③存在肾功能异常,肾小球滤过率(eGFR)<60 mg/(min·1.73 m2)或血肌酐>1.3 mg/dL(女性)、>1.4 mg/dL(男性);④伴有恶性肿瘤或急慢性感染;⑤对本研究药物不耐受、过敏或存在禁忌证;⑥存在精神障碍或沟通障碍。观察组男29 例、女18 例,年龄(59.03 ± 7.85)岁,BMI(29.21 ± 2.14)kg/m2,病程(7.03 ± 2.10)年,腰臀比0.93±0.06,合并高血压20例、高脂血症21 例、冠心病8 例;对照组男28 例、女19 例,年龄(57.79 ± 7.41)岁,BMI(29.09 ± 1.96)kg/m2,病程(6.64 ± 1.95)年,腰臀比0.94 ± 0.07,合并高血压18 例、高脂血症20 例、冠心病9 例。本研究通过医院伦理委员会审核,患者均签署知情同意书。
1.2 治疗方法 对两组患者进行系统糖尿病知识教育,给予合理饮食、运动指导,并培训胰岛素注射方法。对照组给予门冬胰岛素30强化降糖治疗,使用MinMed 712 胰岛素泵,推荐起始剂量为0.4~0.6U/(kg·d),早、午、晚餐前即刻皮下注射,注射比例分别为30%、25%、45%,每3~4 d监测1次血糖谱(三餐前及餐后2 h、凌晨两点),根据血糖调整胰岛素剂量,血糖控制目标为空腹血糖(FPG)<7.0 mmol/L,餐后2 h血糖(2 h PG)<10 mmol/L。观察组在对照组的基础上早餐前给予利拉鲁肽皮下注射,首周0.6 mg/次、1 次/天,1 周后改为1.2 mg/次、1 次/天。两组均治疗12周。
1.3 疗效及安全性评价方法 两组治疗前后空腹抽取外周静脉血5 mL,3 500 r/min 离心9 min(离心半径8 cm),取上层血清。①血糖相关指标:采用日立7600-120 全自动生化分析仪检测FPG、2 h PG,酶联免疫吸附法检测血清糖化血红蛋白(HbA1c)。②血糖变异指数:采用美国Medtronic MiniMed 公司动态血糖监测系统(CGMS),将感应探头置于腹部皮下,进行72 h 持续血糖监测,每隔5 min 记录组织间液葡萄糖浓度。每日输入指尖血糖值≥4 次,以校正CGMS结果,最长输入时间间隔≤12 h。采用软件Mi⁃IliMed solutions cGMs Sensor 分析检测结果,计算血糖值标准差(SDBG)、最大血糖波动幅度(LAGE)、餐后血糖漂移(PPGE)、日间血糖漂移参数(MODD)。③血脂相关指标及BMI:采用日立7600-120 全自动生化分析仪检测甘油三酯(TG)、总胆固醇(TC),根据身高和体质量计算BMI。④胰岛功能相关指标:胰岛素抵抗指数(HOMA-IR)=空腹胰岛素(FINS)×FBG/22.5,胰岛β 细胞功能指数(HOMA-β)=20×FINS/FBG−3.5。⑤血清25-(OH)D、SFRP5 水平:采用酶联免疫吸附法检测SFRP5 水平,化学发光法检测25-(OH)D 水平。⑥不良反应:记录两组恶心、呕吐、低血糖等不良反应的发生率。
1.4 统计学方法 采用SPSS22.0 统计软件。计量资料采用K-S正态性检验,呈正态分布以±s表示,组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后血糖相关指标比较 与治疗前比较,两组治疗后FPG、2 h PG、HbAlc均降低,但观察组降低更明显(P均<0.05)。见表1。
表1 两组治疗前后FPG、2 h PG、HbAlc比较(±s)
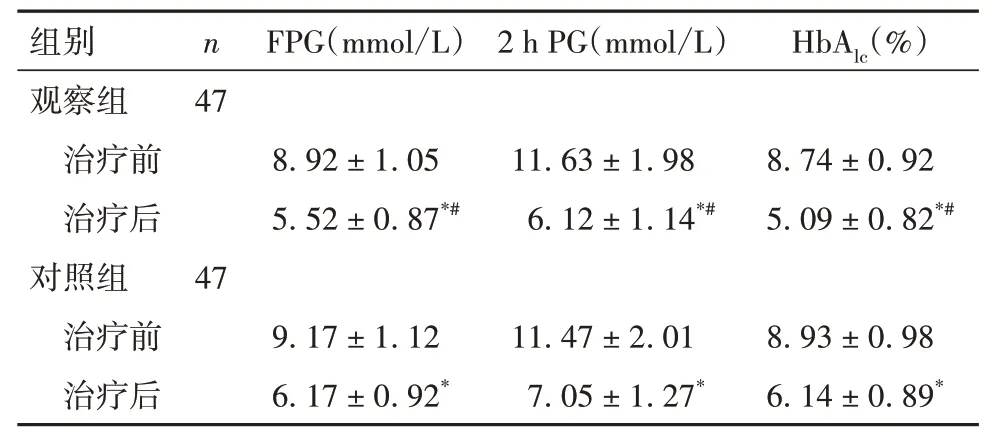
表1 两组治疗前后FPG、2 h PG、HbAlc比较(±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
?
2.2 两组治疗前后血糖变异指数比较 与治疗前比较,两组治疗后SDBG、LAGE、PPGE、MODD均降低,但观察组降低更明显(P均<0.05)。见表2。
表2 两组治疗前后SDBG、LAGE、PPGE、MODD比较(mmol/L,±s)

表2 两组治疗前后SDBG、LAGE、PPGE、MODD比较(mmol/L,±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
?
2.3 两组治疗前后血脂相关指标及BMI 比较 与治疗前比较,两组治疗后TG、TC 及BMI 均降低,但观察组降低更明显(P均<0.05)。见表3。
表3 两组治疗前后TG、TC、BMI比较(±s)
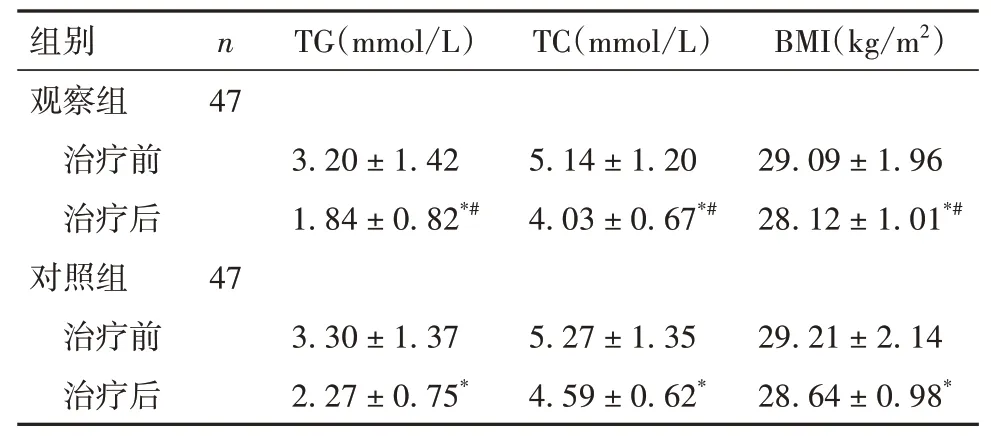
表3 两组治疗前后TG、TC、BMI比较(±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
?
2.4 两组胰岛功能相关指标比较 与治疗前比较,两组治疗后HOMA-IR 均降低,HOMA-β 均升高,但观察组变化更明显(P均<0.05)。见表4。
表4 两组治疗前后HOMA-IR、HOMA-β比较(mmol/L,±s)
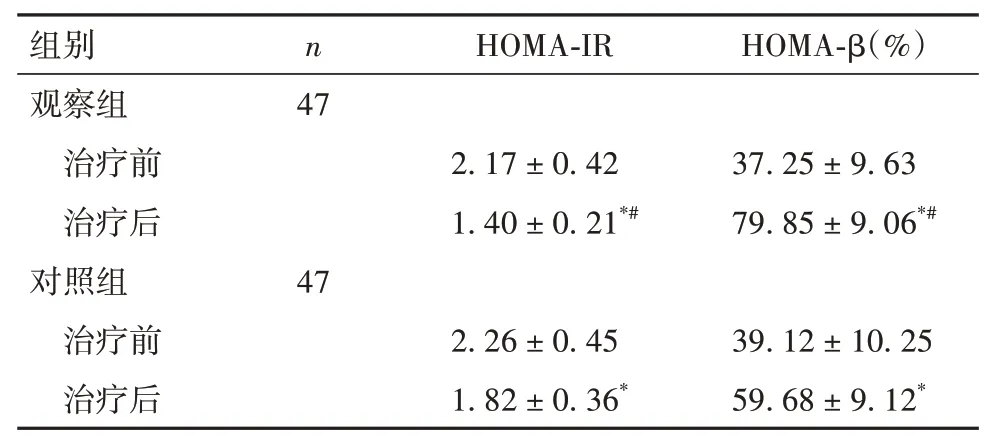
表4 两组治疗前后HOMA-IR、HOMA-β比较(mmol/L,±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
?
2.5 两组治疗前后血清25-(OH)D、SFRP5 水平比较 与治疗前比较,两组治疗后血清25-(OH)D、SFRP5水平均升高,但观察组升高更明显(P均<0.05)。见表5。
表5 两组治疗前后血清25-(OH)D、SFRP5水平比较(mmol/L,±s)

表5 两组治疗前后血清25-(OH)D、SFRP5水平比较(mmol/L,±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
?
2.6 两组不良反应发生率比较 观察组发生恶心3 例、呕吐2 例、低血糖0 例,不良反应发生率为10.64%(5/47),对照组分别为2、2、4 例及17.02%(8/47),两组不良反应发生率比较P>0.05。
3 讨论
T2DM 的病理生理基础是胰岛β 细胞功能进行性减退与IR,其中胰岛β 细胞功能进行性减退是病情持续进展及血糖难以长期稳定控制的重要原因之一[7]。随着病程的延长,T2DM 患者胰岛β 细胞功能将出现不同程度的损伤,导致依赖于内源性胰岛素分泌的降糖药物疗效越来越差。胰岛素泵模拟了胰岛素持续基础分泌与进餐时脉冲式释放的方式,符合生理状态,可有效消除高糖毒害与IR,减少胰岛素剂量,改善胰岛β 细胞功能[8]。门冬胰岛素30 是模拟生理性胰岛素分泌的双时相胰岛素类似物。仲维莉等[9]研究显示,门冬胰岛素30 强化降糖对初发T2DM 和血糖控制不佳的T2DM 患者均安全、有效。胰岛素强化降糖的不足之处在于无法修复胰岛β细胞,即使治疗成功,长期高糖负荷仍会继续加重胰岛β细胞负担,无法长期有效控制血糖[10]。
新近研究发现,T2DM 患者肠促胰岛素分泌量降低或合并肠促胰岛素抵抗,抑制胰岛β细胞分泌、增殖,加重胰岛β 细胞功能进行性下降[11]。GLP-1属肠促胰岛素的一种,具有显著的抗高血糖作用,其作用机制主要有:①葡萄糖依赖性促胰岛素分泌,并通过cAMP 依赖机制促进胰岛素基因转录,增加胰岛素mRNA表达,进而促进胰岛素生物合成[12];②直接诱导胰岛β 细胞增殖和分化,增加DNA 合成,进而增加胰岛β 细胞数量[13];③依靠葡萄糖作用于胰岛β 细胞,刺激胰岛素、生长抑素分泌,通过间接作用实现对胰高血糖素分泌的抑制[14];④通过GLP-1受体介导,抑制胰岛β 细胞凋亡。但GLP-1 极易在人体内被二肽基肽酶4(DPP-Ⅳ)降解,作用时间显著缩短。利拉鲁肽属于GLP-1受体人工合成受体激动剂,与GLP-1 同源性达97%,具有与GLP-1 相似的功效,且代谢稳定性较高,半衰期为13 h 左右,可有效控制血糖、保护胰岛β细胞。动物研究证实,利拉鲁肽可提高T2DM 大鼠的糖耐量,促进胰岛β 细胞再生和修复,并抑制胰岛β细胞凋亡[15]。同时,利拉鲁肽可通过刺激调节食欲的下丘脑中枢GLP-1受体而抑制食欲,激动胃黏膜壁上的GLP-1受体,影响交感、迷走神经调节作用,抑制胃排空,降低主动进食[16]。本研究结果显示,门冬胰岛素30 强化降糖联合利拉鲁肽皮下注射可改善T2DM 患者的糖脂代谢及IR,增强胰岛β细胞功能,降低BMI。
研究指出,血糖变异指数增加是T2DM 患者胰岛β细胞功能进一步损害的重要影响因素[17]。与持续高血糖相比,血糖变异指数增加更易引起活性氧、活性氮自由基生成,导致胰岛β细胞氧化应激损伤,增加胰岛β 细胞凋亡[18]。本研究结果显示,观察组治疗后SDBG、LAGE、PPGE、MODD 均低于对照组,提示在门冬胰岛素30 强化降糖的基础上加用利拉鲁肽皮下下注射可平稳控制T2DM 患者的血糖,进一步保护胰岛β 细胞功能;考虑与利拉鲁肽控制FPG与餐后血糖有关,但具体机制尚未完全阐明。
维生素D 是一种脂溶性维生素,其活性形式1,25-二羟基维生素D3具有保护胰岛β 细胞功能、减少外周组织IR、减轻炎症反应等作用[19]。95%以上的血清25-(OH)D 来自1,25-二羟基维生素D3的前体,稳定性好、半衰期长,是反映维生素D活性的良好指标。SFRP5 是具有抗炎作用的脂肪因子,可减轻炎症反应对胰岛素信号通路的抑制,进而增强胰岛素敏感性,改善糖代谢异常[20]。研究证实,T2DM 患者血清25-(OH)D、SFRP5 水平均显著降低,且与糖脂代谢、IR 相关[21-22]。本研究结果显示,与治疗前比较,两组治疗后血清25-(OH)D、SFRP5水平均升高,且观察组升高更明显;分析原因,利拉鲁肽可增强胰岛β细胞功能,改善糖脂代谢及IR,进而反馈调节血清25-(OH)D、SFRP5 水平。但本研究未阐明25-(OH)D、SFRP5 表达是否存在相关性及通过哪种通路形成反馈调节关系,有待进一步论证。本研究两组不良反应发生率无明显差异,提示二者联合的安全性高。值得注意的是,观察组未发生低血糖,对照组发生4 例低血糖,可能与利拉鲁肽降低血糖变异指数有关。

