恩格列净灌胃对急性心肌梗死小鼠心功能的改善作用及其机制
李彬,于翔
天津医科大学朱宪彝纪念医院心血管内科天津市内分泌研究所国家卫生健康委员会激素与发育重点实验室天津市代谢性疾病重点实验室,天津 300134
急性心肌梗死(AMI)后心室重构是心力衰竭和心源性猝死发生发展的基础[1]。随着心脏介入技术的快速发展,早期血运重建可以有效挽救濒死的心肌,但仍有大部分患者由于各种原因未能及时完成血运重建,导致心肌细胞发生不可逆的死亡,引起心室重构,最终发展为心力衰竭(HF)。炎症在AMI的发生发展中起着重要作用[2]。RIDKER等[3]研究结果表明,以核苷酸结合寡聚化结构域样受体蛋白3(NL⁃RP3)炎症小体和白细胞介素1β(IL-1β)为治疗靶点的Canakinumab 可能对患者有效。然而,Canakinumab价格昂贵,不太可能广泛应用于AMI 的治疗。恩格列净是一种高选择性钠—葡萄糖共转运蛋白2(SGLT-2)抑制剂,是一类新型降糖药物,可通过抑制SGLT-2 的转运而减少肾脏对葡萄糖重吸收,增加尿糖排泄,进而降低血糖[4]。SGLT-2 抑制剂除了能有效降低血糖和糖化血红蛋白,还能减轻体质量、降低血压和尿蛋白、延缓肾脏损害,从而预防2型糖尿病心血管事件的发生。研究显示,SGLT-2 抑制剂可以通过抑制活性氧(ROS)/NLRP3/半胱氨酸蛋白酶1(Caspase-1)信号通路来抑制动脉粥样硬化的炎症反应[5]。SGLT-2 抑制剂还可以抑制NLRP3/凋亡相关微粒蛋白(ASC)通路激活,减轻2 型糖尿病小鼠糖尿病性心肌病的发展[6]。目前,关于SGLT-2 抑制剂对AMI 作用的研究较少。2020 年10 月—11 月,本研究观察了恩格列净对AMI 小鼠心功能的影响,并探讨其机制是否与NLRP3/ASC/Caspase-1 信号通路有关。现报告如下。
1 材料与方法
1.1 材料 实验动物:雄性C57BL/6J 小鼠34 只,6周龄,均购自北京斯贝福生物科技有限公司;给予普通饲料喂养,动物室内温度为24 ℃,每日光照时间为12 h。主要药物:恩格列净购自德国勃林格殷格翰药业有限公司。主要试剂:TUNEL试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE 凝胶快速制备试剂盒、SDS-PAGE蛋白上样缓冲液及NLRP3、ASC、Caspase-1、裂解的半胱氨酸蛋白酶1(cleaved Caspase-1)、IL-1β、白细胞介素18(IL-18)、羊抗兔IgG-HRP、β-actin抗体均购自中国万类生物科技有限公司;NLRP3、ASC、Caspase-1、IL-18、IL-1β及C反应蛋白(CRP)ELISA试剂盒均购自中国上海岚派生物科技有限公司。
1.2 动物分组及处理方法 将34只C57BL/6J小鼠随机分为假手术组11 只、模型组11 只和治疗组12只。模型组与治疗组建立AMI模型,方法如下:将小鼠置于气体麻醉诱导箱内诱导麻醉,取仰卧位,四肢固定于简易手术台上,采用2%异氟醚(0.3 mL/min)经鼻吸入维持麻醉;左胸部去毛、消毒,暴露左胸第4 肋间隙,行1 cm 左右皮肤切口,将缝线穿过切口皮肤做缝合前状态,逐层分离皮肤、皮下组织、肌层,暴露心脏,迅速将心脏挤出胸腔,用6-0 无菌缝合线穿过小鼠左心耳下方2~3 mm 处左冠状动脉前降支,并进行结扎;观察结扎部位,以远端心肌变成苍白色提示造模成功;将心脏迅速回纳至胸腔,逐层缝合。假手术组只穿线不结扎。治疗组于建型后4 h 给予恩格列净10 mg/(kg·d)灌胃,连续7 d。假手术组及模型组分别给予等量0.5%羟乙基纤维素灌胃。
1.3 心功能观察 采用超声心动图检查。各组分别于分组处理后进行超声心动图检查,采用Vevo2100高分辨率超声显像仪,探头频率30 MHz,在胸骨旁长轴切面使用M 型超声心动图测量左心室收缩末期内径(LVIDs)、左心室舒张末期内径(LVIDd)、左心室射血分数(LVEF)和短轴缩短率(FS),所有参数取3个连续心动周期的平均值。
1.4 心脏组织细胞凋亡情况观察 采用TUNEL染色。各组小鼠分组处理后经内眦静脉采血,3 000 r/min离心10 min,分离血清后置于−80 ℃保存。颈椎脱臼法处死小鼠后取心脏,4%多聚甲醛固定,常规石蜡包埋,4 µm 厚度切片。二甲苯脱蜡,梯度乙醇脱水,PBS洗涤。将切片与50 µL TUNEL 反应液在37 ℃黑暗条 件下 孵育90 min,PBS 洗 涤3 次,DAPI 染 核10 min。封片后用荧光显微镜记录并拍照,蓝染代表总细胞核,红色荧光代表凋亡细胞核,即为阳性细胞。心肌组织细胞凋亡率=凋亡细胞核数/总细胞核数×100%。
1.5 血 清NLRP3、ASC、Caspase-1、IL-1β、IL-18、CRP 水平检测 采用ELISA 法。取各组−80 ℃冰箱保存的血清,按照ELISA 试剂盒说明书检测血清NLRP3、ASC、Caspase-1、IL-1β、IL-18、CRP水平。
1.6 心肌组织中NLRP3、ASC、Caspase-1、cleaved Caspase-1、IL-1β、IL-18 表 达 检 测 采 用Western blotting 法。取各组心肌组织,加入RIPA 缓冲液裂解,4 ℃条件下12 000 r/min 离心10 min,分离上清提取蛋白质,BCA 蛋白浓度测定试剂盒测定蛋白浓度。制备SDS-PAGE 凝胶,将蛋白上样液分离后转印至PVDF 膜进行封闭。4 ℃条件下分别加入NL⁃RP3、ASC、Caspase-1、cleaved Caspase-1、IL-1β、IL-18、β-actin 一抗(稀释比例分别为1∶500、1∶500、1∶500、1∶500、1∶500、1∶500、1∶1 000),孵育过夜。洗膜,37 ℃条件下加入二抗(稀释比例均为1∶5 000),孵育45 min。使用ECL 发光底物检测抗体,曝光后扫描。采用凝胶图象处理系统及Gel-Pro-Analyzer软件分析条带灰度值,计算目的蛋白相对表达量。
1.7 统计学方法 采用SPSS23.0 统计软件。计量资料采用S-W 正态性检验,呈正态分布以±s表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
每组各有2 只小鼠在造模过程中死亡,治疗组有1只于造模后24 h内心脏破裂死亡。最终每组各有9只小鼠存活,共27只小鼠完成实验。
2.1 各组小鼠心功能相关指标比较 各组小鼠LVIDd 比较P>0.05。与假手术组比较,治疗组和模型组小鼠LVIDs均升高,LVEF、FS均降低,并且模型组LVEF、FS 降低更明显(P均<0.05)。见表1、OSID码图1。
表1 各组小鼠LVIDd、LVIDs、LVEF、FS比较(±s)

表1 各组小鼠LVIDd、LVIDs、LVEF、FS比较(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
?
2.2 各组小鼠心肌组织细胞凋亡率比较 模型组、治疗组和假手术组小鼠心肌组织细胞凋亡率分别为37.05% ± 1.24%、24.21% ± 5.65%、19.34% ±1.37%,模型组明显高于假手术组和治疗组(P均<0.05),假手术组和治疗组比较无统计学差异(P>0.05)。见OSID码图2。
2.3 各组小鼠血清NLRP3、ASC、Caspase-1、IL-1β、IL-18、CRP 水平比较 与假手术组比较,模型 组 和 治 疗 组 小 鼠 血 清NLRP3、IL-1β、IL-18、CRP 水平均升高,且模型组升高更明显(P均<0.05);与假手术组比较,模型组血清ASC 水平升高,治疗组血清ASC 水平降低(P均<0.05);治疗组血清Caspase-1 水平高于假手术组和模型组(P均<0.05),而假手术组和模型组之间血清Caspase-1 水平比较差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠血清NLRP3、ASC、Caspase-1、IL-1β、IL-18、CRP水平比较(±s)

表2 各组小鼠血清NLRP3、ASC、Caspase-1、IL-1β、IL-18、CRP水平比较(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
?
2.4 各组小鼠心肌组织NLRP3、ASC、Caspase-1、cleaved Caspase-1、IL-1β、IL-18 表达比较 与假手术组比较,模型组、治疗组小鼠心肌组织NLRP3、ASC、cleaved Caspase-1、IL-1β、IL-18 蛋白表达均升高,且模型组升高更明显(P均<0.05)。见表3、OSID 码图3。
表3 各组小鼠心肌组织NLRP3、ASC、Caspase-1、cleaved Caspase-1、IL-1β、IL-18相对表达量比较(±s)
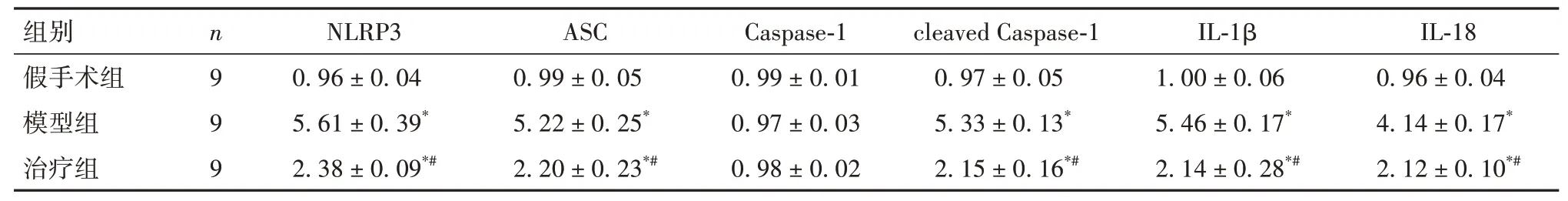
表3 各组小鼠心肌组织NLRP3、ASC、Caspase-1、cleaved Caspase-1、IL-1β、IL-18相对表达量比较(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
?
3 讨论
SGLT-2 抑制剂是一种通过促进尿葡萄糖排泄来降低血糖的新型降糖药,而恩格列净是一种高选择性SGLT-2 抑制剂,除了降糖疗效显著,还显示出良好的心血管效益[7-10]。EMPA-REG OUTCOME 研究结果显示,在合并高心血管风险的2 型糖尿病患者中,恩格列净治疗组的心血管死亡风险下降38%,心力衰竭住院风险下降35%,全因死亡风险下降32%[11]。随后研究显示,另外两种SGLT-2 抑制剂卡格列净和达格列净也具有明显的心血管获益[12-13]。研究表明,达格列净在没有糖尿病的HF 患者中也具有预防的作用[14]。上述研究提示,SGLT-2 抑制剂可能通过降糖之外的其他途径来发挥其心血管保护作用。尽管有大量关于SGLT-2 抑制剂的动物实验和临床研究,但这些药物改善心血管功能的机制尚不清楚。
很多动物实验和临床研究已经报道了SGLT-2抑制剂对缺血性心脏病患者心功能的改善作用。研究显示,在缺血前给予达格列净治疗可以改善大鼠缺血再灌注损伤(IR),提高左心室功能;在缺血期间给予达格列净也被证实有一定的心肌保护作用,但效果不如缺血前用药[15]。但是,在IR 前4 h 或24 h给予恩格列净并不会影响梗死面积[16]。在缺血性心脏病模型中,SGLT-2 抑制剂的大多数相关研究是在IR损伤前或造模期间单次给药,或者在IR损伤后进行4周以上的慢性治疗。另一项研究显示,连续6周恩格列净治疗能够明显改善IR 小鼠的心肌梗死情况[16]。临床上很多患者在AMI 后不能及时进行血运重建,因此有必要在缺血后特别是心肌梗死急性期提供适当的药物干预,以逆转心功能以及后续可能出现的心室重塑。本研究结果显示,对AMI 小鼠连续给予7 d 的恩格列净可显著降低EF 和FS,明显改善心功能,为心肌梗死急性期的药物治疗提供了新的方向。
达格列净治疗可降低IR 大鼠急性期心肌细胞凋亡的数量,提示SGLT-2抑制剂具有抗心肌细胞凋亡的作用[15]。卡格列净治疗可降低雄性大鼠心肌IR 急性期体内凋亡标志物Bax/Bcl-2 水平[15,17]。本研究结果显示,在AMI小鼠中TUNEL 阳性细胞数量显著增多,恩格列净治疗7 d 后TUNEL 阳性细胞数量显著减少;这表明恩格列净可显著减少AMI 小鼠的心肌细胞凋亡,在治疗AMI 后心脏重塑过程中具有重要作用。
NLRP3 炎症小体由NLRP3、ASC 和Caspase-1 组成,当NLRP3 受到各种危险信号的刺激时,其pyrin结构域与配体结合,促进NLRP3、ASC 和Caspase-1的前体组装成活化的炎症小体,并激活Caspase-1;Caspase-1 必须是活性形式才能发挥促炎作用,并且在蛋白质水平更稳定,Caspase-1 活化后进一步将IL-1β 前体(pro-IL-1β)和IL-18 前体(pro-IL-18)加工成具有活性的IL-1β 和IL-18[18]。IL-1β 和IL-18的激活和分泌可触发心肌梗死后细胞焦亡过程,即炎症相关性细胞死亡,从而加重缺血性损伤[19]。在糖尿病小鼠模型中,达格列净通过抑制NLRP3/ASC/Caspase-1 信号通路激活而抑制其心肌病的发展[20]。然而,目前SGLT-2 抑制剂对心肌梗死后NLRP3/ASC/Caspase-1 信号通路的影响尚无广泛研究。NLRP3 炎症小体在心肌梗死后被激活,在啮齿类动物IR 模型中,NLRP3炎症小体组分的缺失可以减轻炎症反应、改善心功能、逆转心肌重塑。本研究结果显示,AMI 小鼠血清CRP、NLRP3、ACS、IL-1β 和IL-18 水平显著升高,心肌组织NLRP3、ASC、cleaved Caspase-1、IL-1β和IL-18蛋白表达显著升高,经恩格列净治疗后显著下降;这提示AMI 后心肌的炎症反应被激活,炎症指标升高,而恩格列净在心肌梗死过程中具有抗炎作用。本研究AMI 小鼠心肌组织cleaved Caspase-1蛋白表达明显升高,而Caspase 1蛋白表达及血清学水平均无明显变化;分析其原因,NLRP3炎症小体被激活后,促使Caspase-1前体自裂解成为有活性的Caspase-1,进而将IL-1β 前体诱导为成熟的IL-1β。
综上所述,恩格列净灌胃治疗可以显著降低AMI小鼠心肌细胞凋亡,并改善左心室功能,其机制可能与抑制NLRP3/ASC/Caspase-1 信号通路有关,提示恩格列净可作为预防AMI 后心肌重塑和心功能不全的治疗药物。本研究进一步证实了抗炎治疗在AMI 治疗中的重要性,但仍需要更多的实验数据来阐明恩格列净的具体作用机制,评估恩格列净治疗AMI的长期安全性和有效性。

