阿曲霉接菌发酵普洱茶的研究
刘琨毅,王利妍,安江珊,罗慧,王兴华,3,马燕,吕才有,赵明
1.云南农业大学 茶学院/食品科学技术学院/云南省药用植物生物学重点实验室/西南中药材种质创新与利用国家地方联合工程研究中心,云南 昆明 650201;2.宜宾职业技术学院 五粮液技术与食品工程学院,四川 宜宾 644003; 3.普洱市茶叶科学研究所,云南 普洱 665000
0 引言
云南普洱茶是我国特有的名茶,其茶汤呈红褐色,滋味醇厚回甘、陈香显著[1]。据报道[2-3],普洱茶可以调节人体肠道微生物菌群,具有抗高脂血症、抗氧化、抗肿瘤、预防糖尿病等多种保健功能。普洱茶独特的风味和保健功能主要归因于其发酵过程中的微生物作用[4-5],但在传统普洱茶自然发酵(Natural Fermentation,NF)过程中,往往存在微生物来源复杂、不可控等因素,从而导致其品质不稳定等问题[6]。
强化发酵(Enhanced Fermentation,EF)是将一种或多种外源微生物接入未经灭菌的原料中进行发酵,以提高发酵产品品质的技术[7]。例如,乳酸菌强化发酵红酸汤可以明显减少亚硝酸盐的含量[8],黑曲霉强化发酵普洱茶可改善普洱茶的感官品质[9]。目前,强化发酵技术在白酒[10-11]、食醋[12]等发酵食品生产过程中已有较广泛的应用,并达到了提高发酵产品品质的目的,但强化发酵技术在普洱茶生产过程中的应用及其对普洱茶微生物群落结构和化学成分的影响却鲜有报道。
阿曲霉(Aspergillusamstelodami)是一种能产纤维素酶的真菌,对形成普洱茶的品质特征具有积极作用[13]。谢晓晨等[14]研究证实,阿曲霉是小青柑(一款普洱茶产品)的优势真菌。因此,将阿曲霉应用于普洱茶发酵不失为一种有益的探索,但接种阿曲霉发酵的普洱茶的感官特征、化学成分及微生物群落结构还需进一步研究,以探究该菌用于发酵普洱茶的可行性。
基于此,本研究拟将从普洱茶中分离获得的阿曲霉A1接种于灭菌和未灭菌的晒青茶中,分别进行普洱茶的纯菌发酵(Pure Fermentation,PF)和强化发酵,分析发酵茶样的感官特征、化学成分及微生物群落结构,以期获得一种提高普洱茶品质的有效方法,为高品质普洱茶的产业化生产提供参考。
1 材料与方法
1.1 主要材料与试剂
晒青茶(选取一芽三叶的云南大叶种云抗10号茶树鲜叶,经摊放、杀青、揉捻、日光干燥至含水量低于10%后制得),云南省普洱市茶叶科学研究所研制;儿茶素(C)、表儿茶素(EC)、没食子酸(GA)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素没食子酸酯(EGCG)、表没食子儿茶素(EGC)、没食子儿茶素(GC)、儿茶素没食子酸酯(CG)、没食子儿茶素没食子酸酯(GCG)、咖啡碱(CA)、鞣花酸(EA)、杨梅素(MY)、木犀草素(LU)、槲皮素(QU)、山奈酚(KA)的标准品,成都曼思特生物科技有限公司产;马铃薯葡萄糖琼脂(PDA)培养基,青岛海博生物技术有限公司产;真菌DNA提取试剂盒、细菌DNA提取试剂盒,生工生物工程(上海)有限公司产;其余化学试剂均为国产分析纯。
1.2 主要仪器与设备
CP214型电子分析天平,上海奥豪斯仪器有限公司产;756CRT型紫外可见分光光度计,上海菁华科技仪器有限公司产;1200型高速液相色谱,配有TSKgel ODS-80TM色谱柱(4.6 mm×250 mm×5 μm),美国安捷伦公司产;Trident 960型基因扩增仪,上海力新仪器有限公司产;CT15RE型离心机,日本日立公司产;SW-CJ-1B型超净工作台,苏州安泰空气技术有限公司产;YS6060型色差仪,深圳市三恩时科技有限公司产。
1.3 实验方法
1.3.1 菌株的分离鉴定从普洱茶(泾普茯茶)中分离纯化得到菌株A1,对其ITS序列进行DNA测序分析[15],并进行系统发育树分析,以明确该菌株为阿曲霉。
1.3.2 阿曲霉A1菌悬液的制备将阿曲霉A1接种于PDA培养基中,于25 ℃条件下培养7 d。用无菌生理盐水洗脱孢子,完成计数后,利用无菌生理盐水将孢子浓度调整至1×107CFU/mL,随后将1 mL孢子悬液接种至100 mL茶叶培养基中,于25 ℃、120 r/min条件下振荡培养4 d,菌体计数后利用无菌生理盐水将菌体浓度调整至1×107CFU/mL,即得阿曲霉A1菌悬液。其中,茶叶培养基是用2 L蒸馏水于100 ℃条件下浸泡100 g晒青茶30 min,经4层纱布过滤后,于121 ℃条件下灭菌20 min而成。
1.3.3 阿曲霉A1纯菌发酵普洱茶方法称取100 g晒青茶(RM)置于500 mL三角瓶中,加入40 mL蒸馏水,湿热(121 ℃,20 min)灭菌,冷却后待用。将阿曲霉A1菌悬液接种于灭菌茶样中,于28 ℃、相对湿度60%的培养箱中发酵20 d后取出,于-80 ℃贮藏待用,样品命名为PF;将灭菌茶样不接菌,进行相同操作后作为对照样品(CK)。每组样品均进行3次重复发酵。
1.3.4 阿曲霉A1强化发酵普洱茶方法在云南省普洱市茶叶科学研究所开展强化发酵普洱茶实验。称取晒青茶25 kg装入发酵筐中,加入10 L蒸馏水,再加入250 mL阿曲霉A1菌悬液,搅拌混匀后进行发酵,每隔5 d翻堆一次,25 d后发酵完成。在每次翻堆前,采用五点取样法取样,样品于-80 ℃贮藏待用,其中接种阿曲霉A1的翻堆样品依次命名为EF1~5,自然发酵的样品(未接种阿曲霉A1)依次命名为NF1~5。每组样品均进行3次重复发酵。
1.3.5 茶叶化学成分测定及感官审评参考M.Zhao等[4]的方法,分别采用恒重法、福林酚比色法[16]、茚三酮比色法、蒽酮法测定茶样水浸出物(Water Extracts,WE)、茶多酚(Tea Polyphenols,TP)、游离氨基酸(Free Amino Acids,FAA)及可溶性糖(Soluble Sugars,SS)含量;采用萃取比色法[17]测定茶样茶黄素(Theaflavins,TF)、茶红素(Thearubigins,TR)及茶褐素(Theabrownins,TB)含量;采用课题组建立的高效液相色谱法[5](High Performance Liquid Chromatography,HPLC)定量分析茶样中的GA、CA、EA、QU、LU、KA、MY、C、EC、EGC、ECG、EGCG、GC、GCG和CG含量。9位评茶员根据《茶叶感官审评方法》(GB/T 23776—2018)[18]及胡圆圆等[19]对普洱茶的感官审评方法,从干茶外形、汤色、香气、滋味和叶底5个项目对茶样进行专业审评,采用百分制评分,每5分为一档,2~3分为半档;将5个项目评分分别与其评分系数20%、15%、25%、30%、10%相乘,并将各个乘积值相加,即为该茶样感官审评的总分。同时利用色差仪对茶汤的颜色进行测定。
1.3.6 基于高通量测序进行微生物多样性分析采用真菌DNA提取试剂盒、细菌DNA提取试剂盒分别提取接种阿曲霉A1普洱茶样品的真菌和细菌的DNA,应用DNA聚合酶(2×Rapid Taq Master Mix)进行聚合酶链式反应(Polymerase Chain Reaction,PCR)。其中,利用引物338F和806R扩增细菌16S rRNA的V3—V4区,以引物ITS5-1737F和ITS2-2043R扩增真菌ITS1的V2区。利用2%琼脂糖凝胶电泳检测PCR产物,并委托深圳微生态公司,应用Illumina MiSeq测序平台对PCR产物进行基因测序[20]。应用QIIME 2.0软件对获得的序列按97%的相似度进行聚类和OTU划分,计算群落丰度(ACE指数、Chao1指数)和Alpha多样性指数(Shannon指数和Simpson指数),评估每个样品的微生物多样性水平[21]。测序序列与Greengenes数据库(Release 13.8,http:∥greengenes.secondgenome.com)和Silva数据库(Release115,http:∥www.arb-silva.de)进行比对,找出最接近且可信度达80%以上的种属信息。
1.4 数据处理
利用IBM SPSS Statistics 22.0软件进行统计学分析和数据处理,数据结果以(平均值±标准差)表示;采用SIMCA 14.1软件进行主成分分析(Principal Component Analysis,PCA);基因测序结果已上传至National Center for Biotechnology Information(NCBI)基因数据库(https:∥bigd.big.ac.cn/bioproject),编号为MZ576486和PRJNA691718。
2 结果与分析
2.1 阿曲霉A1的分离鉴定结果分析
将菌株A1测序所得序列与NCBI基因数据库进行比对,选择模式物种进行系统发育树分析,结果如图1所示。由图1可知,菌株A1与A.amstelodami聚为一支,故将菌株A1命名为阿曲霉A1(A.amstelodamiA1)。
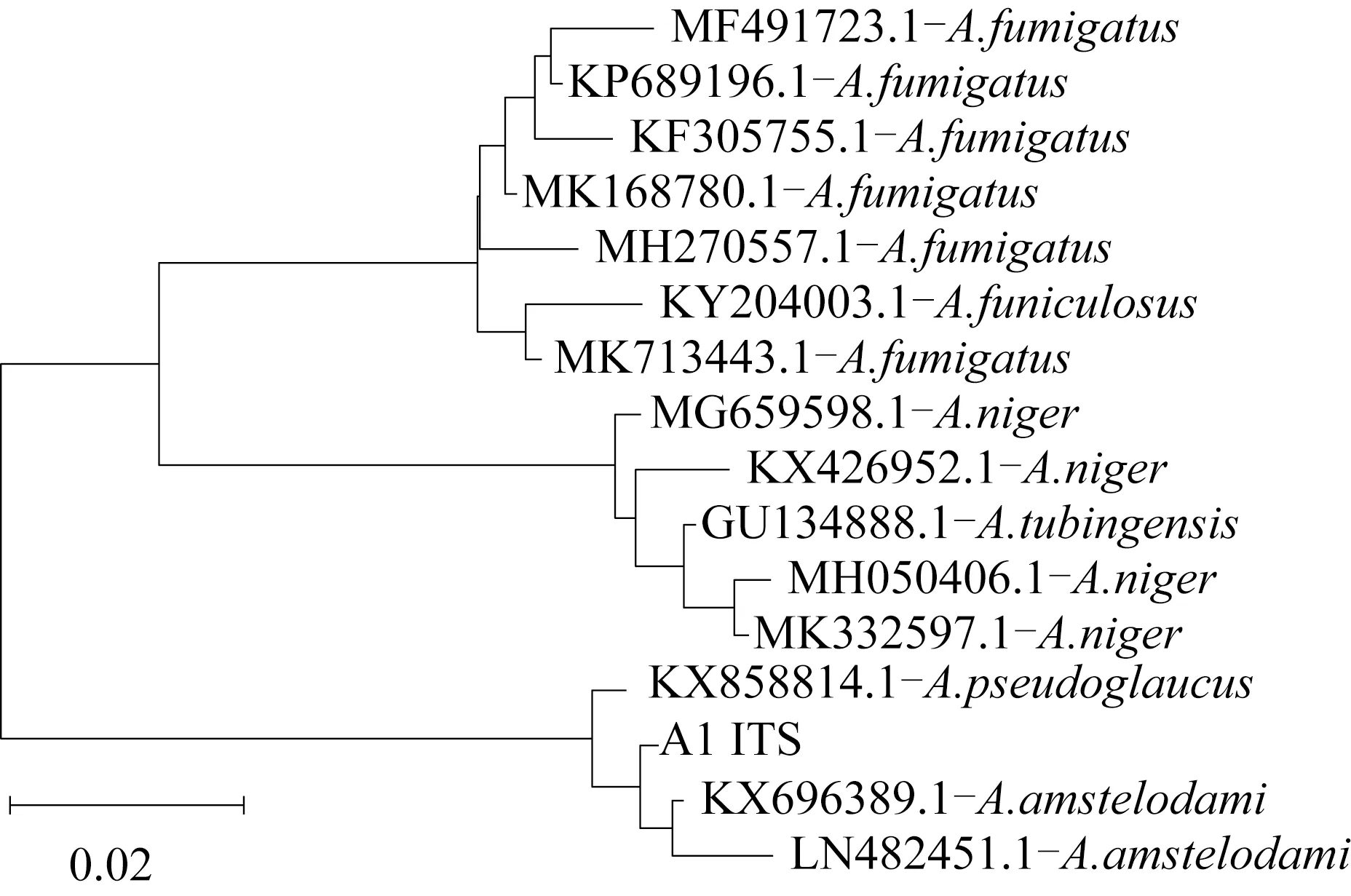
图1 菌株A1的ITS核苷酸序列系统发育树
2.2 阿曲霉A1纯菌发酵对茶叶感官及特征成分的影响分析
对阿曲霉A1纯菌发酵普洱茶茶样进行感官审评,纯菌发酵茶样的茶汤呈橙红色,滋味醇厚,对照样品的茶汤呈黄绿色,涩味较突出。这表明阿曲霉A1纯菌发酵能改善晒青茶的感官品质,并与普洱茶的感官特征(茶汤呈红褐色、滋味醇厚回甘)相似[22]。不同茶样中22种茶叶特征成分的聚类热图如图2所示,其中,不同肩标小写字母表示同一种特征成分含量之间具有显著性差异(P<0.05)。由图2可知,与对照样品相比,纯菌发酵茶样中茶多酚(TP)和5种儿茶素(GCG、CG、ECG、EGCG、EGC)含量均显著降低(P<0.05),促使其茶汤苦涩度降低;而纯菌发酵茶样中茶红素(TR)和茶褐素(TB)含量均显著增加(P<0.05),使得其茶汤由黄绿色变为橙红色,这些茶叶特征成分的变化也与传统普洱茶发酵过程中特征成分的变化相似[23]。由此可以推断,阿曲霉A1对普洱茶的发酵具有积极作用,可将阿曲霉A1接种到晒青茶中进行普洱茶的强化发酵实验。
2.3 阿曲霉A1强化发酵对茶叶感官及特征成分的影响分析
自然发酵和强化发酵茶样的感官特征、评分和审评结果见表1和图3,其中*表示自然发酵茶样与强化发酵茶样具有显著性差异(P<0.05)。由表1和图3可知,经自然发酵和强化发酵处理后,茶样的茶汤均呈红褐色、滋味醇厚回甘、香气纯正,但强化发酵茶样的茶汤颜色更深、滋味更醇厚、香气略带怡人的陈香,且其干茶外形、汤色、滋味、香气和叶底的感官审评分数均显著高于自然发酵茶样(P<0.05)。由图3c)可知,强化发酵茶样的茶汤其a*值(24.80±0.65)和b*值(76.73±1.38)均显著高于自然发酵茶样(P<0.05),而其L*值(69.48±0.81)显著低于自然发酵茶样(P<0.05),这进一步说明了强化发酵茶样具有更深的红褐色。结合图2可知,强化发酵茶样中TB和SS的含量均显著高于自然发酵茶样(P<0.05),这与感官审评中强化发酵茶样具有更深的红褐色和更显著的甜味结果一致;而强化发酵茶样中C、CA、EC和EGC的含量均显著低于自然发酵茶样(P<0.05),验证了强化发酵茶样的苦涩度较自然发酵茶样更低。由此可知,阿曲霉A1强化发酵提高了普洱茶的感官品质。
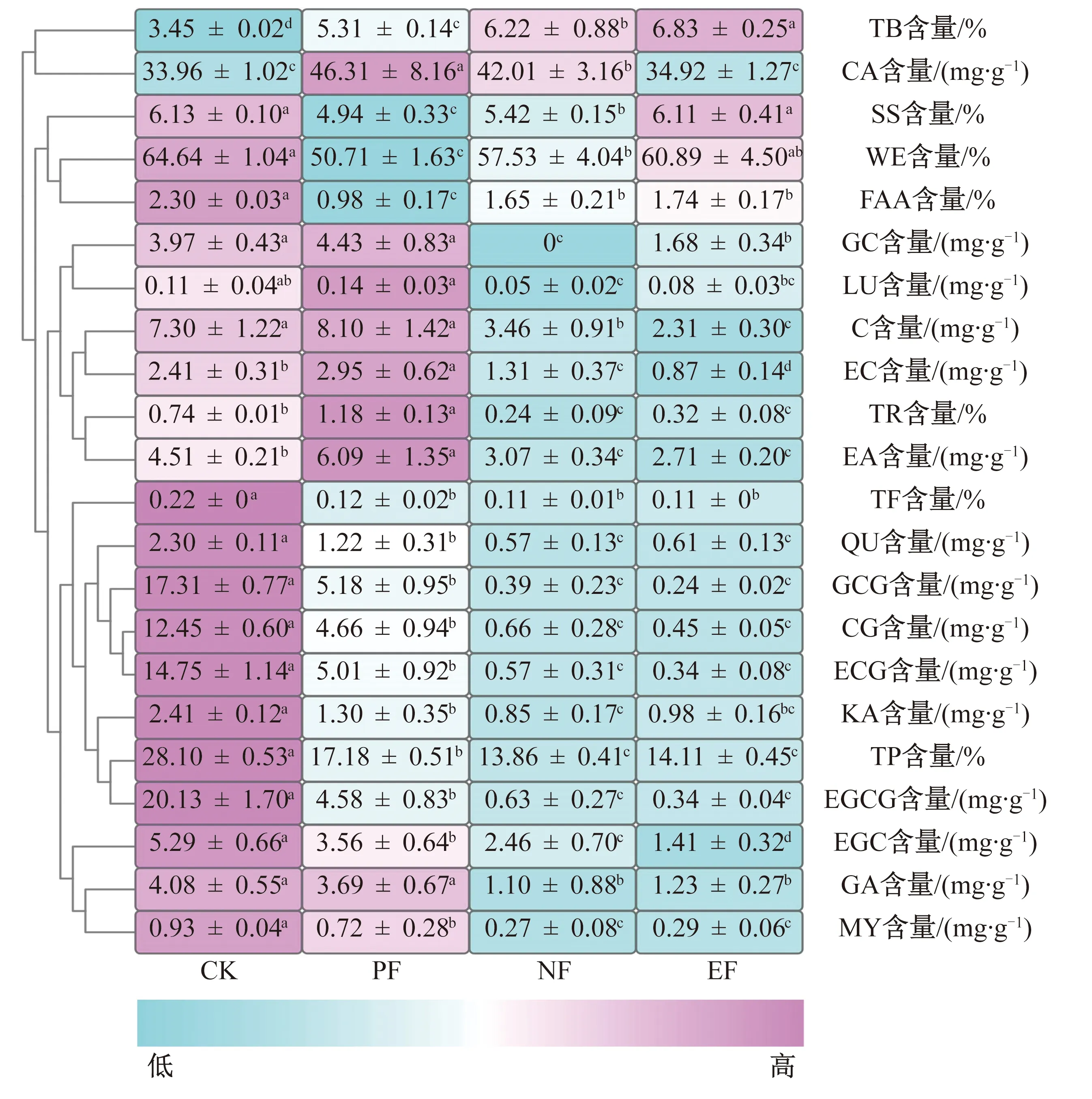
图2 不同茶样中22种茶叶特征成分的聚类热图

图3 自然发酵和强化发酵茶样的感官审评结果
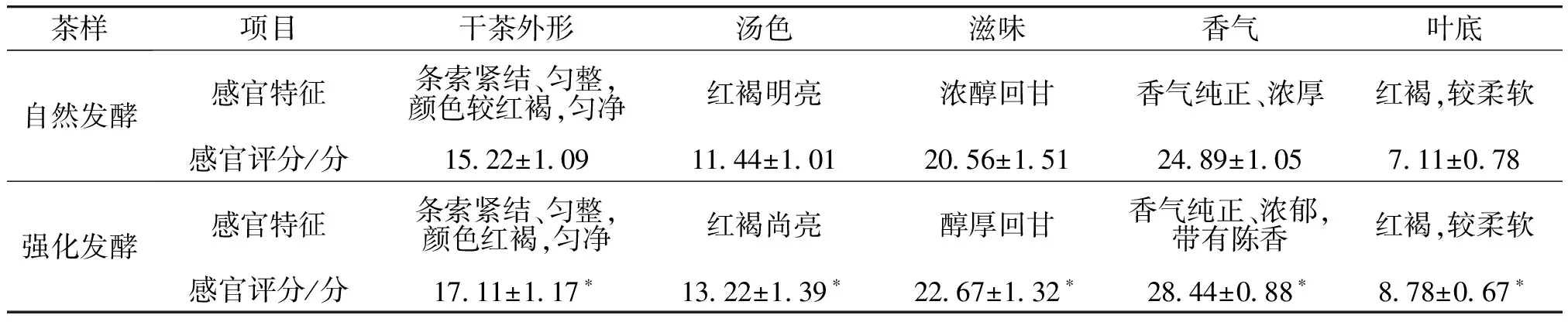
表1 自然发酵和强化发酵茶样的感官特征及评分
2.4 阿曲霉A1强化发酵茶样微生物群落结构分析
自然发酵和强化发酵茶样的微生物群落丰度及Alpha多样性指数见表2。由表2可知,经过QIIME2.0软件检查并剔除嵌合体序列等疑问序列后,得到54 330~77 742个序列,归类为503~833个真菌OTUs、482~2050个细菌OTUs。随着发酵的进行,强化发酵茶样中微生物群落丰度及Alpha多样性指数均增加,但在发酵后期(EF5)均下降,与自然发酵茶样中微生物群落丰度及Alpha多样性指数在发酵后期(NF5)仍继续上升形成差异。强化发酵对茶样真菌和细菌群落结构的影响如图4和图5所示,其中,图4b)中,C为微小根毛霉,D为食腺嘌呤芽生葡萄孢酵母,E为黑曲霉,F为Brunneoclavisporabambusae,G为马克斯克鲁维酵母,H为烟曲霉,I为Paraphysodermasedebokerense,J为疏绵状嗜热丝孢菌,K为Cyberlindnerasp.RODW5,L为Rogersellagriseliniae,M为布兰克假丝酵母,N为Endogonecorticioides,O为阿曲霉,P为其他真菌;图5b)中,C为芽孢杆菌,D为短状杆菌,E为短杆菌,F为伯克氏菌,G为金黄杆菌,H为肠杆菌,I为肠球菌,J为欧文氏菌,K为埃希氏菌,L为克雷白氏菌,M为考克氏菌,N为甲基杆菌,O为微杆菌,P为苍白杆菌,Q为拟杆菌,R为假单胞菌,S为罗尔斯顿菌,T为鞘氨醇杆菌,U为葡萄球菌,V为结核杆菌,W为Xylella,X为其他细菌。由图4a)和图5a)可知,在发酵过程中,自然发酵和强化发酵的微生物群落结构发生了动态变化,且在各个阶段差异显著,这主要是因为发酵过程中茶样化学成分的不断变化及微生物之间的相互作用(如共生和拮抗作用)[24]。
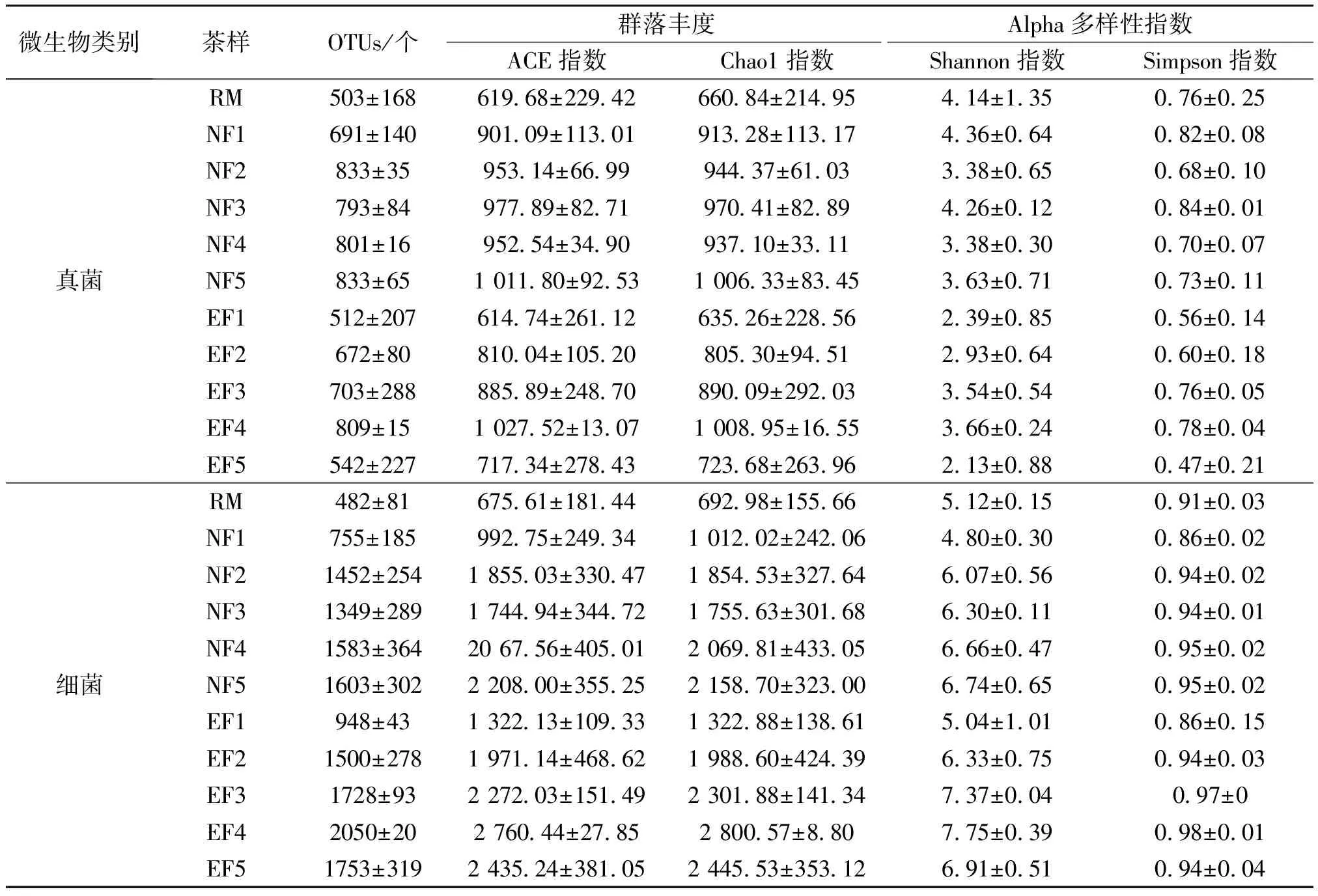
表2 自然发酵和强化发酵茶样的微生物群落丰度及Alpha多样性指数
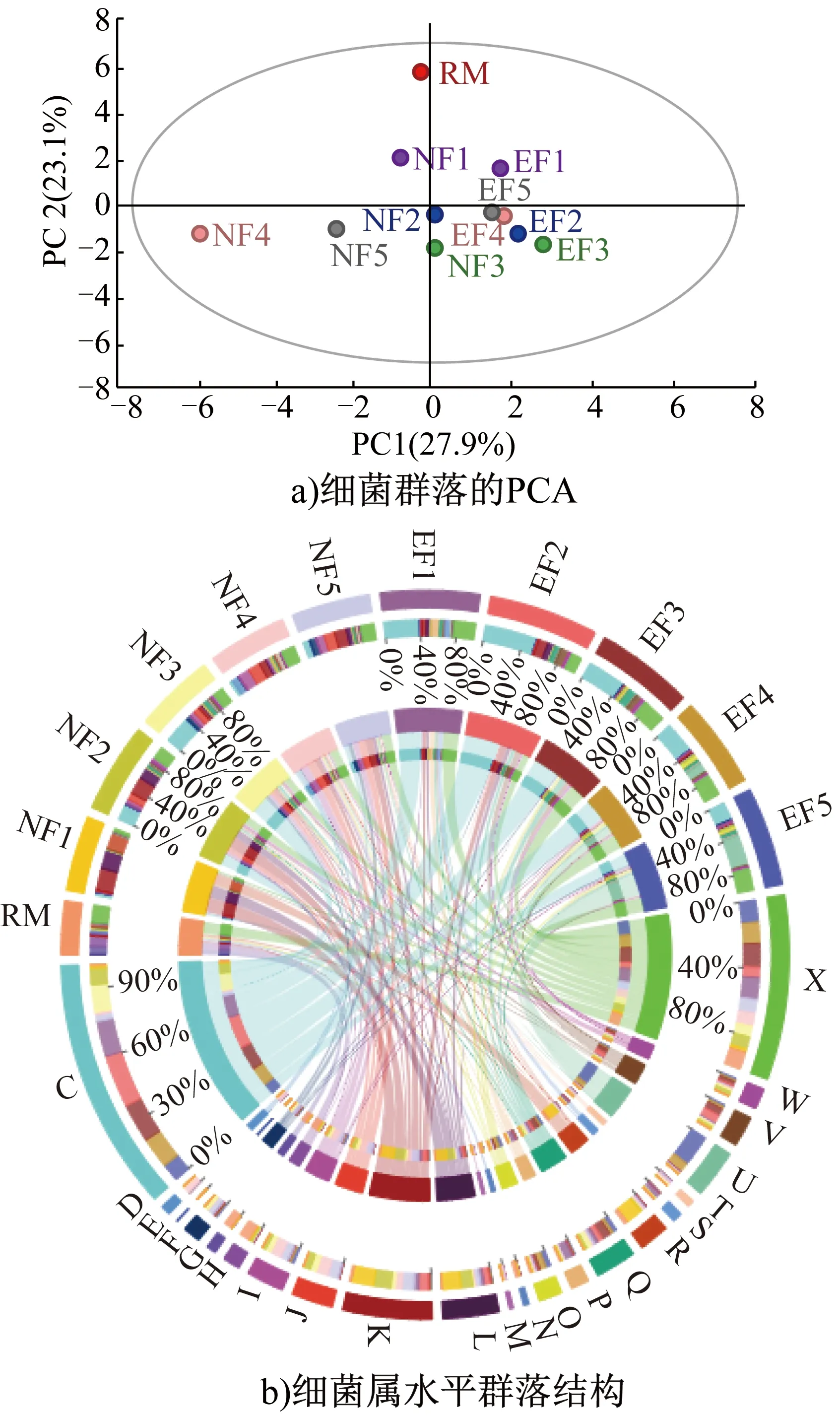
图5 强化发酵对茶样细菌群落结构的影响
由图4b)可知,原料(RM)中的优势真菌为B.bambusae(41.50%)、黑曲霉(21.18%)和马克斯克鲁维酵母(17.27%)。在强化发酵各阶段中,均检测到了阿曲霉(0.01%~0.03%),但不是优势真菌;而B.bambusae(41.91%)是发酵初期(EF1)的优势真菌;随着发酵的进行,微小根毛霉(41.68%~66.42%)迅速生长繁殖,在发酵中期(EF2~4)成为优势真菌;食腺嘌呤芽生葡萄孢酵母(72.61%)在发酵后期(EF5)成为优势真菌;黑曲霉(8.64%~33.74%)在整个发酵阶段均为优势真菌。在自然发酵过程中,黑曲霉始终是优势真菌(26.64%~37.40%);此外,发酵初期(NF1)的优势真菌还包括马克斯克鲁维酵母(31.28%);随着发酵的进行,微小根毛霉(37.48%~61.22%)迅速繁殖,与黑曲霉共同成为发酵中后期(NF2~5)的优势真菌。由此可知,虽然在发酵初期将阿曲霉A1接种到未经灭菌的晒青茶中进行强化发酵,但整个发酵过程处于开放状态,环境中的微生物也会进入发酵系统[10],适合在茶叶中生长的微生物就会在这种发酵体系中生长繁殖。
由图5b)可知,RM中的优势细菌主要是肠杆菌(20.94%)、金黄杆菌(16.65%)和假单胞菌(6.90%)。在强化发酵过程中,芽孢杆菌(39.01%~52.50%)是发酵前中期(EF1~3)的优势细菌;随着发酵的持续进行,葡萄球菌(12.11%~34.37%)和芽孢杆菌(19.63%~37.39%)共同成为发酵中后期(EF4~5)的优势细菌。在自然发酵过程中,发酵前期(NF1)的优势细菌主要是埃希氏菌(32.41%)、克雷白氏菌(27.41%)和假单胞菌(24.54%);芽孢杆菌(37.07%)在发酵中期(EF3)成为优势细菌;而在发酵后期(EF5),埃希氏菌(16.46%)再次成为优势细菌。
综上所述,尽管在接种阿曲霉A1进行强化发酵过程中,阿曲霉在茶样真菌群落中所占比例有限,但相对自然发酵显著改变了其他微生物的相对丰度,例如增加了B.bambusae、食腺嘌呤芽生葡萄孢酵母、葡萄球菌和芽孢杆菌的相对丰度,降低了黑曲霉、马克斯克鲁维酵母、埃希氏菌、克雷白氏菌和假单胞菌的相对丰度,这也解释了强化发酵茶样的感官及特征成分的变化原因。
3 结论
本文将分离自普洱茶的阿曲霉A1接种于灭菌和未灭菌的晒青茶中,分别进行了纯菌发酵和强化发酵,进而分析了发酵茶样的感官特征、化学成分及微生物群落结构。经纯菌发酵后,茶样中茶多酚和5种儿茶素含量均显著降低,茶红素和茶褐素含量均显著增加。经强化发酵后,茶样中茶褐素和可溶性多糖含量均显著高于自然发酵,而儿茶素、表儿茶素、表没食子儿茶素和咖啡碱含量均显著降低;茶汤的感官特征也随之发生变化,例如,a*值、b*值及干茶外形、汤色、滋味、香气、叶底的感官评分均显著升高,L*值显著降低。虽然阿曲霉A1在强化发酵的真菌群落中只占很小的比例,但其促使了其他几种主要微生物相对丰度的显著变化,因此,阿曲霉A1通过与其他微生物的协同作用改变了普洱茶中茶叶的特征成分,从而提高了普洱茶的感官品质。本研究为改善传统普洱茶发酵工艺提供了新思路,并为后续进行多菌种的普洱茶强化发酵乃至实现普洱茶工业化的控菌发酵起到了一定的推动作用,后续也将对阿曲霉A1强化发酵普洱茶的作用机理及安全性展开进一步研究。

