MⅠ期未成熟卵临床应用价值
魏玉兰 黄 博 任新玲 靳 镭
华中科技大学同济医学院附属同济医院生殖医学中心 湖北 武汉 430030
随着辅助生殖技术(assisted reproductive technology,ART)飞速的发展,促排卵技术及培养室培养条件的全面提高,获得卵子在数量和质量上都有了一定改善。拟行胞浆内单精子注射术(intracytoplasmic sperm injection,ICSI)的卵子在脱去颗粒细胞后经常会有未成熟卵,此类卵子该直接丢弃还是继续培养成熟后加以利用值得探讨。本研究回顾性分析MⅠ期未成熟卵体外培养成熟后进行ICSI的临床应用价值,以期为未成熟卵的临床应用提供参考。
1 材料与方法
1.1 研究对象与纳入标准回顾性分析华中科技大学同济医学院附属同济医院生殖医学中心2018年3月至2020年1月行辅助生殖助孕的不孕症患者的临床资料,将ICSI中含有MⅠ期体外成熟卵子的375个新鲜周期作为研究对象,并将ICSI注射的3 323枚成熟卵子(MⅡ)分为A组(体内成熟卵子)和B组(MⅠ期体外成熟卵子)。再根据年龄的不同将A、B组各分为2个不同亚组:≤35岁(A 1组、B1组);>35岁(A 2组、B2组),分别比较不同年龄段两组胚胎的发育潜能。纳入标准:①新鲜周期;②女方宫腔形态正常;③男女双方染色体核型报告正常;④所有患者夫妻双方均了解并签署知情同意书;⑤分组:去除颗粒细胞后可见第一极体的成熟卵子为A组;去除颗粒细胞后6 h以内经过体外培养成熟的MⅠ期卵子为B组。排除标准:需进行卵子激活的患者。
1.2 研究方法
1.2.1 卵母细胞采集及脱颗粒 按本中心常规方案促排卵,注射人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)后37 h经阴道超声引导下穿刺取卵。卵子采集后,将卵冠丘复合物(cumulusoocyte complexes,COCs)充分洗涤后置培养箱中培养(37℃,6%CO2),拟行ICSI手术的卵子在获卵后2~4 h用80 IU/mL的透明质酸酶(vitrolife,瑞典)消化COCs并用机械法去除颗粒细胞。本中心常规在上午11点至下午1点按采卵的先后顺序脱颗粒并在显微镜下观察判断卵子的成熟情况,将成熟及未成熟卵分别培养。
1.2.2 ICSI时机的选择及原核评估 对于卵成熟度≥50%的患者在脱颗粒后1 h常规ICSI(实施ICSI手术时MⅠ期卵子若成熟了则注射,未成熟则丢弃),而对于卵成熟度<50%的患者会在脱颗粒后适当延长ICSI前的预孵育时间,根据卵成熟度状态调整最佳的ICSI时机。大部分患者都能在脱颗粒后4 h以内达到成熟过半的标准。ICSI术后将卵子转至胚胎培养基中并将体外成熟卵做好标记。对于极少数超过6 h成熟度还未过半的患者,本中心常规将成熟卵子先行ICSI而将余下的未成熟卵培养至次日,若有成熟卵子则在患者知情同意的情况下再行ICSI。次日评估卵子受精情况并记录原核(pronucleus,PN)数目:2PN为正常受精;NPN为未受精;3PN为3个原核的异常受精。
1.2.3 卵裂胚评估及第3天(D3)继续培养胚胎标准 本中心D3卵裂胚评分标准:Ⅰ级,卵裂球数7~10个,卵裂球大小均匀且碎片<10%;Ⅱ级,卵裂球数7~10个,卵裂球大小均匀或轻度不均且碎片<25%;Ⅲ级,卵裂球大小严重不均且碎片<50%,或卵裂球无大小严重不均、碎片25%~50%;Ⅳ级,碎片≥50%。本中心常规将D3移植胚胎以外剩余的胚胎继续培养。继续培养胚胎标准:细胞数≥4个,评分为1级、2级和3级的胚胎。D3优质胚胎标准:D1为正常受精(2PN),D2卵裂球数为4/5个,D3卵裂球数7~10个,卵裂球大小均匀且碎片<10%。
1.2.4 囊胚评估 本中心采用Gardner囊胚评分系统对囊胚进行质量评估[1]。根据囊腔扩张和孵出将囊胚分为6期:1期,囊腔范围小于胚胎体积的一半;2期,囊腔范围超过胚胎体积的一半;3期,囊腔占满整个胚胎;4期,囊腔完全扩张,透明带变薄;5期,囊胚开始孵化;6期,囊胚完全孵出。再根据内细胞团(inner cell mass,ICM)和滋养外胚层细胞(trophectoderm,TE)的发育对囊胚质量进行分级。ICM分级:细胞数目多,排列紧密为A级;细胞数目少,排列松散为B级;细胞数目很少为C级。TE分级:细胞数目多,结构致密为A级;细胞数目少,结构松散为B级;细胞数目稀疏,大细胞很少为C级。冷冻囊胚标准:D5/D6囊胚评分≥3/4BC。
1.3 统计学分析采用SPSS 19.0统计学软件包进行统计分析,符合正态分布的计量资料数据用均数±标准差(±s)表示,组间均数比较采用单因素方差分析,率与构成比的组间比较采用卡方检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 组间基线情况比较B1组原发不孕比例高于A 1组(P<0.01),其余各亚组的年龄、不孕年限、身体质量指数(BMI)比较均无统计学差异(P>0.05)。见表1。

表1 组间基线情况比较
2.2 组间受精情况比较在2PN受精率方面,B组显著低于A组(P<0.01);B1组3PN率显著高于A 1组(P<0.05)。A 2组与B2组的退化率(degradation rate,DA)虽有统计学差异但由于样本量有限有待增加样本量进一步证实。见表2。

表2 组间受精情况比较[例(%)]
2.3 组间胚胎卵裂情况比较与A组相比,B组D2未裂率呈升高趋势;D3优胚率呈下降趋势,但仅A 1组与B1组有统计学差异(P<0.01)。见表3。

表3 组间胚胎卵裂情况比较[例(%)]
2.4 组间囊胚形成情况比较B组囊胚形成率、可利用囊胚率、优质囊胚率显著低于A组,但仅B1组与A 1组有统计学差异(P<0.01)。对于>35岁的患者,A 2组与B2组仅囊胚形成率有统计学差异(P<0.05)。见表4。

表4 组间囊胚形成情况比较[例(%)]
2.5 妊娠结局随访以内膜达到移植标准的首个囊胚复苏周期为妊娠,结局比较标准。由于部分患者新鲜周期已经妊娠加之B组胚胎冷冻排序较后,因此截止2020年10月23日,B组单个胚胎复苏移植6例:分娩2例;分别来源于A、B组的两个胚胎联合复苏移植4例:妊娠3例(分娩2例,其中双卵双胎1例,正在进行的妊娠1例),分娩胎儿均健康无畸形及并发症。A组单个胚胎复苏移植84例,临床妊娠42例,分娩26例;来源于A组的两个胚胎联合复苏移植8例,临床妊娠8例,分娩6例。见表5。
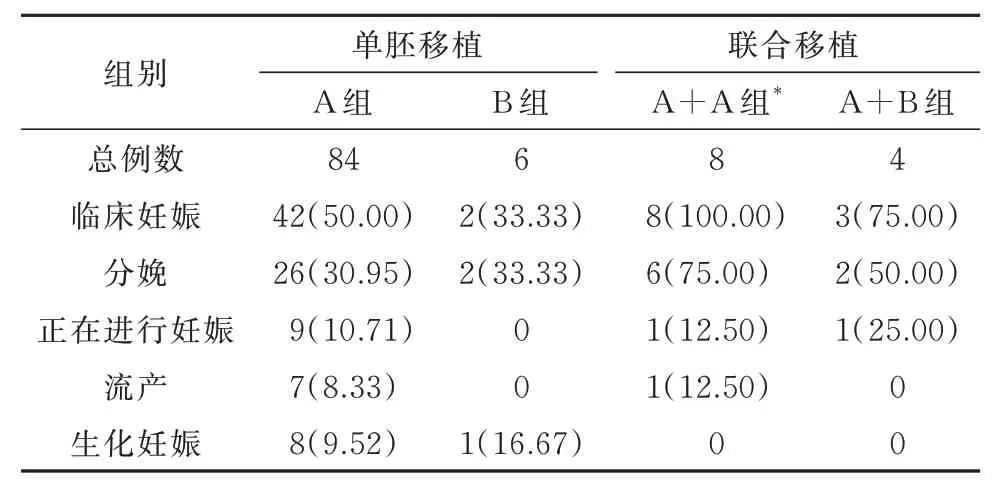
表5 妊娠结局比较[例(%)]
3 讨论
常规促排卵周期中约有15%~20%的未成熟卵子[2]。若能将这些卵子充分利用而不是直接丢弃,既可增加卵子利用率也可增加妊娠机会。本研究将体内成熟卵子与MⅠ期体外成熟卵子的发育潜能进行比较,以期为未成熟卵的临床应用提供参考。
目前针对未成熟卵的研究主要是人卵母细胞体外成熟培 养(in vitromaturation,IVM)技 术。IVM技术对于多囊卵巢综合征(polycystic ovary syndrome,PCOS)及癌症患者生育力保存等方面都有一定的应用[3],但是该技术也有其局限性:①培养液成分要求较高。为了提高卵子成熟受精率和发育潜能,IVM培养液需添加15%~20%血清的人输卵管液(human tubal fluid,HTF)、Ham's F10培养液或DMEM平衡盐液,并添加促性腺激素(Gn)、卵泡液(FF)、细胞因子及抗氧化剂等多种成分[4]。②体外培养时间较长。常规试管手术优势卵泡直径≥16 mm时取卵,而IVM技术则是达到10~12 mm时取卵,因此体外培养成熟通常需要更长时间(24~48 h)。而长时间体外培养,可能会导致氧自由基大量积聚,增加了卵子氧化应激损伤、非整倍体率增加及胚胎发育阻滞的风险[5,6];③虽有研究报道经IVM后未成熟卵的成熟率可达70%,但发育潜能仍低于体内成熟卵子,表现在受精率、卵裂率、囊胚形成率及种植率低等方面[7]。正因为受各种体外培养条件及胚胎发育潜能有限等因素的影响,使IVM技术不能被广泛地应用于临床。而本研究与IVM技术相比优势在于,本研究为脱颗粒后6 h以内自发成熟的卵子,成熟率可达66.11%(472/714),而且无需额外添加任何培养成分,简单易行。
来源于未成熟卵的胚胎发育潜能有限,究其原因可能与卵子的胞核/胞质成熟不同步相关。卵子的成熟可以简单地分为胞核成熟和胞质成熟。胞核成熟是指生殖泡破裂,同源染色体分离,卵周间隙出现和释放第一极体。胞质成熟是指细胞完成了蛋白质的磷酸化及去磷酸化和细胞器的重新排列。通常所说的卵子成熟一般是指核成熟,但在控制性超促排卵(controlled ovarian hyperstimulation,COH)过程中,外源性的Gn可导致卵子代谢异常、三磷酸腺苷(ATP)含量下降、转录异常,出现胞核/胞质成熟不同步[8]。而只有胞核/胞质同步成熟的卵子才具备良好的受精能力及胚胎发育潜能[9-11]。本研究中MⅠ期体外成熟卵子发育潜能有限可能与以下因素相关:①培养时间较短,培养条件有限,基础培养液、培养环境不足以满足MⅠ期卵子胞质的成熟。据文献报道,MⅠ期卵子经培养后,MⅡ期静止时间3~6 h实施ICSI手术获得的优质胚胎率较高[12];②ATP含量是卵子成熟及胚胎发育潜能的重要基础,虽然经过培养胞核已成熟(第一极体释放),但胞质尚未完全成熟;因此,胞质中线粒体及ATP含量较低[13,14];③颗粒细胞通过与卵子双向交流用以延缓细胞核成熟,从而让细胞核与细胞质成熟更加同步,提高胚胎发育潜能[15],并有助于获得与体内成熟卵子更为相似的基因表达谱[16]。这也许是脱去了颗粒细胞的未成熟卵虽然能发育成熟但发育潜能有限的原因之一[17];④维持胚胎进一步发育的相关蛋白水平较低,导致精原核形成落后、纺锤体缺陷,影响胚胎的正常受精及分裂[18,19]。
年龄是影响卵子质量的重要因素,对于>35岁的患者,随着年龄增加卵子出现细胞骨架异常、线粒体数目减少、线粒体DNA突变、纺锤体异常及染色体异常的风险也逐年增加[20-22]。从我们的研究数据来看,>35岁与≤35岁的患者相比,2PN受精率、囊胚形成率、优质囊胚率均呈下降趋势可能与此相关。而且在>35岁的患者中,A 2与B2组仅囊胚形成率有统计学差异(P<0.05),而D2未裂率、D3优胚率、可利用囊胚率、优质囊胚率均无统计学差异。在不排除样本量较少的因素之下,同时也考虑可能是因为高龄患者卵子异常率增加从而缩短了与胚胎发育潜能有限的体外成熟卵子之间的质量差距。
虽然来源于未成熟卵的胚胎发育潜能有限,但是从临床数据来看,截止2020年10月23日B组单个胚胎复苏移植6例:分娩2例;A+B组各一个胚胎联合复苏移植4例:妊娠3例(分娩2例,其中双卵双胎1例,正在进行的妊娠1例),分娩胎儿均健康无畸形及并发症。由此可见,在不增加人工及试剂耗材等成本的情况下,MⅠ期体外成熟卵提高了卵子利用率,增加了患者妊娠机会,有其一定的临床应用价值。由于目前复苏移植例数有限,相信随着样本量的增加会有更多有力的证据。在临床工作中为了进一步提高卵成熟度,现将总结的几条改善措施归纳如下:①在获卵过程中,如果通过对卵丘复合物观察发现卵子可能存在成熟率较低时适当延迟脱颗粒时间;②去除颗粒细胞时以能清楚观察极体为标准,尽量保留颗粒细胞;有研究报道,颗粒细胞能够分泌多种生长因子,这些生长因子与促性腺激素反应,通过自分泌和旁分泌途径作用于卵子,从而促使卵子成熟[23];③据文献报道,低浓度氧气培养相对高浓度氧气可以提高卵子的体外成熟率[24],因此去除颗粒细胞后将卵子从高氧分压的常规CO2培养箱(气体体积分数20%O2、6%CO2)转移至低氧分压的桌面培养箱(气体体积分数5%O2、5%CO2、90%N2)中进行培养;④适当延长ICSI前的预孵育时间,根据卵成熟度状态调整最佳的ICSI时机。
综上所述,MⅠ期未成熟卵经体外培养成熟后具有一定的临床应用价值,本研究为我们后续的深入探索提供了参考。在不远的将来通过积极探寻更为有效的培养体系及优化技术,改善卵子的胞核/胞质成熟同步化,将有可能进一步提高未成熟卵的临床利用价值。

