LINC00511通过血管内皮生长因子调控肺腺癌的增殖、侵袭和迁移
汪 洋 王一娜 罗洞波 吕红博
新疆医科大学附属肿瘤医院胸外科二病区 新疆 乌鲁木齐 830011
长链非编码RNA(long non-coding RNA,LncRNA)指的是长度超过200个核苷酸的转录组的非蛋白编码部分[1]。在细胞乃至生物体中,LncRNA参与了包括细胞增殖、细胞分化、细胞周期进程、细胞凋亡和转移在内的多种生物学过程[2]。不同的LncRNA可以被确定为癌基因、肿瘤抑制因子、预后和诊断生物标志物以及治疗靶点等等[3]。长链非编码RNA LINC00511是一个大小约为2 000 bp的LncRNA,共有5个外显子。研究表明,LINC00511在包括乳腺癌、卵巢癌、肝癌、胰腺癌、肺癌和胶质瘤在内的多种癌症中高表达。LINC00511是一种癌基因,在细胞增殖、细胞周期进程、凋亡、侵袭、迁移、转移和化疗耐药中起着重要的调控作用[4,5]。
近几十年来,生长因子在临床上被广泛用于治疗血液、肿瘤和心血管疾病。尤其是血管内皮生长因子(VEGF)越来越多地用作激动剂治疗心脏、肾脏和骨科相关疾病,以及用作拮抗剂来治疗眼科疾病[6]。也有一些研究表明VEGF也参与癌细胞的病理性增殖过程中。参与细胞组织等的正常生长、伤口愈合、以及肿瘤的发生和转移。因此VEGF也在生物体内起着至关重要的作用[7,8]。本研究初步探讨长链非编码RNA LINC00511和血管内皮生长因子(VEGF)调控肺腺癌增殖、侵袭和迁移的机制。
1 材料与方法
1.1 实验材料实验组织材料:本研究从新疆医科大学附属肿瘤医院胸外科收集了25例肺腺癌组织样本和25例正常肺组织样本。入选标准:本研究所有肿瘤样本都是被证实含有超过80%的肿瘤细胞通过病理检查的病理切片;手术前未给予抗癌治疗;通过病理检查切除表面无肿瘤组织来证实所有肿瘤结节均完全切除;提供完整的临床病理和随访数据。本研究经本医院伦理委员会批准同意,所有纳入个体均签署书面知情同意书。本研究遵循《赫尔辛基宣言》。
实验细胞材料:本研究中使用的MRC-5细胞和A 549细胞均购自中国科学院上海生命科学研究所细胞库。MRC-5细胞培养使用的MEM培养基和A 549细胞培养使用的F-12K培养基均购自Gibco公司。培养基中均加入10%胎牛血清,胎牛血清购自Excell公司。MRC-5和A 549均放置于37%含有5%CO2的恒温箱中培养。
1.2 细胞转染使用Life公司的脂质体Lipofectamine 2000进行细胞转染,转染步骤参照产品说明书。待细胞接种到12孔板并彻底贴壁后,细胞密度达到60%融合时即可进行细胞转染,按12孔板每孔转染1μg质粒,且质粒与Lipofectamine 2000的比例为1∶1进行实验。
1.3 主要分子和化学试剂TRIzol试剂购自Life公司;RNA抽提所需酚氯仿异戊醇、异丙醇等化学试剂购自国药公司;无RNA酶水购自Hyclone;逆转录试剂盒、Oligo dT 18和SYBR Green荧光定量试剂盒均购自Promega公司;qRT-PCR实验中所用到的各基因引物均由生工生物工程(上海)公司合成。RIPA细胞裂解液购自碧云天公司;BCA蛋白浓度测定试剂盒购自碧云天公司;SDS-PAGE预制胶和Western Blot实验相关试剂均购自雅酶公司;VEGF单克隆抗体(ab1316)购自Abcam公司,内参β-actin(#4970)购自Cell signaling technology公司。HRP标记羊抗兔特异性二抗(AS014)购自Abclonal公司。ECL显色液购自Millipore公司。CCK8试剂购自APExBIO公司。Transwell小室购自CORNING公司。
1.4 qRT-PCR实验收集不同分组的细胞样品,使用TRIzol裂解细胞,提取细胞和组织样本中总RNA,提取步骤参照Life公司产品说明书。用紫外可见分光光度Nanodrop 2000(Thermo Fisher)检测RNA的质量和浓度。根据RNA的浓度,取1μg RNA进行逆转录反应,逆转录的反应体系和程序参照产品说明书。逆转录反应后得到cDNA,使用RNase free water稀释10倍,作为模板进行qRTPCR检测,qRT-PCR实验使用TaKaRa公司的SYBR Green荧光定量试剂盒,具体的反应体系和程序参照产品说明书。qRT-PCR反应所用引物序列见表1。

表1 本研究所用引物序列
1.5 Western Blot实验使用RIPA处理细胞,4℃孵育30 min,收集细胞裂解液至1.5 mL的EP管中,12 000g4℃离心15 min,收集上清。通过BCA蛋白浓度测定试剂盒测定蛋白的浓度。向细胞裂解液中加入蛋白loading buffer煮沸5 min后,通过10%SDS-PAGE将20 mg的蛋白样品0.3 A、20 V电转至PVDF膜上。5%脱脂奶粉封闭1 h,分别加入TBST稀释的VEGF兔抗(1∶2 000),4℃孵育过夜,TBST洗膜3次,加入HRP标记的羊抗兔二抗,室温孵育1 h,TBST洗膜6次。ECL显色液显影。应用凝胶图像分析软件Image J分析各条带的灰度值,计算目的蛋白与内参蛋白条带的灰度值比值。实验重复3次。
1.6 CCK 8实验取A 549或按实验分组处理后的细胞,按5 000细胞/孔的比例,接种到96孔板内,每组设5个复孔,在37℃,含有5%CO2的条件下过夜培养至细胞彻底贴壁,加入10μL的CCK 8溶液,继续培养1 h,用酶标仪检测450 nm处的吸光度值。计算细胞存活率,并绘制柱状图。实验重复3次。
1.7 Transwell实验使用Transwell小室(8μm孔径)在24孔板中行进体外细胞迁移和侵袭检测。分别在含有重建基底膜(matrigel)的8μm孔径的聚碳酯膜Transwell小室和不含matrigel的Transwell小室中预先加入600μL 20%FBS的F-12K培养基,37℃平衡1 h。将转染48 h后的A 549细胞重悬于含有10%FBS的F-12K培养基中,取100μL细胞密度为1×109/L的细胞加至上室,37℃、5%CO2培养24 h,取出Transwell小室,用棉签擦拭Transwell微孔膜内层的细胞,PBS冲洗后用4%甲醇固定室中的细胞,然后用0.1%的结晶紫染色。倒置显微镜(奥林巴斯IX73)下计数染色细胞并拍照。随机选取5个视野的平均值,每个标本重复3次,分析各组间的差异并绘制迁移和侵袭的柱状图。实验重复3次。
1.8 统计学分析所有数据均采用SPSS 21.0统计学软件进行处理,计量资料采用均值±标准差表示,两组间比较为t检验,多组间的比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 LINC00511和VEGF在肺腺癌中高表达为了研究LINC00511和VEGF在肺腺癌中的作用,我们首先检测了LINC00511和VEGF在肺腺癌中的表达情况。结果表明在肺腺癌组织中,LINC00511和VEGF均显著高表达(图1A、图1B)。通过qRTPCR在肺腺癌细胞系A 549中检测,对比人胚肺成纤维细胞MRC-5的LINC00511和VEGF均显著高表达(图1C、图1D)。使用VEGF特异性抗体,进行Western Blot检测,结果与qRT-PCR结果一致,即VEGF在A 549中显著高表达(图1E)。以上结果表明,LINC00511和VEGF在肺腺癌中高表达,提示LINC00511和VEGF与肺腺癌的发生密切相关。

图1 LINC00511和VEGF在肺腺癌中高表达
2.2 LINC00511和VEGF促进肺腺癌细胞的增殖、侵袭和迁移 LINC00511和VEGF在肺腺癌细胞中的高表达提示LINC00511和VEGF与肺腺癌的发生相关。我们敲低了LINC00511和VEGF的表达,通过qRT-PCR检测,结果表明3对shRNA均能显著抑制LINC00511和VEGF的表达(图2A、图2B)。Western Blot结果与qRT-PCR结果显示VEGF表达显著下调(图2C)。通过CCK8实验,检测敲低LINC00511或VEGF后A 549细胞的增殖能力,结果表明,敲低LINC00511或VEGF后,细胞的增殖能力分别下降了1.92倍和2.78倍(图2D)。通过Transwell实验,检测敲低LINC00511或VEGF后,A 549细胞的侵袭和迁移能力,结果表明,敲低LINC00511或VEGF后,细胞的侵袭和迁移能力下降了2.63倍和3.45倍(图2E)。以上结果提示LINC00511和VEGF可以显著促进肺腺癌的增殖、侵袭和迁移。
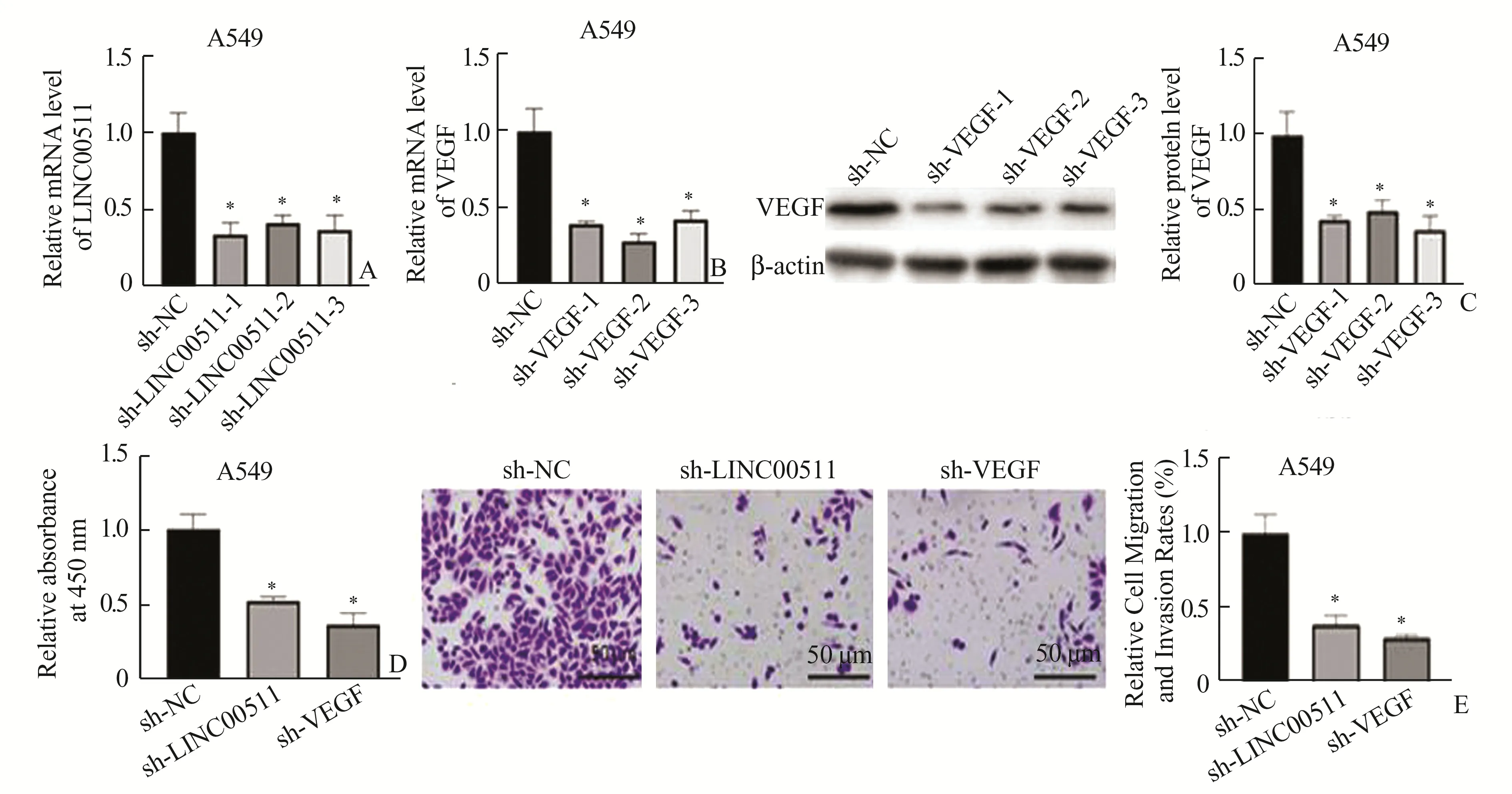
图2 LINC00511和VEGF促进肺腺癌细胞的增殖、侵袭和迁移
2.3 LINC00511调控VEGF的表达上调由于LINC00511和VEGF均能显著促进肺腺癌细胞的增殖、侵袭和迁移,基于已有的研究成果,我们推测LINC00511和VEGF存在靶向调控关系。因此,我们在敲低LINC00511后,通过qRT-PCR检测了VEGF的表达,结果表明敲低LINC00511可以下调VEGF的表达水平2.86倍(图3A)。Western Blot结果与qRT-PCR一致,即敲低LINC00511后,VEGF的表达显著下调(图3B)。以上结果表明,LINC00511的敲低可以下调VEGF的水平,即LINC00511可以促进VEGF的表达,因此我们推测LINC00511可以通过促进VEGF的表达,来促进肺腺癌细胞的增殖、侵袭和迁移。
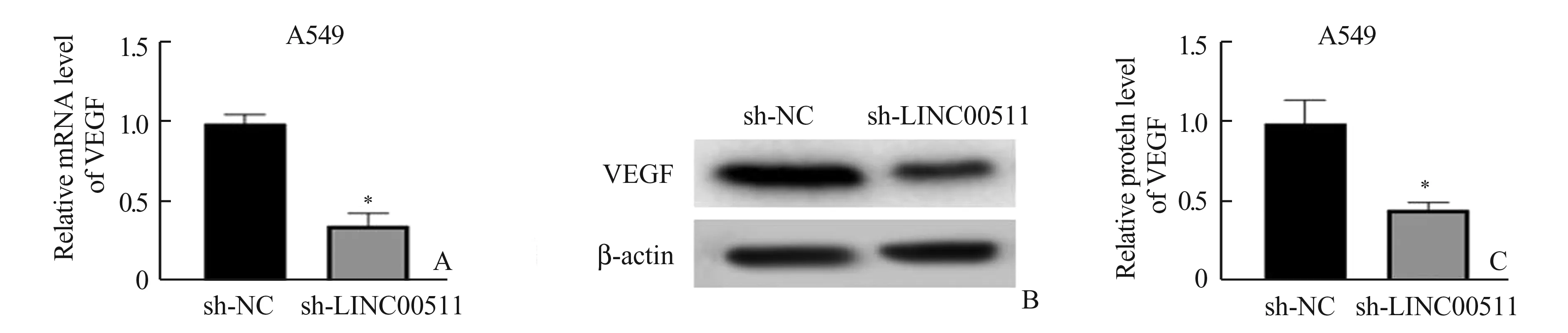
图3 LINC00511调控VEGF的表达上调
2.4 LINC00511通过VEGF促进肺腺癌细胞的增殖、侵袭和迁移本研究中,我们发现LINC00511和VEGF均能促进肺腺癌细胞的增殖、侵袭和迁移。并且LINC00511可以靶向调控VEGF的表达,由此推测LINC00511对肺腺癌的调控是通过VEGF实现的。因此我们在A 549细胞中敲低LINC00511的同时过表达了VEGF,通过qRTPCR和Western Blot验证发现LINC00511敲低后VEGF表达下调了2.78倍,而敲低LINC00511的同时过表达VEGF,VEGF表达恢复(图4A、图4B)。通过CCK8实验,我们发现敲低LINC00511细胞增殖速率下降了2.85倍,敲低LINC00511的同时过表达VEGF,细胞的增殖能力恢复(图4C)。通过Transwell实验,我们发现敲低LINC00511细胞的侵袭和迁移能力下降了2.38倍,而敲低LINC00511的同时过表达VEGF,细胞的侵袭和迁移能力恢复(图4D)。

图4 LINC00511通过VEGF促进肺腺癌细胞的增殖、侵袭和迁移
3 讨论
LINC00511是一种新发现的LncRNA,据报道LINC00511在包括肺癌、乳腺癌、胰腺癌、宫颈癌、肝癌、卵巢癌和胶质瘤在内的多种癌症中表达上调并与癌症的发生密切相关。其潜在作用机制包括促进肿瘤的增殖、细胞周期进程、侵袭、迁移、转移和化疗耐药及抑制细胞凋亡等等[4]。除此之外,LINC00511的上调往往预示着患者的不良预后,这也代表着LINC00511在临床上可以被用作癌症患者预后的生物标志物[5]。
目前对于LINC00511致癌作用分子机制的研究,强调的是LINC00511主要通过调节microRNA功能发挥其致癌功能。比如:通过LINC00511对hsa-miR29b-3p的内源竞争性RNA的活性,LINC00511可以诱导VEGFA的表达,从而导致胰腺导管腺癌发生和发展[8]。Lu等[9]发现LINC00511可以靶向通过miR-185-3p/E2F1/Nanog信号轴,进而促进乳腺癌的发生以及维持乳腺癌干细胞的特性。在最近的一项研究中,LINC00511还被发现可以通过靶向作用于miR625-5p/NFIX信号轴来促进胃癌发生[10]。这些关于LINC00511作用的分子机制研究提示LINC00511可以在转录和转录后水平发挥作用。除此之外,LINC00511也被发现可以与多种信号通路直接或间接的相互作用,比如JAK2/STAT 3、Wnt/β-Catenin、PTEN/AKT/FOXO等等[11-13]。
在LINC00511的研究中,也有许多的结果提示,LINC00511是癌症复发和预测因子。比如:LINC00511可以通过miR-185调节STXBP4的表达,诱导乳腺癌抗辐射,导致乳腺癌的复发[14]。类似的研究发现,在宫颈癌细胞中LINC00511的沉默可以增强化疗药物紫杉醇的敏感性,抑制了细胞活力、细胞增殖、迁移和侵袭,促进了细胞凋亡,从而阻止了宫颈癌的发生发展和复发[15]。为了实现这些功能,LINC00511可以调节相关蛋白的表达,即Bcl-2、Bax、cleaved caspase-3、多 药 耐 药 蛋 白1(MRP1)和p糖蛋白[16]。Du等[17]发现,在多形性胶质母细胞瘤中,LINC00511高表达与复发相关,LINC00511通过miR524-5p间接调控YB1/ZEB1信号轴,增强多形性胶质母细胞瘤细胞增殖、迁移和侵袭。
在本研究中,我们通过下调LINC00511和VEGF,确定了LINC00511和VEGF在肺腺癌中的致癌功能。进一步的,我们发现LINC00511的敲低会导致VEGF的表达下调。而在下调LINC00511后,过表达VEGF,会使肺腺癌的增殖、侵袭和迁移能力得到恢复。我们结果显示,LINC00511可以通过上调血管内皮生长因子VEGF,来促进肺腺癌的增殖、侵袭和迁移。对于LINC00511在肺腺癌中的作用机制而言,VEGF是新的靶基因,为LINC00511在肺腺癌的研究以及肺腺癌的临床治疗提供了理论基础。

