通过Wnt/β-catenin通路影响结肠癌细胞凋亡
廖慧灵 董卫国
结直肠癌(colorectal cancer,CRC)是消化道最常见的恶性肿瘤之一,也是引发全球癌症患者死亡的第4大原因[1]。由于CRC的早期临床表现较为隐匿,大多数患者在诊断时已出现转移,故化疗在CRC的综合治疗当中占有重要地位[2]。尽管近年来CRC的综合治疗取得了较大的进步,但患者的总生存期仍差强人意。化疗耐药性的产生更是降低治疗效果的一大因素[3]。因此,迫切需要寻找新的特异性耐药靶点来改善CRC的化疗耐药,以提高整体疗效、增加患者的生存期。
驱动蛋白家族(kinesin superfamily proteins,KIFs)是一组具有高度保守运动结构域的蛋白,已被证明以微管和ATP依赖的方式将细胞器、蛋白质复合物和mRNA运输到特定的目的地,并参与了有丝分裂和减数分裂期间的染色体和纺锤体的运动[4]。目前,已有多种KIFs家族成员被证实参与肝癌、胃癌等肿瘤的发生、发展过程[5~7]。有研究发现,驱动蛋白家族分子C3(kinesin superfamily protein C3, KIFC3)在乳腺癌组织中高表达,且被鉴定为乳腺癌中多西紫杉醇的耐药基因[8,9]。另有研究发现,KIFC3在CRC组织与细胞中高表达,通过促进上皮间质转化(epithelial mesenchymal transition,EMT)刺激细胞的侵袭和迁移[10, 11]。但对其在CRC中的功能了解仍然有限。本研究通过敲低结肠癌HCT116细胞株中KIFC3表达,观察KIFC3在结肠癌细胞凋亡中的作用及可能机制,以期为结肠癌的治疗提供新的靶点。
材料与方法
1.实验材料:人结肠癌细胞HCT116来自中国典型培养物保藏中心。胎牛血清PRMI1640培养基、phosphate-buffered saline (PBS)、胰蛋白酶消化液均购自美国Gibco公司。由上海吉凯基因公司构建同时带有绿色荧光标记蛋白和嘌呤霉素抗性标记的KIFC3基因沉默重组慢病毒载体GV248-Msil-shRNA和阴性对照慢病毒载体GV248-NC-shRNA。嘌呤霉素、Hoechst 33258染色试剂盒、4%多聚甲醛和BCA 蛋白定量试剂盒购自上海碧云天生物技术有限公司。Annexin V-APC/7-AAD细胞凋亡检测试剂盒购自美国BD公司。KICF3、Bax、Bcl-2、PARP1、β-catenin、c-Myc和GAPDH购自武汉Proteintech公司。CC9和GSK-3β购自美国Cell Signaling Technology公司。
2.细胞培养:将人结肠癌HCT116细胞用含10%的胎牛血清、1%抗生素溶液(青霉素100U/ml 和链霉素100g/ml)的PRMI1640培养基培养,置于37℃、5%CO2的加湿培养箱中。待细胞融合度达到90%时,用胰酶消化细胞,进行传代培养。
3.慢病毒转染:取处于对数生长期的HCT116细胞,按照说明书每孔5×104个细胞接种于6孔板中。根据预实验转染的结果,病毒感染复数值为100,以此为依据分别加入相应的阴性对照病毒载体和沉默KIFC3病毒载体的病毒液,感染72h后通过显微镜观察荧光表达情况评估感染效率,再通过嘌呤霉素加压筛选,从而构建稳定表达的细胞系。通过实时荧光定量PCR(RT-qPCR)验证转染效率。实验分为未做任何处理的对照组、转染GV248NC-shRNA的阴性对照组(sh-NC组)和转染GV248Msil-shRNA的沉默组(sh-KIFC3组)。
4.RT-qPCR检测KIFC3和β-catenin mRNA的表达:收集慢病毒感染后的HCT116稳定细胞株,根据制造商的说明,使用TRIzol试剂(日本TaKaRa公司)从细胞裂解物中提取总RNA并反转录。使用带有gDNAEraser(perfect real-time,日本TaKaRa公司)的PrimeScriptTMRT试剂盒制备qPCR反应体系。通过qPCR与CFX Connect 实时系统(美国Bio-Rad公司)测量,使用β-actin作内参。qPCR引物详见表1。

表1 检测KIFC3和β-catenin mRNA表达的qPCR引物序列
5.Hochest 33258荧光染色法:将上述3组处于对数生长期的细胞种植于6孔板中,培养24h,用4%多聚甲醛固定细胞,在PBS中洗涤3次,按照说明书用Hoechst 33258染色。在正置显微镜下观察并随机在不同的视野中捕捉细胞核的形态。通过聚集在核膜外围的浓缩染色质或核体的完全碎片形态来鉴定凋亡细胞核。
6.Annexin V-APC/7-AAD双染流式细胞术:取上述3组处于对数生长期的细胞种植于6孔板中,培养24h,进行常规消化、离心后收集细胞,分别以冰PBS洗涤细胞2次;将细胞重悬后向每组加入5μl AnnexinV-APC和10μl 7-AAD,于室温避光孵育15min。用FACS Calibur流式细胞仪检测并分析各组细胞凋亡结果。上述实验独立重复3次。
7.Western blot法检测相关蛋白表达:按照提取蛋白试剂盒的说明提取上述3组细胞总蛋白, 用BCA试剂盒测定蛋白浓度。蛋白质经过SDS-PAGE电泳后转膜,用5%的脱脂奶粉于室温中封闭1h,加入一抗KIFC3(1∶1000)、Bax(1∶1000)、Bcl-2(1∶1000)、CC9(1∶1000)、PARP1(1∶1000)、β-catenin抗体(1∶1000)、GSK-3β(1∶1000)、c-Myc(1∶2000)及GAPDH抗体(1∶5000)4℃孵育过夜,加入TBST放摇床上清洗3次后,加入对应的二抗孵育1h。接着用TBST清洗3次,加入ECL发光液, 使用ChemiDoc TM Touh(BIO-RAD, 美国)化学发光仪检测各个条带,并用Image J分析各条带灰度值。上述实验独立重复3次。

结 果
1.慢病毒转染效率检测:使用倒置显微镜,分别在明场和荧光条件下观察各组转染细胞相应的荧光含量。结果显示,除对照组细胞外,sh-NC组和sh-KIFC3组细胞均高表达绿色荧光(图1)。qPCR的结果显示,sh-NC组细胞中KIFC3 mRNA的表达与对照组比较,差异无统计学意义(P>0.05,图2);与sh-NC组比较,sh-KIFC3组细胞中的KIFC3 mRNA的表达明显降低(P<0.001,图2)。
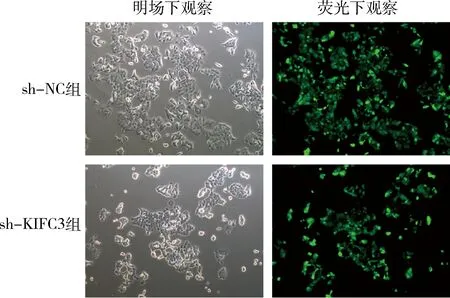
图1 荧光显微镜在明场和荧光下分别观察慢病毒感染后HCT116细胞发光情况(×200)

图2 RT-qPCR法检测HCT116细胞中KIFC3 mRNA表达
2.KIFC3对HCT116细胞凋亡形态的影响:通过核形态学评估Hoechst染色。结果显示,对照组和sh-NC组的细胞均发出弥散、均匀的蓝色荧光,且细胞核无明显的凋亡形态学特征,两者之间的差异无统计学意义(P>0.05,图3);sh-KIFC3组有较多的细胞核呈现出核染色质浓缩聚集、核碎裂、核边集及发出蓝白色荧光等典型的凋亡特征改变(P<0.05,图3)。
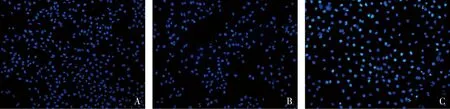
图3 Hochest 33258荧光染色法检测慢病毒感染后HCT116细胞中细胞凋亡形态(×200)A.对照组;B.sh-NC组;C.sh-KIFC3组
3.KIFC3对HCT116细胞凋亡率的影响:使用流式细胞仪进行凋亡检测分析,对照组、sh-NC组和sh-KIFC3组的细胞凋亡率分别为8.46%、8.73%和19.3%。结果显示,sh-KIFC3组HCT116细胞的凋亡率明显高于sh-NC组和对照组。表明KIFC3表达下调可促进结肠癌HCT116细胞发生凋亡,差异有统计学意义(P<0.001,图4)。
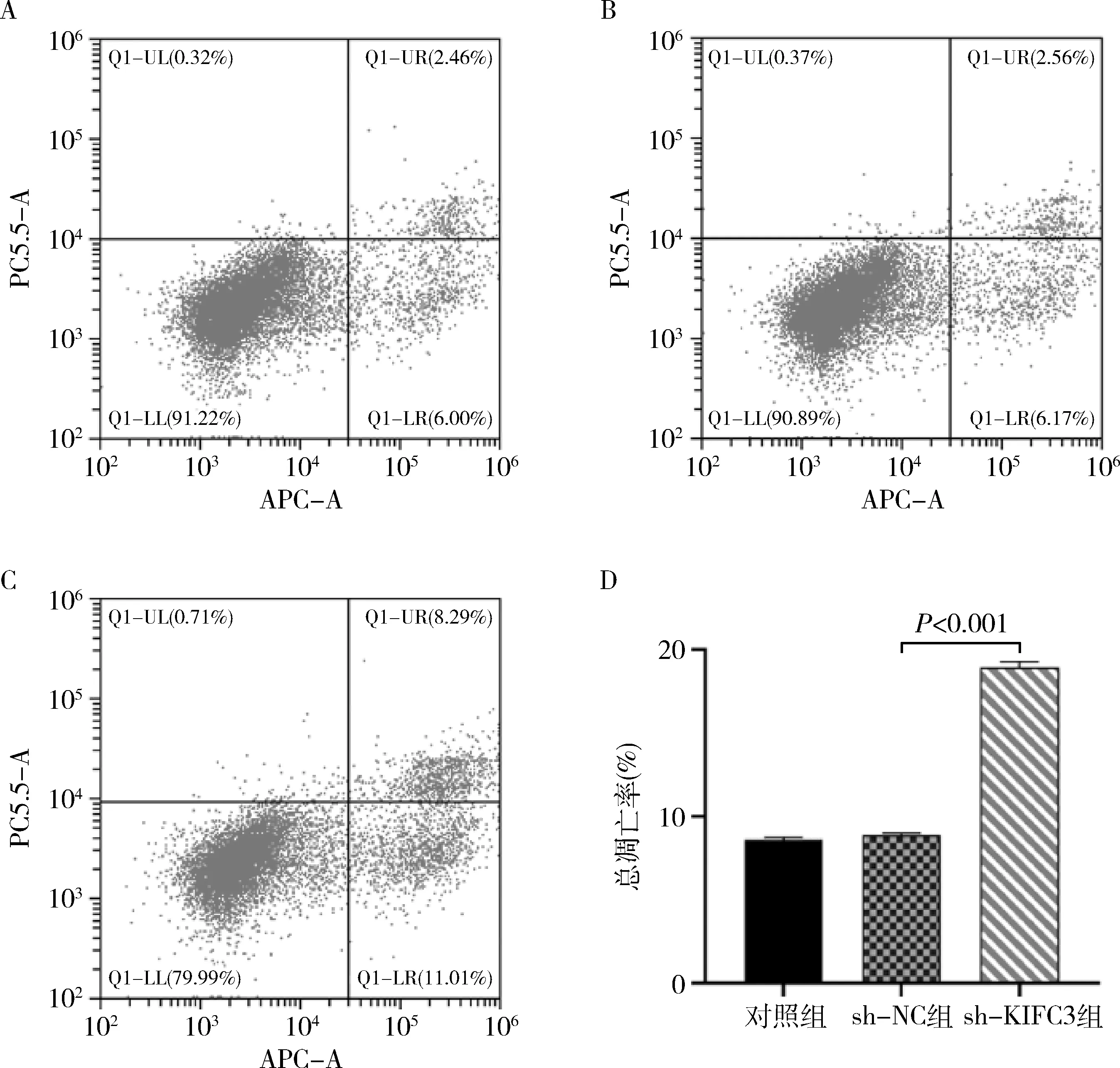
图4 流式细胞术检测慢病毒感染后HCT116细胞的凋亡率A.对照组;B.sh-NC组;C.sh-KIFC3组;D.各组细胞凋亡率的定量分析
4.KIFC3对HCT116细胞相关凋亡蛋白的影响:Western blot法检测各组细胞中KIFC3、Bax、Bcl-2、CC9、PARP1的表达,与对照组比较,sh-NC组细胞中的KIFC3、Bax、Bcl-2、CC9、PARP1的蛋白表达无明显变化(P>0.05,图5);与sh-NC组比较,sh-KIFC3组细胞内Bax表达水平增加,KICF3、Bcl-2、CC9、PARP1表达减少,差异有统计学意义(P<0.05,图5)。结果显示,表达下调的KIFC3诱导HCT116细胞凋亡可能是通过破坏Bcl-2/Bax比例、下调PARP1和CC9的表达。
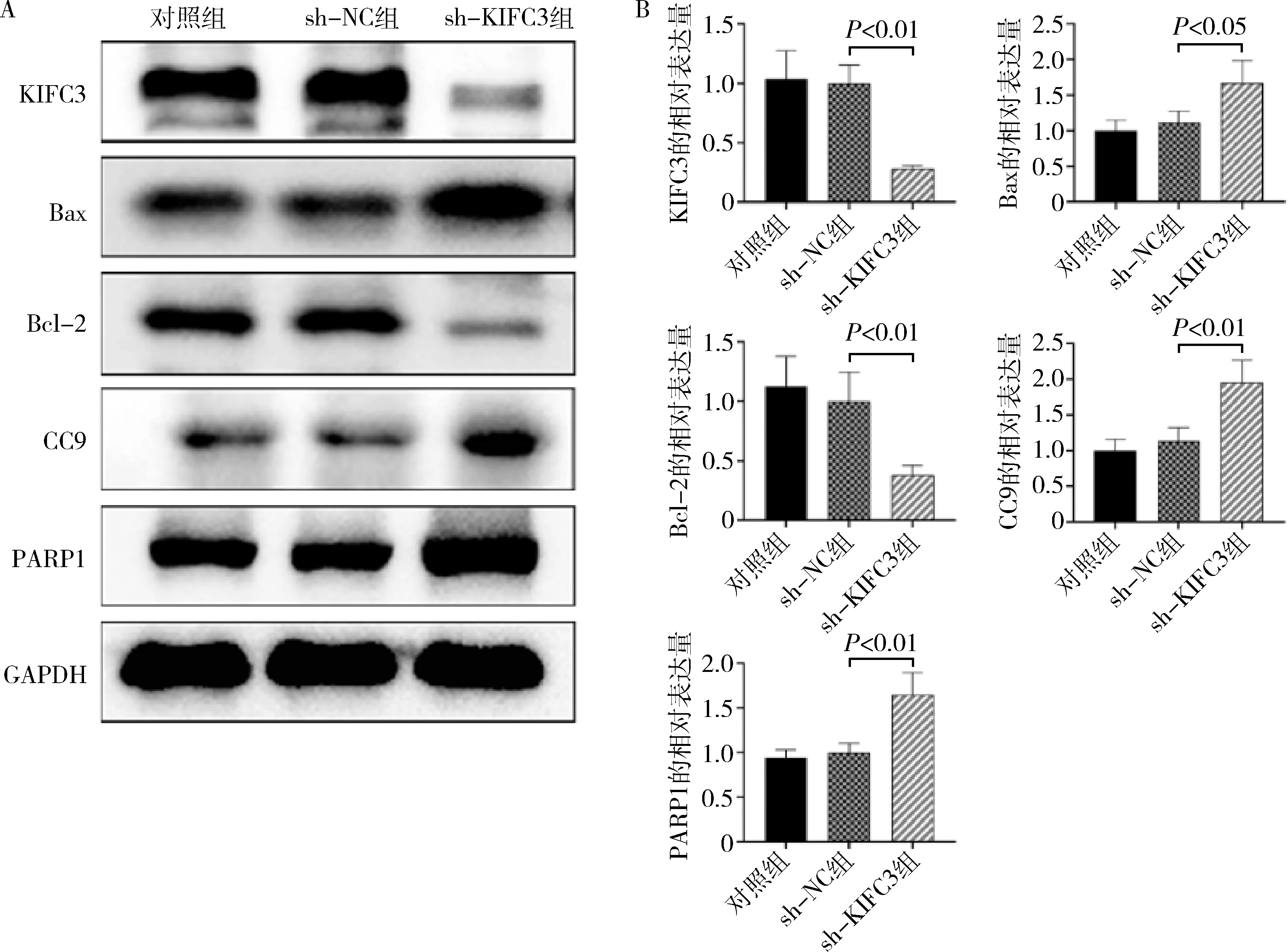
图5 KIFC3 下调对 HCT116 细胞相关凋亡蛋白的影响A.Western blot法检测KIFC3下调对HCT116细胞中相关凋亡蛋白的影响;B.KIFC3下调对HCT116细胞中相关凋亡蛋白的蛋白含量定量分析
5.KIFC3对HCT116细胞Wnt/β-catenin通路的影响:Western blot法检测各组细胞中β-catenin、GSK-3β和c-Myc的表达,与对照组比较,sh-NC组细胞中的β-catenin、GSK-3β和c-Myc蛋白表达无明显变化(P>0.05,图6);与sh-NC组比较,sh-KIFC3组细胞中的β-catenin和c-Myc蛋白表达下调,GSK-3β蛋白表达上调,差异有统计学意义(P<0.01,图6)。qPCR结果显示β-catenin mRNA在各组中的变化,与Western blot法检测的结果一致(P<0.01,图6)。
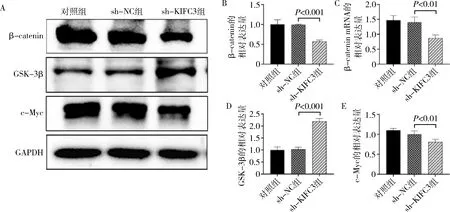
图6 KIFC3 下调对 Wnt/β-catenin相关蛋白含量的影响A.Western blot 法检测KIFC3下调对HCT116细胞中β-catenin、GSK-3β和c-Myc蛋白含量的影响;B.KIFC3下调对HCT116细胞中β-catenin蛋白含量定量分析;C.RT-qPCR法检测HCT116细胞中β-catenin mRNA表达;D.KIFC3下调对HCT116细胞中GSK-3β蛋白含量定量分析;E.KIFC3下调对HCT116细胞中c-Myc蛋白含量定量分析
讨 论
CRC是我国一种常见的消化道恶性肿瘤,其发生率逐年攀升。化疗可以有效减少肿瘤复发,延长患者的生存期。然而,随着疗程的深入,部分化疗药在治疗疾病的同时通过诱导肿瘤细胞或周围的基质细胞释放相关分子,上调抗凋亡蛋白、下调促凋亡蛋白表达或诱导部分耐药基因表达上调,改变肿瘤微环境,使肿瘤细胞避免被化疗药物杀伤,从而引发耐药[12]。这使得治疗效果大打折扣,甚至出现肿瘤的复发及转移。因此,寻找新的CRC耐药靶点,对提高CRC患者的生存率意义重大。
随着对基因研究的不断深入,肿瘤相关基因越来越受重视。肿瘤细胞对化疗药物耐药性的产生通常是由于特定基因的上调或下调,导致相关蛋白质的过度表达。研究发现,采用阿霉素和环磷酰胺的化疗方案可诱导基质细胞产生CXCL1,减少细胞凋亡,介导乳腺癌细胞耐药[13]。多西紫杉醇是一种常用的化疗药,通过阻止胞质分裂并导致细胞凋亡发挥作用。De等[14]研究发现,KIFC3、KIFC1、KIF1A或KIF5A的过度表达通过作用于微管,诱导乳腺癌细胞对多西紫杉醇的耐药。此外,Zhou等[15]研究发现,KIF11在CRC组织中上调,并且KIF11的敲低通过增强DNA损伤和细胞凋亡,增加对奥沙利铂的敏感度。由此可见,肿瘤相关基因的上调或下调与细胞凋亡及肿瘤细胞耐药性的产生高度相关。
KIFs在真核细胞中广泛表达,主要参与细胞内物质转运及有丝分裂中染色体和纺锤体分离[4]。KIFs的异常表达可通过影响有丝分裂过程诱导异倍体细胞的产生,进而导致肿瘤的进展[16]。大量研究发现,KIFs与肿瘤的发生、发展相关[5~7]。KIFC3属于KIFs第14亚家族,已有研究发现,KIFC3在CRC组织中高表达,且可促进肿瘤细胞的侵袭和迁移[10,11]。但KIFC3是否影响CRC细胞凋亡尚未明确。
细胞凋亡是一种程序性细胞死亡,在正常生长发育过程中对维持组织稳态和去除病变或受损细胞至关重要,是抑制细胞增殖和肿瘤发生的防御机制[17]。细胞凋亡功能的异常不仅促进了肿瘤发生、发展,同时还参与介导了肿瘤细胞的耐药[18]。在本研究中,我们通过使用Hochest 33258荧光染色评估各组细胞核的形态,发现sh-KIFC3组细胞中有较多的细胞核出现了核染色质固缩等凋亡特征性改变;通过流式细胞术分析可知sh-KIFC3组的凋亡比例更高。此外,KIFC3敲低会诱导促凋亡蛋白Bax增加,降低抗凋亡蛋白Bcl-2、CC9和PARP1表达。Bcl-2和Bax已被证实在细胞凋亡进程中起重要作用,而 PARP1参与DNA 损伤修复过程,抑制PARP1功能会干扰 DNA 正常修复,诱导DNA损伤,促进癌症进展[19]。这与笔者的研究结果相一致。因此,笔者推测KIFC3表达下调可以促进结肠癌细胞的凋亡。
Wnt/β-catenin信号通路是参与细胞凋亡的重要途径,β-catenin是通路中的关键转录共激活因子,严格调节着细胞间黏附[20]。在Wnt信号未激活的情况下,胞质内的β-catenin会被由轴抑制蛋白(AXIN)、腺瘤性息肉病大肠杆菌(APC)、糖原合酶激酶3(GSK3)和酪蛋白激酶1(CK1)组成的蛋白质复合物磷酸化,导致β-catenin降解,以保持较低基线水平[21]。已有越来越多的证据表明,Wnt/β-catenin信号通路的失调可以通过影响细胞凋亡导致恶性肿瘤的发生、发展[22]。在CRC中,Wnt/β-catenin信号通路的影响受到大量关注。研究发现,Wnt/β-catenin通路对CRC发生、发展起到了一定的促进作用[23]。有超过90%的CRC患者Wnt/β-catenin 通路的关键调节因子发生突变,而这些突变是造成CRC的重要因素[24]。Amna等[25]研究发现,β-catenin具有CRC预后价值以及作为患者分层生物学标志物的潜力。Wnt信号还可诱导EMT相关转录因子的表达,促进EMT。而EMT有助于CRC的侵袭和转移,并与化疗耐药高度相关[26]。本研究中笔者发现,当下调KIFC3的表达后,GSK-3β含量上升,β-catenin的蛋白含量也下降。由此笔者推测,下调KIFC3可能通过Wnt/β-catenin信号通路促进结肠癌细胞的凋亡。不过,结肠癌细胞的凋亡过程比较复杂,仍有很多作用机制尚未阐明,未来还需进一步深入研究。
综上所述,KIFC3可能通过Wnt/β-catenin通路促进结肠癌细胞的凋亡。本研究结果为CRC的早期诊断和基因靶向治疗提供了新思路,也进一步明确了有丝分裂纺锤体作为癌症治疗靶点的发展方向。

