脂肪来源间充质干细胞调控原发免疫性血小板减少症小鼠Th细胞因子失衡
肖建红,张阳春
(1.华中科技大学协和深圳医院血液科,广东深圳 518052;2.南华大学附属第一医院血液科,湖南衡阳 421001;3.深圳大学第二附属医院骨科中心,广东深圳 518101)
原发免疫性血小板减少症(primary immune thrombocytopenia,ITP)是血液科最为常见的一种由自身免疫紊乱而导致的机体血小板减少,在免疫系统具有器官特异性,由于人体内产生抗血小板自身抗体导致单核巨噬细胞系统破坏血小板过多,从皮肤、黏膜渗血,进而导致多个器官不同程度出血[1-2]。ITP 的发病原因及具体机制仍不完全清楚,在临床治疗上,对轻中度及急性的ITP 患者采取一般治疗方法如糖皮质激素、免疫抑制剂、脾切除等等疗效可显著改善,但对于复发、难治性ITP 患者目前尚无较好的防治方案[3-4]。因此,防治ITP新的有效疗法亟待探索。在治疗自身免疫性疾病领域,间充质干细胞已在多个免疫性疾病的治疗理念中有了跨越式发展,目前已成为一种全新的治疗策略[5-6]。而在干细胞来源种类的选择上,与骨髓等其他来源的间充质干细胞相比,脂肪来源的间充质干细胞(adipose-derived mesenchymal stem cells,AMSCs)具有更大优势:供体充足、容易获取及培养、生物个体间免疫原性低等,有着广泛的临床应用前景[7]。AMSCs 能否作为治疗自身免疫性疾病ITP 的一种新的手段,尚有待进一步研究证实。基于AMSCs 的低免疫原性特征及临床应用研究服务,我们采用人来源的AMSCs,探讨其对ITP 小鼠的疗效,免疫失衡的改善及特异性转录因子T-bet∕GATA-3 表达影响,并阐明AMSCs 在ITP 中的相关作用机制。
1 材料与方法
1.1 实验材料
SPF 级BALB∕c 小鼠,体质量为18~26 g,6~8 周龄,共30 只,动物实验经华中科技大学协和深圳医院伦理委员会批准;脂肪组织供体:筛选在深圳市宝安区人民医院手术室行抽脂术患者或和术中相关部位需要行多余脂肪组织切除的患者5 例(其中3 例女性,2 例男性),年龄18~45 岁,排除合并自身免疫系统疾病及影响免疫系统的其他疾患,并经外科医师确定获取的脂肪组织无进一步临床应用价值,以及术前术中无污染。所筛选的患者知晓实验目的、知情同意,同时实验方案征得我院医学伦理委员会批准(伦审[2016]A-002号)。
1.2 AMSCs分离、培养及检测以此为例重新调整标题
手术室获取的脂肪组织快速送往实验室,将其剪为小碎块并清除夹杂的非脂肪组织,加入胶原酶消化后,采用Ficoll 密度梯度离心弃除浮游颗粒。AMSCs 为贴壁细胞,加入DMEM 培养液,5%二氧化碳培养箱培养,经多次换液,待AMSCs 细胞生长到90%,再按比例传代,并显微镜下观察AMSCs 形态变化。根据前期研究经验[8],选取生长稳定、增殖能力强的第4 代传代细胞,用酶联免疫检测仪波长570nm 测定吸光值(OD 值),绘制细胞生长曲线;同时流式细胞检测AMSCs 表面抗原标记CD14、CD29、CD44、CD45及CD105分子表达。
1.3 AMSCs鉴定
1.3.1 诱导成脂分化 将传代好的第4 代AMSCs以5×103∕cm2密度接种于6 孔板,待增殖达90%后,更换DMEM 培养液。成脂诱导组细胞每孔加入2 mL成脂诱导剂(10%FBS的HG-DMEM 培养液中加 入1 µmol∕L 地塞米松,10 µg∕mL 胰岛素,200µmol∕L 吲哚美辛和0.5 mmol∕L IBMX),置5%二氧化碳培养箱培养3 天,再用成脂诱导保持液处理,循环3 次后诱导维持培养液(只含有10 µg∕mL胰岛素)处理一周并定期换液。对照组细胞加入10% FBS 的HG-DMEM 培养。3 周后行油红“O”脂肪染色法观察脂肪颗粒。
1.3.2 油红“O”脂肪染色 AMSCs成脂诱导达3周后去除细胞当前使用培养液,PBS 清洗3 次;27.5%甲醛室温固定20 min 后PBS 清洗3 次,空气中干燥;加入0.5%的红油室温孵育1 h,60%异丙醇清洗30 s;PBS 清洗3 次后,倒置显微镜下观察并记录。
1.3.3 诱导成骨分化 将传代好的第4 代AMSCs以5×103∕cm2密度接种于6 孔板,待增殖达90%后,更换DMEM 培养液。成骨诱导组细胞每孔加入2 mL 成骨诱导剂(10%FBS 的LG-DMEM 培养液中加入50 µmol∕L 抗坏血酸,10 mmol∕L β-磷酸甘油和100 nmol∕L 地塞米松),置5%二氧化碳培养箱培养,维持诱导3 周并定期换液。对照组细胞加入含10%FBS 的LG-DMEM 培养液。3 周后行茜素红染色法观察钙质颗粒。
1.3.4 茜素红染色 AMSCs 成骨诱导达3 周后去除细胞当前使用培养液,使用PBS 清洗三次;使用10%甲醛室温固定15 min 后PBS 清洗3 次;按照1 mL∕孔加入40 mmol∕L 的茜素红染色液,室温孵育20 min 并轻微振荡;清除掉未完全结合的染料,用PBS漂洗并振荡5 min重复4次;倾斜放置2 min,去除多余的清洗液,倒置显微镜下观察并记录。
1.4 ITP小鼠建立及处理
将30 只BALB∕c 小鼠编号并随机分成3 组,即正常对照组(Normal组)、ITP对照组(ITP∕PBS组)及ITP 实验组(ITP∕AMSC 组),每组10 只,除正常对照组外,其余两组均按我们前期已成功建立ITP 小鼠模型的方法继续造模[9]。3 组小鼠分别处理如下,ITP 实验组:从ITP 小鼠尾静脉输注200 µL 1×106∕mL AMSCs;ITP 对照组:从ITP 小鼠尾静脉输注200µL PBS;正常对照组小鼠不进行任何处理。根据我们既往研究及参考文献,ITP 模型建立后进行1 次AMSCs 注射,处理后的第7 天,断颈处死小鼠,获取标本并进行相关指标检测。
1.4.1 Th1∕Th2细胞因子 将获取的小鼠部分外周血分离血清,酶联免疫吸附测定(ELISA)各组血清IFN-γ、IL-2、IL-4及IL-10细胞因子表达。96孔酶标板按照次序分别加入100µL 的标准品,100µL样品,空白对照加入100µL 的蒸馏水,详细步骤按ELISA试剂盒说明书,用酶标仪在450 nm处测吸光值(OD 值),以标准品浓度为横坐标,OD 值为纵坐标绘制标准曲线,所有样品孔OD 值均减除空白孔值后计算各种细胞因子含量。
1.4.2 外周血小板水平 按照实验设计定期获取的小鼠尾静脉血100 µL,将血液和100 µL 1%EDTA-Na2 抗凝剂充分混合后,送检验科全自动血细胞分析仪检测血常规并记录外周血小板水平。
1.4.3 免疫磁珠分纯Th 细胞 密度梯度离心法分离获得的外周血单个核细胞,将细胞悬液移至Eppendorf 管,离心、弃上清、重悬后加入CD4 Micro-Beads 充分混匀,在4℃孵化15 min;用Buffer 洗涤细胞,再次离心、重悬。将MS 分离柱放置在MACS分离器的磁场中,以Buffer 漂洗,将细胞悬液通过分离柱,反复Buffer冲洗分离柱3次。取出分离柱,用1 mL Buffer 加压冲洗分离柱,收集含CD4+T 淋巴细胞流出液,即Th细胞,已备基因检测。
1.4.4 特异性转录因子基因表达 实时荧光定量PCR(RT-PCR)检测小鼠外周血调控Th1∕Th2 细胞分化的特异性转录因子T-bet∕GATA-3 表达水平,GenBank 上查找目的基因mRNA 序列,在CDS 区设计特异性引物,序列见表1。
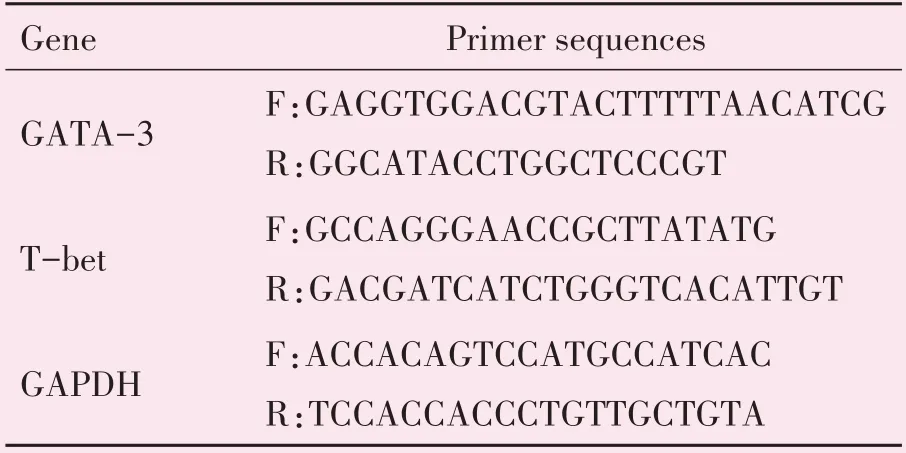
表1 Th细胞特异性转录因子及相关细胞因子引物序列Table 1 Th cell specific transcription factors and related cytokines’primer sequences
按常规方法提取总RNA,加入DEPC 水溶解。取4µL RNA 模板做逆转录反应,逆转录聚合酶链反应体系如下:5×逆转录buffer 4.0 µL,下游引物(10 pmol∕µL)0.5 µL,dNTPs(10 mmol∕L)0.5 µL,MMLV(200 U∕µL)0.5 µL,DEPC 水10.5 µL,RNA模板4.0 µL,总体积为20.0 µL。实时荧光定量PCR 反应体系如下:5×SYBR Green ⅠPCR buffer 10µL,上游引物F(10 pmol∕µL)1.0µL,下游引物R(10 pmol∕µL)1.0 µL,dNTPs(10 mmol∕L)1.0 µL,Taq 酶(3 U∕µL)1.0 µL,cDNA 5.0 µL,ddH2O 31.0µL,总体积:50.0µL。PCR 条件:93℃,3 min-93℃,15 s-55℃,30 s-72℃,30 s,共40循环。
1.5 数据统计处理
2 结果
2.1 AMSCs细胞形态观察
AMSCs 为贴壁细胞,形态多呈梭形,随着细胞增殖和多次传代,呈集落式生长,漩涡状排列;供输注ITP小鼠用的P4代细胞呈不规则梭形,有单个细胞核仁或者双核,核仁基本居中,呈类圆形(图1)。
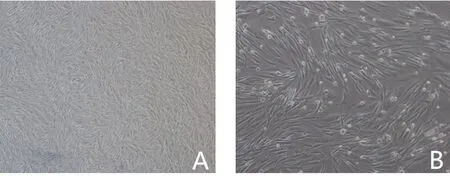
图1 显微镜下P4代AMSCs细胞形态Fig.1 Cell morphology of P4 AMSCs observed under microscope
2.2 AMSCs细胞免疫表型
P4 代AMSCs 细胞表面CD29、CD44 和CD105抗原标记呈强阳性表达,分别为97.54%、97.34%和99.61%;低表达抗原标记CD14 及CD45 分子,分别为2.51%和0.26%(图2),细胞免疫表型鉴定结果合格。
2.3 AMSCs细胞生长曲线
P4 代细胞的生长增殖呈S 形,第0~3 天时处于起始期,3 天后增殖加快并进入对数生长期,1 周后进入平台期。按照生长曲线实验数据得细胞的倍增时间为26 h,其生长达平台期平均扩增时间为5 d(图3)。

图3 P4代AMSCs细胞生长增殖情况Fig.3 Growth and proliferation of P4 AMSCs
2.4 AMSCs分化能力测定结果
2.4.1 AMSCs 诱导成脂分化 P4代AMSCs 增殖稳定后,通过成脂诱导剂达3 周后去除细胞培养液,27.5%甲醛等处理后行油红“O”脂肪染色倒置显微镜下观察见细胞内红色脂肪颗滴,结果符合实验预期(图4)。
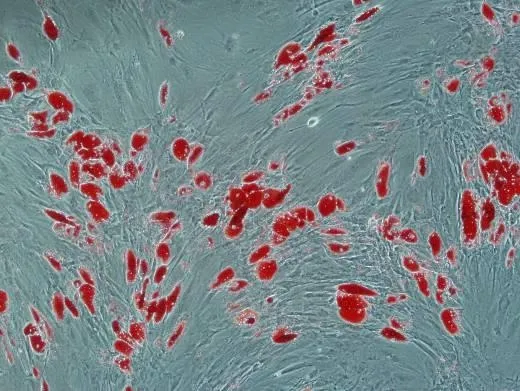
图4 AMSCs诱导成脂分化Fig.4 Lipogenic induction of AMSCs
2.4.2 AMSCs 诱导成骨分化 P4代AMSCs 增殖稳定后,通过成骨诱导剂达3 周后去除细胞培养液,10%甲醛室温固定等处理后,茜素红染色液染色可见细胞质大量红色钙结节(图5)。

图5 AMSCs诱导成脂分化Fig.5 Osteogenic induction of AMSCs
2.5 小鼠一般状况
建模后,ITP小鼠一般状况比正常对照组较差,进食量和活动量有所下降;ITP 小鼠经过AMSCs 治疗1 周,进食量和活动量均较治疗前有所增加,且好于ITP 对照组。同时ITP 实验组经AMSCs 治疗1周后观察小鼠皮肤紫癜范围有所减少。分组前及各组小鼠在干预前(0 周)、造模后1 周(第1 周)及AMSCs 治疗后1 周(第2 周)体质量符合正态分布,经单因素方差分析3 组小鼠体质量在第1 及2 周组间差异有统计学意义(统计值分别为F=4.12,P=0.035 4;F=5.06,P=0.018 6),采用Bonferroni 法进一步作两两比较统计得出:ITP 小鼠在AMSCs 治疗前(第1 周)的平均体质量(ITP∕PBS 组及ITP∕AMSC组)均轻于正常小鼠Normal 组,差异有统计学意义(分别为P=0.008 5,P=0.007 8),而ITP∕PBS组与ITP∕AMSC组比较差异无统计学意义(P=0.525 1);2周后,经AMSCs 治疗后ITP 小鼠的体质量虽未恢复至正常小鼠,差异有统计学意义(P=0.028 1),但比对照组ITP 小鼠显著增加,差异有统计学意义(P=0.000 6;表2)。
表2 不同时间各组小鼠体质量情况比较Table 2 Comparison of mice weight in each group at different time g()
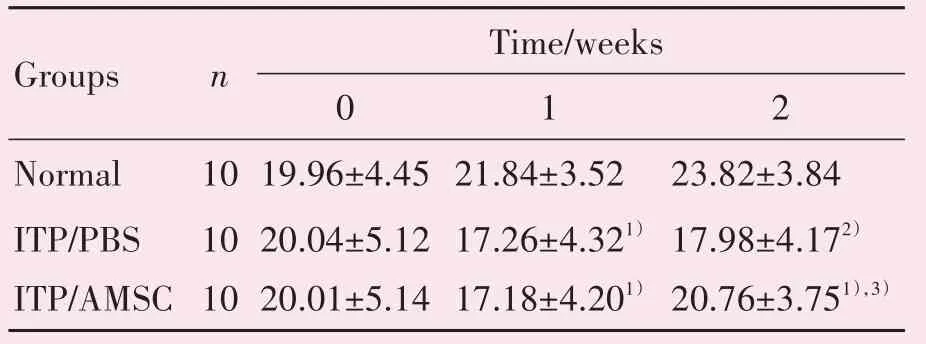
表2 不同时间各组小鼠体质量情况比较Table 2 Comparison of mice weight in each group at different time g()
Compared with the normal group,1)P<0.001;2)P<0.01;compared with the control group,3)P<0.05.
2.6 外周血小板水平检测
通过血细胞分析仪检测小鼠外周血小板水平,各组数据符合正态分布,经单因素方差分析,3 组小鼠血小板水平在第3~6 天组间差异均有统计学意义,第3 天(F=56.18,P=0.000 0)、第4 天(F=44.35,P=0.000 0)、第5 天(F=41.63,P=0.000 0)、第6天(F=37.35,P=0.000 0)。采用Bonferroni法进一步作两两比较发现:与Normal 组小鼠比较,ITP∕PBS 组及ITP∕AMSC 组小鼠血小板水平较低(均P=0.000 0);经AMSCs 治疗后,ITP∕AMSC 组血小板水平虽有所升高(与ITP∕PBS 组比较,在第3~6 天,均有统计学差异,P值依次为0.010 4、0.000 6、0.000 0及0.000 0),但仍未达到正常水平(与Normal 组比较,仍有显著性差异,均P=0.000 0;图6)。通过3组数据比较分析得出,AMSCs 可提高ITP 小鼠血小板水平。
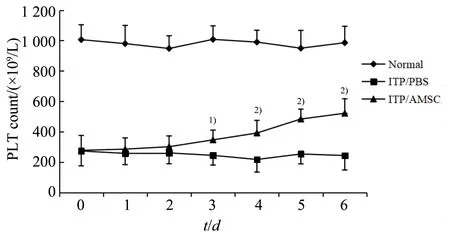
图6 3组小鼠外周血小板水平变化Fig.6 Changes of peripheral blood platelet levels in three groups
2.7 T-bet/GATA-3表达水平
通过RT-PCR 检测特异性转录因子T-bet∕GATA-3 mRNA 表达水平,各组数据符合正态分布,经单因素方差分析,3 组小鼠T-bet mRNA 及GATA-3 mRNA 表达组间差异均有统计学意义(统计值分别为F=29.86,P=0.000 0;F=27.35,P=0.000 0)。采用Bonferroni 法进一步作两两比较发现ITP∕PBS组小鼠T-bet 表达明显高于Normal 组及ITP∕AMSC组小鼠(均P=0.000 0);经AMSCs 治疗后,ITP 小鼠T-bet表达虽有所降低,但仍高于正常小鼠,差异有统计学意义(P=0.000 0)。而对于Th2 细胞的特异性转录因子GATA-3 mRNA 表达,ITP∕PBS 组小鼠明显低于Normal 组小鼠表达(P=0.000 0);经AMSCs 治疗后,ITP 小鼠GATA-3 表达显著上升,高于ITP∕PBS 组小鼠(P=0.000 0),但仍低于正常小鼠(P=0.012 8;图7)。

图7 T-bet/GATA-3 mRNA在3组小鼠中的表达Fig.7 Expression of T-bet/GATA-3 mRNA in three groups of mice
2.8 小鼠外周血Th1/Th2细胞因子表达
通过ELISA检测小鼠外周血Th1∕Th2相关细胞因子,各组数据符合正态分布,经单因素方差分析,3 组小鼠IL-2、IFN-γ、IL-4 及IL-10 表达组间差异均有统计学意义(统计值分别为F=29.86,P=0.000 0;F=27.35,P=0.000 0)。采用Bonferroni 法进一步作两两比较发现:ITP∕PBS 小鼠血清Th1 细胞因子IFN-γ、IL-2 水平高于正常Normal 组(均P=0.000 0),经AMSCs 治疗后,ITP 小鼠IFN-γ、IL-2与ITP∕PBS 组比较显著下降,差异有统计学意义(分别为P=0.000 6,P=0.000 8),虽然IL-2 水平尚未恢复正常小鼠水平(P=0.010 5),但IFN-γ因子已接近正常水平,与Normal 组比较差异无统计学意义(P=0.084 2);对于Th2 细胞因子IL-4 及IL-10,ITP∕PBS 小鼠显著低于Normal 组(均P=0.000 0),经AMSCs 输注后,ITP 小鼠血清IL-4 及IL-10 水平均上升,虽与Normal 组比较尚未恢复正常水平(分别为P=0.018 4,P=0.025 1),但较ITP∕PBS组小鼠有非常显著差异(分别为P=0.000 1,P=0.000 7;图8)。

图8 ITP小鼠Th1/Th2细胞相关因子表达Fig.8 Expression of Th1/Th2 cytokines in ITP mice
3 讨论
ITP 是人体血液系统的常见病,亦与免疫系统密切相关,是具有器官特异性的自身免疫紊乱性血液病[10-11]。由于人体内产生抗血小板自身抗体导致单核巨噬细胞系统破坏血小板过多,从早期的皮肤黏膜渗血,进展为多个重要器官的不同程度出血[11]。在临床治疗上,对轻中度及急性的ITP 患者采取一般治疗方法如糖皮质激素、免疫抑制剂、脾切除等等疗效显著,但对于复发、难治性ITP 患者目前尚无较好的防治方案[3,12-13]。近年来,对ITP的发病机制有了更新的认识:ITP 患者机体产生了针对自身自身抗体的淋巴B 细胞离不开特异性自身反应性T 细胞的辅助即Th 细胞(辅助性T 淋巴细胞),分化异常的Th 及其产生的细胞因子导致机体Th 淋巴细胞免疫失衡,进而引起一系列免疫炎性反应,产生针对血小板的自身反应性抗体异常增多,最终导致ITP的发生和发展[10,14]。
目前认为,ITP 机体Th 淋巴细胞免疫的失衡,主要是其产生的Th1 细胞因子和Th2 细胞因子的比例失衡所致[15]。Th 细胞的分类是根据其生物学特性和产生细胞因子种类而区分为4 种不同的类别,除了Th1及Th2细胞外,还有Th3细胞即调节性T 细胞(Treg)和较晚发现的Th17 细胞[16-17]。在ITP免疫调节机制中产生关键作用的是Th1 及Th2 细胞[16-17]。Th1 细胞主要产生IL-2、IFN-γ 等因子,介导固有免疫等细胞免疫应答[18]。更重要的是在ITP中,Th1 细胞因子IFN-γ 的异常升高,能直接抑制Th2 细胞的分化和功能,以及Th2 细胞因子表达[18-20]。而Th2 细胞主要产生IL-4、IL-10 等因子,介导机体体液免疫应答[18]。ITP 患者的Th1 和Th2的免疫失衡,主要是Th1 细胞因子异常增多导致,是Th1 因子占主导地位的免疫性疾病[18]。作者通过建立ITP 小鼠模型,并对外周血对Th1 及Th2 细胞因子检测,再次探明,ITP 小鼠血清Th1细胞因子IFN-γ 及IL-2 的表达水平高于正常小鼠;同时Th2细胞因子IL-4及IL-10表达水平低于正常小鼠。
鉴于ITP 患者的Th1∕Th2 细胞因子的免疫失衡,新的治疗理念有了跨越式发展,针对其免疫失衡的新型药物已在临床上逐步开始尝试[18]。Alemtuzumab,是一种抗糖基磷脂酰肌醇锚定的糖蛋白(CD52)的人源化单克隆抗体,可抑制ITP 患者Th细胞免疫失调,虽然具体机制尚有待进一步阐明,但临床研究发现Alemtuzumab 可成功改善难治性ITP 患者血小板水平并能持续有效,而不足之处是可能由于该药物的免疫原性等问题,患者治疗后多出现的不良反应为发热,带状疱疹等[3]。人脐带间充质干细胞是一种仅存在于新生儿脐带组织中的一种多功能干细胞,有文献报道慢性难治性ITP 患者经过人脐带间充质干细胞治疗,疗效显著,在两年的随访中,1年的缓解率高达100%[21]。虽然研究例数不多及还需大样本量进一步证实,但人脐带间充质干细胞治疗后1 年的100%有效缓解率及低副反应确实令人瞩目。除了脐带间充质干细胞外,其他如骨髓间充质干细胞、AMSCs等间充质干细胞均有着共性,具有生物个体间低免疫原性,调控过度的细胞免疫应答,改善机体免疫失衡[22]。相对其他来源的间充质干细胞而言,从脂肪获取的AMSCs,来源广及易培养增殖是其最大的优势。在前期实验的基础上[23],作者再次通过分离培养人来源的AMSCs 输注ITP 小鼠,发现AMSCs 能改善Th1∕Th2细胞因子失衡,Th1细胞代表性因子IFN-γ、IL-2水平下降,Th2 细胞代表性因子IL-4、IL-10 的水平上升,同时ITP 小鼠外周血血小板水平提高。除了Th1∕Th2 相关细胞因子,外周血小板水平等客观指标改善外,我们也观察到ITP 小鼠经AMSCs 输注后体质量有明显提高,虽然ITP 小鼠的皮肤黏膜等出血性瘀斑尚无客观指标进行统计分析[24],实验组ITP小鼠经治疗后表现出紫癜不同程度的减少。更重要是我们进一步深层次发现,ITP 小鼠Th细胞特异性转录因子GATA-3 和T-bet 发生表达改变,Tbet 水平显著性高于正常小鼠,同时GATA-3 表达低于正常。目前已证实,在自身免疫性疾病中特异性转录因子T-bet 和GATA-3 与Th 细胞的分化和Th1∕Th2 细胞因子平衡密切相关[25-27]。通过AMSCs的输注,ITP 小鼠T-bet 表达下调,同时GATA-3 表达增加。据此,我们得出:AMSCs 可能通过对TBet∕GATA3 的转录调控,影响Th1∕Th2 细胞因子失衡,从而改善ITP小鼠血小板水平。
综上所述,ITP 机体存在Th1∕Th2 细胞因子免疫失衡,以Th1 细胞因子占主导,AMSCs 可能通过对Th 细胞的T-bet∕GATA-3 的转录调控,减少Th1因子分泌、增加Th2 因子分泌,改善ITP 免疫失衡,恢复血小板水平。

