胸骨后重建路径联合术后辅助放疗在微创Mckeown食管癌切除术近期并发症与安全性分析
田界勇,梅新宇,张天赐,徐广文,熊燃
(中国科学技术大学附属第一医院∕∕安徽省立医院胸外科,安徽合肥 230001)
食管癌(esophageal cancer)是我国高发恶性肿瘤之一,高居我国恶性肿瘤死亡率第四位[1-2]。外科手术是食管癌治疗的主要方式之一,5 年生存率为40%左右[3]。随着食管外科微创技术的不断发展,微创Mckeown食管癌切除术即胸腹腔镜联合食管癌切除术(食管胃颈部吻合)的手术方法逐渐被大家接受,是目前国内外食管癌手术的主流术式选择[4]。
现阶段,微创Mckeown 食管癌切除术常用的管状胃上提路径主要包括后纵隔路径和胸骨后路径,这两种不同的上提路径对食管癌患者术后并发症的发生率有相当重要的影响。目前,后纵隔路径是最常用的方法,但该路径也存在一些缺点,主要是表现在一旦发生颈部吻合口瘘,易导致胸内瘘,而颈部吻合口胸内瘘发生后处理非常困难,易出现肺部感染,感染性休克,大出血,瘘口经久不愈合等严重并发症[5-6]。而胸骨后路径技术最大优点是安全,其优势主要在于降低患者术后肺部感染的发生率、改善患者术后消化道症状及为术后辅助放疗预留照射空间[7-9]。因此,本研究回顾性分析2020 年1 月至2021 年6 月期间在中国科学技术大学附属第一医院胸外科接受微创Mckeown 食管切除术,根据管状胃上提途径分胸骨后路径组与后纵隔路径组,比较两组患者临床资料及术后并发症发生情况。现报告如下:
1 材料与方法
1.1 临床资料
回顾性分析中国科学技术大学附属第一医院胸外科接2020 年1 月至2021 年6 月期间接受微创Mckeown 食管癌切除术的患者89 例。其中胸骨后路径组39 例,后纵隔路径组50 例。男性患者71例,女性患者18 例。平均年龄67.6 岁,中位年龄69.0(63.0~73.0)岁。
患者的术前检查包括:常规血检(血常规、生化、凝血象、免疫组合),心肺功能(心电图、超声心动图,肺功能),颈胸部平扫+增强CT、腹部超声,上消化道造影、胃镜检查及活检病理,部分患者行PET-CT。所有患者的肿瘤分期采用AJCC 第8 版TNM分期系统。
1.2 患者纳入与排除标准
纳入标准:①术前临床分期为T1-3N0-1M0的胸段食管癌患者;②行胸腹腔镜联合微创Mckeown 食管癌切除术,同时行二野或三野淋巴结清扫;③术前心肺功能检查均能够耐受手术;④病历资料完整的患者。排除标准:①无病理证实且合并其他肿瘤的患者;②既往有胸腹部手术史或胸骨正中劈开入路手术史;③术前心肺功能不能耐受手术;④有凝血障碍疾病者。
1.3 手术方法
全部患者均行气管内全麻(单腔气管插管联合封堵器)。
1.3.1 胸骨后路径组 胸部操作:患者先取左侧卧位,单肺通气。胸部手术采用3 孔法操作,右侧腋中线第7 肋间1 cm 切口为观察孔,右侧腋前线第4肋间2 cm切口为主操作孔,腋后线第8肋间2 cm切口为副操作孔。松解下肺韧带,交替使用(harmonic 型号HARH36)超声刀(美国强生公司)和型号KJ-DN0205G 电凝钩(杭州康基医疗器械有限公司)完成胸段食管游离,清扫上段、中段、下段食管旁,气管旁,左右喉返神经旁,隆突下,下肺韧带和隔肌淋巴结。使用EC60A-3.5 mm 直线切割缝合器(美国强生公司)离断食管,经腋中线第7 肋间留置28号胸管一根。关闭胸壁各切口。
颈部操作:患者重新摆平卧位,经左侧胸锁乳突肌内缘切口游离出食管,切开食管,放置圆形吻合器底钉座。
腹部及颈部操作:双肺通气。腹部手术采用5孔法操作,脐下做1 cm 切口做观察孔,建立人工气腹,右肋缘下做0.5 cm 切口,左右侧锁骨中线与脐上两横指水平线交点做0.5 cm、1.0 cm切口,剑突下做0.5 cm 切口。用超声刀完成胃大小弯的游离,用10 mm Hem-o-lok(北京华康普美科技有限公司)结扎胃左血管后离断。保留胃网膜右动脉,清扫贲门旁、胃小弯上部、胃左血管旁、肝总动脉旁、脾动脉旁、腹腔动脉旁淋巴结。胃完成游离后,关闭隔肌裂孔。腹腔镜下使用超声刀打通胸骨后隧道,注意避免损伤心包和双侧纵隔胸膜,自颈部胸骨后置引流管自腹腔操作孔引出,延长剑突下切口至4 cm,将胃提出用EC60A-3.5 mm 直线切割缝合器制作管状胃,移除远端食管及胃小弯组织,切缘予以丝线加缝,管状胃与胸骨后引流管连接并上提至颈部。胃壁上做一小口,置入吻合器主机,完成食管状胃端侧吻合。最后用内镜下直线切割缝合器切除胃残端。残端用4-0 可吸收缝线加缝,放置胃管,鼻肠管。颈部切口放置引流,关闭颈部腹部切口。
1.3.2 后纵隔路径组 胸部操作:患者先取左侧卧位,单肺通气。胸部手术采用3 孔法操作,右侧腋中线第7 肋间1 cm 切口为观察孔,右侧腋前线第4肋间2 cm切口为主操作孔,腋后线第8肋间2 cm切口为副操作孔。松解下肺韧带,交替使用超声刀和电钩完成胸段食管游离,清扫上段、中段、下段食管旁,气管旁,左右喉返神经旁,隆突下,下肺韧带和隔肌淋巴结。经腋中线第7 肋间留置28 号胸管一根。关闭胸壁各切口。
腹腔操作:双肺通气。腹部手术采用5 孔法操作(同胸骨后路径组),用超声刀完成胃大小弯的游离,用(10 mm)Hem-Lock 结扎胃左血管后离断,保留胃网膜右动脉,清扫贲门旁、胃小弯上部、胃左血管旁、肝总动脉旁、脾动脉旁、腹腔动脉旁淋巴结。胃完成游离后,上腹正中辅助小切口长约4 cm,于贲门上离断食管,将胃提出用内镜下EC60A-3.5 mm 直线切割缝合器制作管状胃,切缘予以1 号丝线加缝,胃底缝线于近端食管残端系线连接。
颈部操作:经左侧胸锁乳突肌内缘切口游离出食管,切开食管,放置CDH25A 圆形吻合器(美国强生公司)底钉座。胃壁上做一小口,置入吻合器主机,完成食管胃端侧吻合。最后用EC60A-3.5 mm直线切割缝合器切除胃残端。残端用4-0 可吸收断装缝线加缝,放置胃管,鼻肠管。颈部切口放置引流,关闭颈部腹部切口。
1.4 放疗技术方法
1.4.1 CT 模拟定位 应用头颈肩网或真空垫固定患者体位,病人取仰卧位,扫描范围自环状软骨下缘水平至第一腰椎下缘水平。要求进行CT增强扫描,但如果患者对造影剂过敏或高龄、有合并症时,可以不作增强扫描,仅进行平扫,建议此类患者行PET-CT检查进行图像融合以辅助靶区勾画。
1.4.2 靶区勾画 术后原发灶残留处、残留淋巴结、选择性淋巴引流区预防照射;结合术中所见及术后病理;若无法确定,残留淋巴结判断依据PETCT(FDG 代谢>2.5)与胸部增强CT(短径≥1 cm,气管食管沟淋巴结短径≥0.5 cm),必要时行侵入性检查(EUS、EBUS)获取肿大淋巴结病理加以确定;大体肿瘤靶区(GTV)包括术后原发灶残留处及残留淋巴结;对于上切缘阳性或切缘距肿瘤≤3 cm 患者,GTV 可包括吻合口;临床靶区(CTV)为选择性淋巴引流区预防照射(ENI),胸中段食管鳞癌CTV包括以下淋巴引流区:1R 组、1L 组、2R 组、2L 组、4R 组、4L 组、7 组、8U 组、8M 组(至气管隆突下3 cm)。计划肿瘤靶区(PTV-G 与PTV-C):在GTV 与CTV 基础上外放6~8 mm,避免外放到皮下3 mm 以外(图1)。
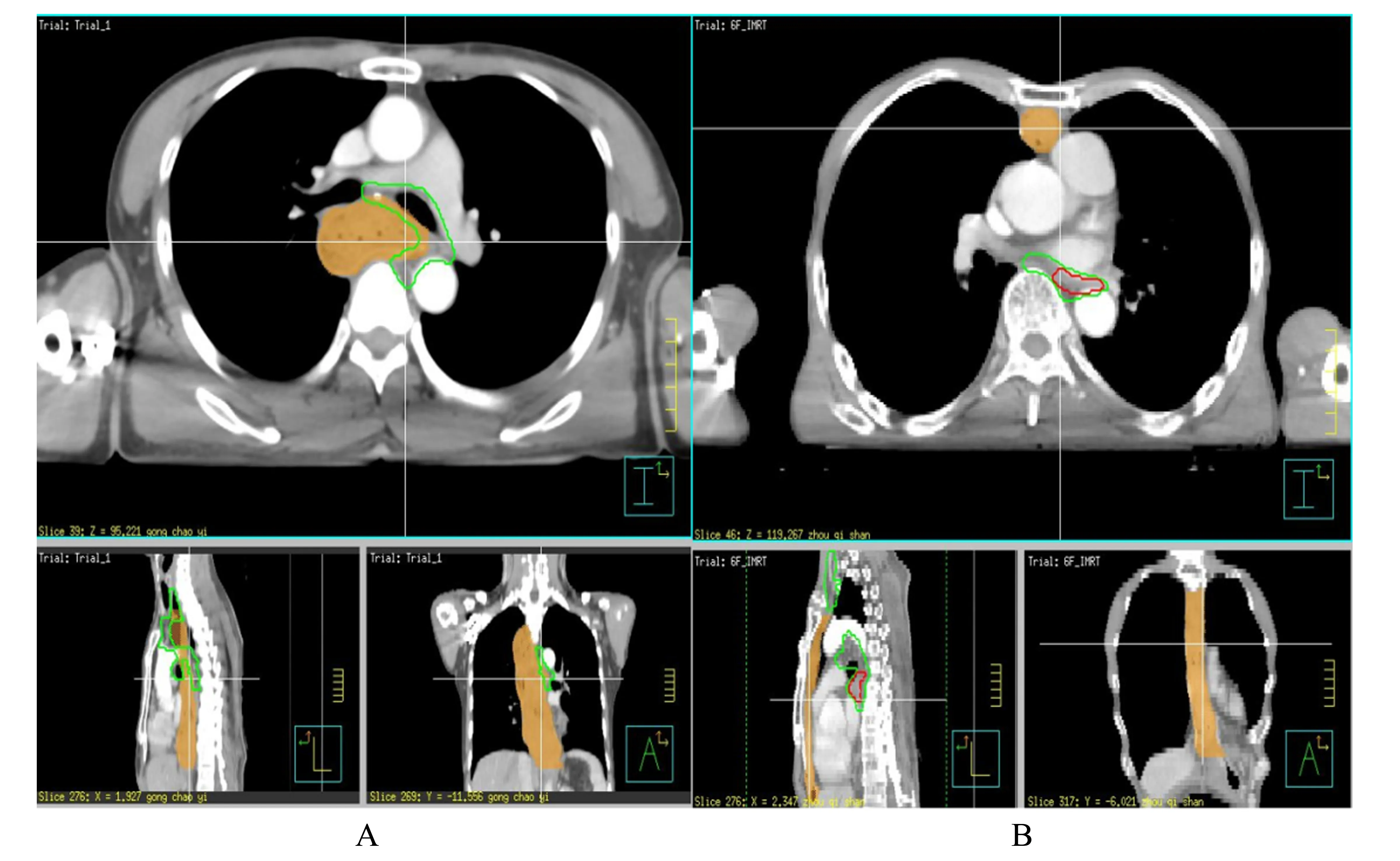
图1 后纵隔路径与胸骨后路径术后辅助放疗示意图Fig.1 Schematic diagram of postoperative adjuvant radiotherapy by Posterior mediastinal route and Retrosternal route
1.4.3 照射剂量 PTV-G,60.2 Gy∕28 f;PTV-C,50.4 Gy∕28 f。
1.5 观察指标
比较两组患者的围手术期相关指标,包括术中出血量、手术时间、术后3天引流量、术后胸腔引流管及胃管及颈部引流管放置天数;术后放疗并发症情况。
比较胸骨后路径组与后纵隔路径组患者围手术期并发症发生情况,包括吻合口瘘、吻合口狭窄、肺部感染、心律失常、胃食管反流及喉返神经损伤等。
两组患者术后预防性放疗并发症情况,不良反应采用RTOG(Radiation Therapy Oncology Group)急性放射损伤分级标准进行评价。
1.6 统计学方法
采用SPSS 22.0 统计学软件对数据进行分析。正态分布资料用表示,计量资料均数比较采用t检验,计数资料比较采用χ2检验及Fisher’s 精确检验,偏态资料以中位数M(P25~P75)描述,两组间比较为Mann-WhitenyU检验。P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料比较
两组患者在年龄、性别、饮酒史、吸烟史、肿瘤部位、T分期、N分期及术前并发症方面差异均无统计学意义(P>0.05;表1)。

表1 两组患者一般临床特征Table 1 General clinical characteristics of the patients in both groups [n(%)]
2.2 围手术期资料比较
胸骨后路径组在手术时间、术中出血量及术后住院时间方面与后纵隔路径组差异无统计学意义(P=0.396;P=0.466;P=0.471;表2)。在术后3 天引流量方面,胸骨后路径组较后纵隔路径组更少,但差异无统计学意义[600(445,1 030)vs.780(650,880),P=0.068;表2]。胸骨后路径组在术后置胸管及胃管方面与后纵隔路径组差异无统计学意义(P=0.234;P=0.560;表2)。胸骨后路径组在术后置颈部引流管时间较后纵隔路径组更少,但差异无统计学意义(P=0.128;表2)。
表2 两组患者围手术期比较Table 2 Perioperative comparison between the two groups [,M(P25,P75)]
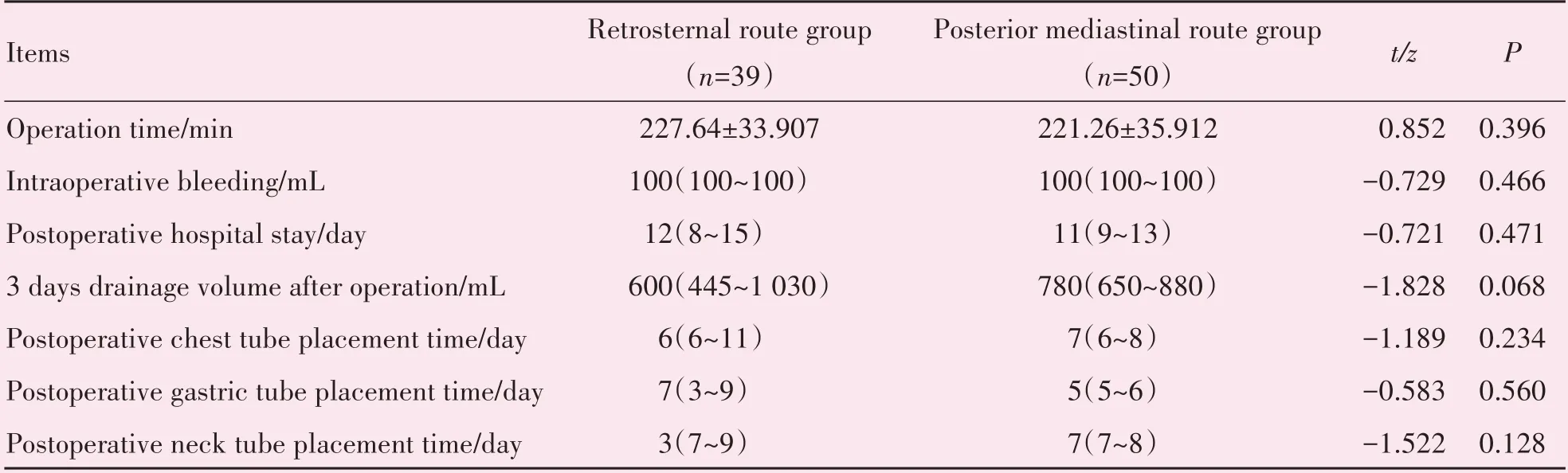
表2 两组患者围手术期比较Table 2 Perioperative comparison between the two groups [,M(P25,P75)]
2.3 术后一般并发症
胸骨后路径组较后纵隔路径组在吻合口瘘及吻合口狭窄发生率方面差异无统计学意义,但胸骨后路径组发生率更高(15.4%vs.6.0%,P=0.172;17.9%vs.6.0%,P=0.098;表3)。胸骨后路径组的肺部感染发生率较后纵隔路径组更低,差异无统计学意义(7.7%vs.14.0%,P=0.503;表3)。胸骨后路径组较后纵隔路径组在胃食管反流发生率方面差异有统计学意义,胸骨后路径组发生率更低(5.2%vs.24.0%,P=0.019;表3)。

表3 两组患者手术情况与术后并发症情况Table 3 Surgery and postoperative complications in both groups [n(%)]
2.4 术后放疗并发症
全组89例患者,行新辅助放化疗12例,行术后辅助放疗30例(其中胸骨后路径组10例,后纵隔路径组20例),根据RTOG急性放射损伤分级标准,胸骨后路径组有1 例患者出现急性放射性食管(胃)炎,为1级;2例患者出现急性放射性肺炎,其中1、2级分别为1 例、1 例。后纵隔路径组有6 例患者出现急性放射性食管(胃)炎,其中1、2级分别为2例、4 例;1 例患者出现急性放射性肺炎,其中1、2 级分别为1 例、0 例。全组发生吻合口瘘者共9 例,术后均未行放疗(表4)。

表4 两组患者术后辅助放疗并发症情况Table 4 Complications of postoperative adjuvant radiotherapy in both groups [n(%)]
3 讨论
食管癌作为最常见的消化道恶性肿瘤之一,其目前治疗方法仍然是以外科手术为主的综合治疗。随着腔镜技术的进步,越来越多的手术方式出现在临床上且逐渐成熟,目前食管癌最主要的外科手术方式为微创Mckeown食管癌切除术,其手术中管状胃建立后上提方式主要有两种。后纵隔路径与胸骨后路径。目前仍然是以后纵隔路径为主。本研究通过比较管状胃经后纵隔路径与胸骨后路径两种不同上提方式发现,胸骨后路径在手术效果安全性及近期并发症方面与后纵隔路径无明显差异,但胸骨后路径食管癌患者术后胃食管反流发生率更低,差异有统计学意义。
本研究结果显示,后纵隔路径组与胸骨后路径组在手术时间及术中出血量方面无明显差异。另外,两组患者术后住院时间及术后3 天引流量方面无明显差异。通过近期疗效结果显示两组患者在手术效果及安全性方面无明显差异。朱孝中等[10]通过回顾性分析76 例行胸腔镜食管癌根治术的食管癌患者病历资料发现,胸骨后路径组在手术时间、术中出血量及术后总引流量方面与后纵隔路径组无明显差异。Lv 等[11]通过回顾性分析63例食管癌患者行胸骨后路径与后纵隔路径组食管癌切除术病历资料发现,两组在术中出血量、手术时间及术后住院时间等方面差异无统计学意义。经胸骨后路径管状胃上提有以下几个优点:第一,在上提管状胃的过程中,手术医师可直视管状胃上提全过程,使管状胃受到不必要的额外损伤。第二,为患者术后行放射性治疗提供空间,降低后纵隔复发机率。另外减少放射性治疗对管状胃的损伤,降低放射性胃炎的发病率。第三,管状胃经胸骨后路径术后出现吻合口瘘易于处理,一般无胸腔感染症状。
本研究通过对后纵隔路径组与胸骨后路径组术后并发症分析发现,两组患者在术后吻合口瘘及吻合口狭窄方面差异无统计学差异。但是,胸骨后路径组术后吻合口发生率与吻合口狭窄发生率较后纵隔路径组高。姜睿[12]通过回顾性分析食管癌患者行食管癌切除术管状胃经胸骨后路径与经后纵隔路径上提病历资料研究发现,两组患者在术后吻合口瘘及术后吻合口狭窄方面无明显差异。Wang 等[13]通过对比28 例行管状胃经胸骨后路径上提及31 例行管状胃经后纵隔路径上提的食管癌患者病历资料发现,经胸骨后路径组患者在吻合口漏、吻合口狭窄发生率方面较经后纵隔路径组差异无统计学意义。胸骨后路径组术后吻合口瘘及吻合口狭窄患者多于后纵隔路径组患者,原因有以下几点:第一,管状胃经胸骨后路径上提可能会向后压迫心包,影响吻合口周边血液循环及供氧从而导致吻合口瘘的发生。第二,由于经胸骨后路径其路径是由手术医师通过解剖组织而来,其孔径周围组织及胸骨柄向前对管状胃的压力使吻合口血供减少造成吻合口缺血从而造成吻合口瘘的形成。第三,管状胃经胸骨后路径吻合口位置相对后纵隔路径更浅,缺少相关组织及肌肉的保护。另外,患者术后咳嗽等使胸腔压力增加的行为会对吻合口产生较大的压迫性从而使吻合口发生吻合口瘘。另外Inoue等[14]研究发现,胸骨-气管距离是胸骨后路径吻合口瘘的独立危险因素,胸骨-气管距离<13mm者应避免管状胃上提行胸骨后路径。本研究吻合口瘘发生率胸骨后路径组虽高于后纵隔路径组,差异没有统计学意义,但胸骨后路径组吻合口发生率要低于其他文献报道的吻合口瘘发生率,因为我们对手术方式做了以下改进:第一,管状胃尽量做长做细,直径控制在3 cm 以内,这样可以保证吻合口无张力。第二,胸骨入口尽量扩大,左颈部肌群彻底切开,周围纤维组织切开,保证入口周围组织对管状胃卡压减少,改善管状胃血供。
本研究发现,管状胃经胸骨后路径上提在胃食管反流发生率方面较管状胃经后纵隔路径上提更低,差异有统计学意义。另外,胸骨后路径组较后纵隔路径组在术后肺部感染发生率方面更低,但无统计学意义。张晓彬等[15]通过对144 例行管状胃经胸骨后或后纵隔两种不同上提路径对三切口食管鳞状细胞癌切除术患者分析发现,经胸骨后路径和后纵隔路径上提管状胃对于三切口食管鳞癌切除术均是安全可行的,经胸骨后路径会增加早期吻合口瘘发生的几率,并带来更多的吻合口狭窄率,但相对后纵隔组可降低患者术后反流症状发生。王兴邦等[16]通过对60 例食管癌患者的随机对照试验发现,后纵隔路径组患者术后反酸烧心发生率显著高于胸骨后路径组。另外,Lv 等[11]研究也发现后纵隔路径组较胸骨后路径组肺部感染及术后胃食管反流发生率更高。造成这种现象原因有以下几点:第一,管状胃经胸骨后路径上提,管状胃与腹腔会形成一个自然的斜坡,而后纵隔路径由于没有此斜坡的存在因此患者更容易发生胃食管反流的情况。第二,胸骨后路径胸骨对管状胃的压迫作用及管状胃随双侧胸膜呼吸运动,加速胃蠕动从而减少胃食管反流症状。第三,管状胃经后纵隔路径上提由于其本身位于胸腔内,患者术后咳嗽等造成胸腔压力改变及双肺活动对管状胃造成压迫,使管状胃内胃酸等消化液反流,严重时会造成吸入性肺炎,特别当患者进食后,管状胃处于充盈状态更加容易造成上述现象。
根据本研究接受术后辅助放疗患者的数据,两组放射性胃炎发生率及严重程度无统计学差异,其原因可能源于较小的样本量。从理论分析,术后辅助放疗主要照射范围为双侧锁骨上、上中纵隔及上中食管旁淋巴引流区;胸骨后路径将管胃远离照射范围,故其放射性胃炎发生率与严重程度应当较低。鉴于本研究严格把握术后放疗适应症(pT3-4N+),故术后接受放疗患者例数较少,未能进行有效统计学分析,今后还需进一步增加样本量。通过检索文献,尚未有胸骨后路径联合术后放疗的研究见诸报道,此为本研究一创新点。另外,对于环周切缘阳性的患者,胸骨后路径还能够方便放疗针对瘤床区加以高量,或对降低局部复发有所裨益。
综上所述,微创Mckeown 食管癌切除术管状胃经胸骨后路径与经后纵隔路径的近期疗效及安全性一致。但经统计学数据分析可以得出经胸骨后路径术后胃食管反流发生率更低。与此同时本研究发现,经胸骨后路径组术后放疗并发症较后纵隔路径组减少,但由于受限于术后放疗的病例数量,因此经相关统计学分析数据结果未发现明显差异。结合临床经验笔者认为,肿瘤分期偏晚且术后需辅助放疗、高龄且合并COPD 等基础性疾病的患者可优先考虑选择管状胃经胸骨后路径上提。但本研究是单中心回顾性研究,存在一定的病例选择性偏倚,其结果应有更大样本量的前瞻性对照研究进一步证实。

