二甲双胍通过增强M146L细胞IDE表达促进胞内Aβ降解
谢婷,徐采利,唐姣玲,郭开华
(中山大学中山医学院解剖生理学系,人体解剖学教研室,广东广州 510080)
阿尔兹海默症(Alzheimer’s disease,AD)是最常见的衰老相关神经退行性疾病,淀粉样蛋白-β(amyloid beta,Aβ)是AD 最重要的病理标志物之一。除了淀粉样斑块,AD 还呈现相关代谢紊乱的特征[1],代谢性疾病Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)和AD 之间有着多重联系[2-3]。二甲双胍(metformin,Met)是治疗T2DM 的一线药物[4],主要通过增加外周组织的胰岛素敏感性达到降血糖效果。而目前Met是否能用于AD 治疗值得关注也尚存争议。临床研究报道长期Met 治疗可导致老年人认知及脑小血管病(cerebral small vessel disease,CSVD)改善[5-6]。然而,也有研究显示Met 治疗不会改善T2DM 高危人群的认知功能[7]。有研究报道,在db∕db 小鼠[8]及SAMP8 小鼠[9]中,Met 治疗可降低Aβ 水平及改善认知能力,然而具体机制尚不清楚。Aβ 的表达水平取决于Aβ 产生和清除的动态平衡[10],Aβ 来源于淀粉样蛋白前体(amyloid precursor protein,APP)的非淀粉样蛋白切割途径,β分泌酶是此途径的关键酶,BACE1(beta-site amyloid precursor protein cleaving enzyme 1)被认为是主要的β 分泌酶[11]。细胞中异常聚集蛋白的清除主要与蛋白酶体降解途径和自噬-溶酶体降解途径有关,蛋白酶体降解途径中的各种Aβ 降解酶(Aβ-degrading proteases,AβDPs)以单独或协同作用的方式,对调节脑内Aβ 水平具有重要影响[12-14]。此外,有研究报道称低剂量的Met 通过激活葡萄糖敏感途径(lysosomal glucose-sensing pathway)调节葡萄糖水平[15]。而胰岛素降解酶(Insulin-degrading enzyme,IDE)是葡萄糖代谢的关键分子[16],也是最重要的AβDPs 之一,在细胞外和细胞内Aβ 降解中都发挥重要作用[17]。值得注意地是,最近有研究显示,在APP∕PS1 小鼠小鼠模型中,Met能减弱Aβ 病理及认知障碍,提高IDE 水平[18],但尚未明确IDE 在此通路中的作用。因此,我们假设IDE 是Met 调节Aβ 蛋白水平改变的潜在机制。本研究采用AD 细胞模型M146L 细胞系[19-20],通过药理学干预等策略探索Met 对胞内Aβ 异常积累的影响及其潜在机制。
1 材料与方法
1.1 细胞系和细胞培养
中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO)细胞购于中国科学院昆明细胞库,M146L细胞购于上海谷研实业有限公司,该细胞系是将突变型PS1基因转入过表达APP的CHO细胞,能稳定分泌Aβ[21]。实验伦理批号:SYSU-IACUC-2019-B989。细胞培养液:F12-DMEM(C11330500 BT,Gibco)添加10 g∕L 的胎牛血清(Thermo Fisher Scientific,USA)以及青链霉素(青霉素100 U∕mL,链霉素0.1 mg∕mL)(15140-122,Gibco),细胞培养于37 ℃,体积分数5% CO2的恒温培养箱。培养液添加200µg∕mL 的G418(A1720-1G Sigma-Aldrich)用于M146L的筛选及培养。
1.2 MTT实验
细胞种板于96 孔板,放入37 ℃,5% CO2的恒温培养箱。细胞贴壁后,弃旧培养液,每孔加入10µL MTT 溶液(5 mg∕mL)及100 µL 新鲜培养液,37 ℃,5% CO2继续培养4 h。弃旧培养液,每孔加入110 µL DMSO,慢摇10 min 以溶解MTT 结晶甲臜,随后采用酶标仪检测490 nm的吸光度。
1.3 蛋白免疫印迹
用蛋白提取试剂盒(贝博,中国)提取蛋白,BCA 定量试剂盒(碧云天,中国)检测以及配平蛋白浓度后,加入SDS 蛋白上样缓冲液煮沸5 min 使蛋白变性。SDS-PAGE 凝胶电泳,保证每条泳道上样量均为10 µL,PVDF 膜湿法转膜。5%BSA 室温封闭2 h,一抗4 ℃孵育过夜。抗体浓度分别为βactin(1:1 000,4970S,CST,USA),APP(1:1 000,2452,CST,USA);Aβ1-42(1:500,bs-0107R,Bioss Antibodies,China);IDE(1:1 000,ab32216,Abcam,USA);NEP(1:100,sc-46656,SANTA,USA);轻链蛋白3(light chain 3,LC3)(1:1 000,ET1701-65,HUABIO,China);BACE(1:1 000,CST,USA)。漂洗后相应二抗室温孵育2 h。洗膜后加入ECL 发光液显色曝光,用GE AI600 成像系统(GE,USA)显色拍照,Image J 软件进行灰度值分析。
1.4 细胞免疫荧光
用激光共聚焦皿培养细胞(801002,NEST,USA),汇合度为60%时培养液换成加入或不加入Met 的F12-DMEM 继续培养24 h。随后弃培养液,PBS 洗3 次,每次5 min。多聚甲醛固定15 min。PBS 洗3 次,每次5 min。随后加入1%BSA 及0.25%Triton X-100(Sigma)室温孵育1 h后,加入一抗4 ℃过夜,漂洗后加入相应二抗iFluor™594 Conjugated Goat anti-rabbit IgG Goat Polyclonal Antibody(1:500,HA1122,HUABIO,China)及Hoechst 33258(1:1 000,H3570,Enzo Life Sciences)室温孵育2 h。一抗是Aβ1-42(bs-0107R,Bioss Antibodies)和IDE(ab32216,Abcam)。滴加抗荧光萃灭封片剂后存放于4 ℃或-20 ℃。在激光共聚焦显微镜(LSM780;Carl Zeiss)下观察摄片。
1.5 统计学分析
统计学分析用Graph pad Prism 9.0 进行,数据来自至少3 次独立实验,并用均数±标准差表示。所有定量数据经过正态性检验和方差齐性检验确认为服从正态分布且方差齐后,采用单因素方差分析(One Way ANOVA),方差分析差异有统计学意义时采用Bonferroni 法进行两两比较,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度Met 对CHO 和M146L 细胞活力的影响
为了确定Met 的最佳使用浓度,我们进行了MTT 实验,通过测定吸光度间接反应活细胞数量及细胞活力。对CHO 细胞和M146L 细胞分别设置Met 的浓度梯度为0 µmol∕L(对照组)、25 µmol∕L、50µmol∕L、100µmol∕L、200µmol∕L,培养24 h后,检测细胞活力。结果如图1 所示,经单因素方差分析,CHO 细胞(F=1.067,P=0.407)及M146L 细胞(F=2.166,P=0.123)组间差异均无统计学意义。因此,在0~200µmol∕L 浓度范围内,Met 处理24 h 后,CHO 细胞和M146L 细胞的细胞活性都没有显著改变。同时,在Met 浓度为50 µmol∕L 时两种细胞的细胞活力均较高,因此后续实验Met 的处理浓度均设置为50µmol∕L。

图1 不同浓度Met 对CHO和M146L 细胞活力的影响Fig.1 The effects of Met on cell viability of CHO and M146L cells
2.2 Met诱导M146L细胞Aβ42水平降低
检测Met 对细胞内Aβ42表达水平的影响。结果如图2 Western blotting 所示,经单因素方差分析,3组间差异有统计学意义(F=11.880,P=0.006);采用Bonferroni 法作两两比较,发现M146L 细胞组与CHO 对照组比较差异有统计学意义(P=0.021),同时,Met 处理24 h 的M146L 细胞组与M146L 细胞组比较差异有统计学意义(P=0.009)。为了直观显示Met 处理对Aβ42水平的影响,用Aβ42以及细胞核的特异性抗体进行免疫染色,并在共聚焦显微镜下进行观察(图3A),同时进行半定量统计(图3B)。经单因素方差分析,3 组间差异有统计学意义(F=10.620,P=0.011);采用Bonferroni 法作两两比较,发现M146L 细胞组与CHO 对照组比较差异无统计学意义(P=0.108),Met 处理24 h 的M146L 细胞组与M146L 细胞组比较差异有统计学意义(P=0.011)。因此,免疫荧光结果表明,Met 处理24 h后,M146L细胞内Aβ42水平明显降低。

图2 Met 诱导M146L 细胞内Aβ42 水平降低Fig.2 Met treatment induced Aβ42 degradation in M146L cells

图3 免疫荧光结果显示Met 诱导M146L 细胞内Aβ42 水平降低Fig.3 Immunofluorescence staining showing Met treatment degraded Aβ42 deposition in M146L cells
2.3 Met 诱导M146L 细胞Aβ42水平降低与Aβ42产生途径无关
APP 和BACE 是与Aβ 产生相关的蛋白,为了探究Met 处理下调细胞内Aβ42表达的机制,我们首先检测50 µmol∕L Met 处理24 h 后CHO 细胞及M146L 细胞中APP 和BACE 的蛋白表达水平。Western blotting 结果如图4 所示:经单因素方差分析,BACE 蛋白3 组间差异有统计学意义(F=6.957,P=0.027);采用Bonferroni 法作两两比较,发现M146L 细胞组与CHO 对照组比较差异有统计学意义(P=0.043),Met 处理24 h 的M146L 细胞组与M146L 细胞组比较差异无统计学意义(P>0.999)。APP 蛋白3 组间差异无统计学意义(F=4.030,P=0.056)。因此,在加入50 µmol∕L Met 处理24 h 后,M146L细胞的APP、BACE表达量无明显变化。
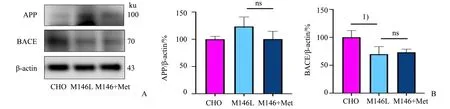
图4 Met处理对APP、BACE蛋白表达的影响Fig.4 Effect of Met treatment on the expression of APP and BACE
2.4 Met 诱导M146L 细胞Aβ42水平降低与IDE 表达增强有关
我们接着检测了Aβ降解相关蛋白在细胞内表达量的变化,Western blotting 结果如图5所示:经单因素方差分析,IDE 蛋白3 组间差异有统计学意义(F=8.071,P=0.020);采用Bonferroni 法作两两比较,发现M146L 细胞组与CHO 对照组比较差异有统计学意义(P=0.035),同时,Met 处理24 h 的M146L 细胞组与M146L 细胞组比较差异有统计学意义(P=0.045)。脑啡肽酶(neprilysin,NEP)蛋白3组间差异有统计学意义(F=14.130,P=0.005);采用Bonferroni 法作两两比较,发现M146L 细胞组与CHO对照组比较差异有统计学意义(P=0.008),Met处理24 h 的M146L 细胞组与M146L 细胞组比较差异无统计学意义(P>0.999)。LC3Ⅱ∕Ⅰ蛋白3组间差异有统计学意义(F=8.753,P=0.017);采用Bonferroni法作两两比较,发现M146L细胞组与CHO对照组比较差异有统计学意义(P=0.049),Met 处理24 h 的M146L 细胞组与M146L 细胞组比较差异无统计学意义(P>0.999)。因此,M146L 细胞内的IDE、NEP 及LC3Ⅱ∕Ⅰ水平明显低于CHO 细胞,且只有IDE 蛋白水平在Met 处理24 h 后有显著提高(图5)。为了直观地观察Met 处理对IDE 水平的变化,进行了免疫荧光实验。用IDE 以及细胞核的特异性抗体进行免疫染色,并在共聚焦显微镜下进行观察。免疫荧光结果如图6 所示,对半定量统计结果行单因素方差分析,3 组间IDE 蛋白水平差异有统计学意义(F=10.430,P=0.011);Bonferroni 法作两两比较,发现M146L 细胞组与CHO 对照组比较差异有统计学意义(P=0.014),同时,Met 处理24 h的M146L 细胞组与M146L 细胞组比较差异有统计学意义(P=0.045)。因此,免疫荧光显示IDE 蛋白表达量的变化与Western blotting 结果一致,提示IDE可能参与Met对细胞内Aβ42蛋白水平的调节。
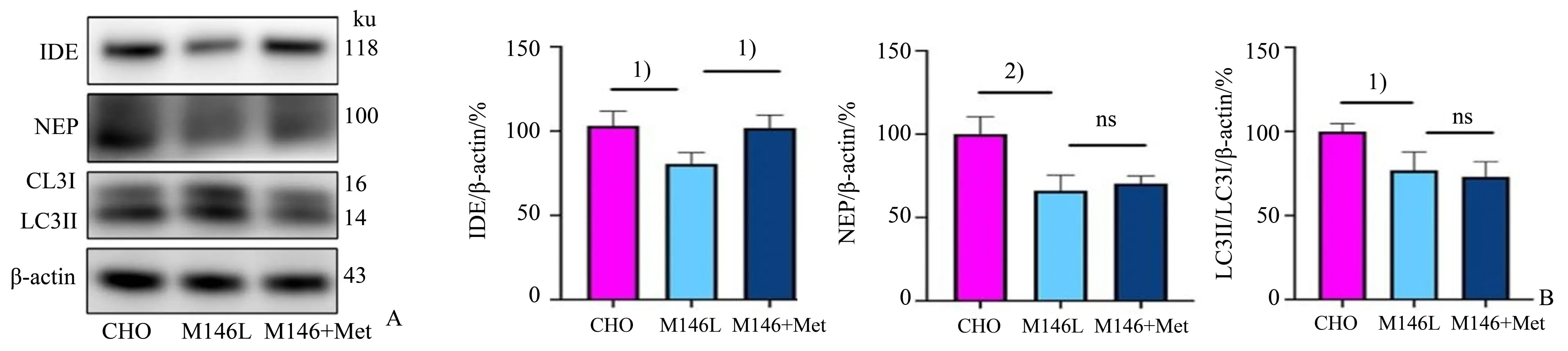
图5 Met 处理对Aβ42降解相关蛋白的影响Fig.5 Effect of Met treatment on the expression of proteins degrading Aβ42
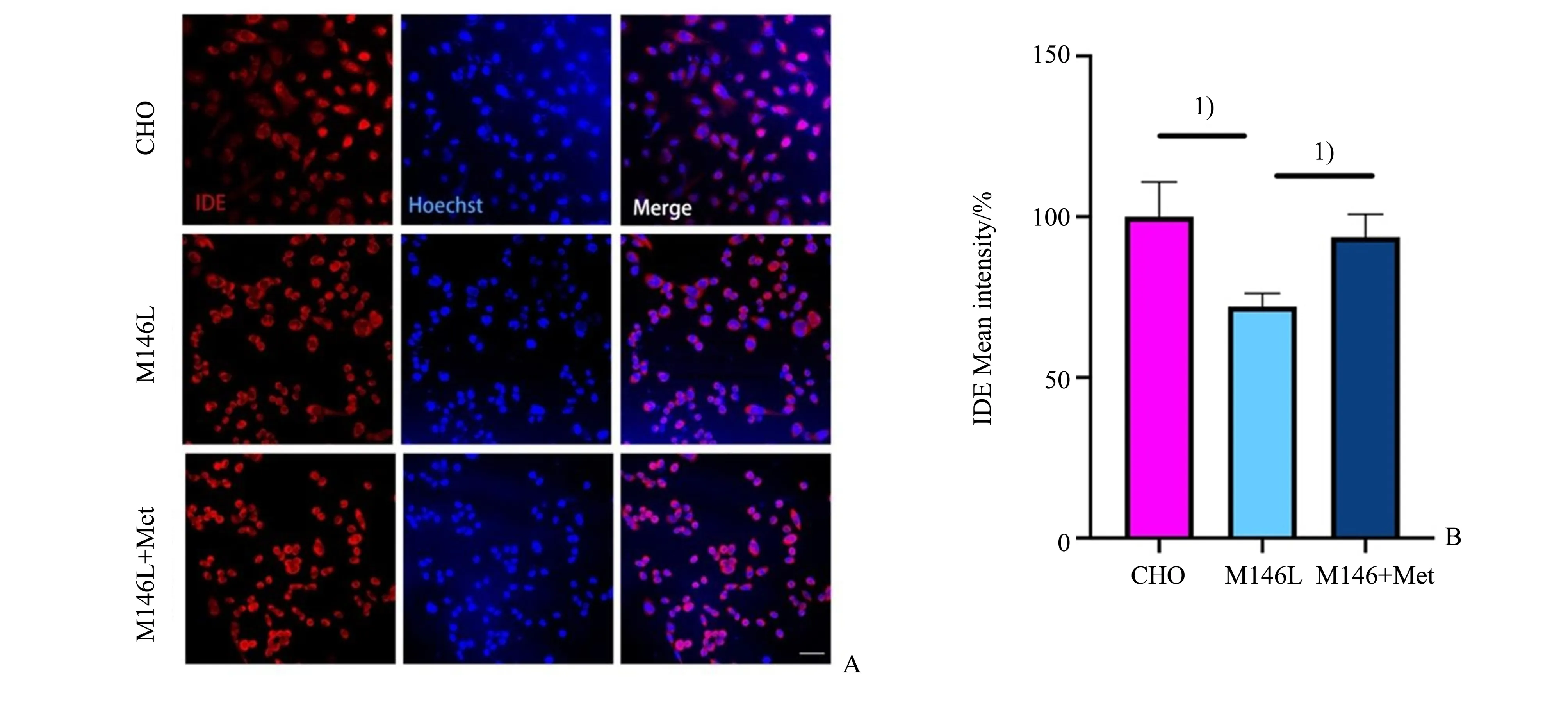
图6 免疫荧光显示Met增强M146L细胞IDE表达Fig.6 Immunofluorescence staining shows Met treatment promoted IDE protein level in M146L cells
2.5 抑制IDE 表达将逆转Met 对Aβ42 的降解作用
为了进一步验证Met 对M146L 细胞的保护作用是通过IDE 介导的,我们采用IDE 的特异性抑制剂杆菌肽(Bacitracin,Bac),探究在IDE 的表达受到抑制后,Met 对Aβ42的降解作用是否会被逆转。Western Blotting 结果显示(图7),对半定量结果进行单因素方差分析,IDE 蛋白3 组间差异有统计学意义(F=22.750,P=0.002);采用Bonferroni 法作两两比较,发现M146L 细胞组与M146L 细胞经Met处理24 h组比较差异有统计学意义(P=0.034),同时,M146L细胞经Met处理24h组与M146L细胞经Met、Bac 联合处理24 h 组比较差异有统计学意义(P=0.002)。Aβ42蛋白3 组间差异有统计学意义(F=9.677,P=0.013);采用Bonferroni 法作两两比较,发现M146L 细胞组与M146L 细胞经Met 处理24 h组比较差异有统计学意义(P=0.029),同时,M146L细胞经Met处理24 h组与M146L细胞经Met、Bac联合处理24 h 组比较差异有统计学意义(P=0.025)。因此,与Met处理组相比,50µmol∕L Met及20µmol∕L Bac 联合处理M146L 细胞24 h 后,M146L 细胞中的IDE表达水平下调,即20µmol∕L Bac可以有效降低IDE 蛋白表达。Met 和Bac 联合处理24 h 后,M146L 细胞中的Aβ42水平明显升高,因此,抑制IDE 表达将逆转Met对Aβ42的降解作用。以上结果表明,Met 对M146L 细胞Aβ42的降解作用是通过IDE介导的。

图7 抑制IDE 表达将逆转Met 对Aβ42 的降解作用Fig.7 Inhibition of IDE reverses Met-induced Aβ42 degradation
3 讨论
目前临床使用的AD治疗药物只能起到减缓症状的作用,无法阻止或延缓病情进展。因此,寻找和开发AD 治疗药物具有重要临床价值。考虑到AD 的发病与代谢紊乱具有一定联系。于是,将临床糖尿病治疗药物用于AD治疗或许是一个可以尝试的思路。为此我们选择T2DM 的一线临床用药Met 作为治疗药物[22],同时将M146L 细胞作为AD模型组。我们尝试探究Met 是否促进M146L 细胞Aβ 降解并初步探讨潜在机制。在本研究中,我们在AD 细胞模型M146L 细胞系中确认了Met能够降低胞内Aβ42水平,这种影响依赖于Met 上调Aβ 降解酶IDE 水平,而与Aβ 产生途径的APP,BACE 及Aβ降解途径的NEP及LC3Ⅱ∕Ⅰ无关。
在Farr[9]等的研究中,Met能改善AD模型SAMP8小鼠的学习和记忆能力,这种改善与APPc99和pTau404的降低有关。同时,Met能降低Aβ1-40水平,以及增加PKC,pGSK-3β ser9 水平。在Ou[23]等的研究中,Met 通过AMPK∕mTOR∕S6K∕Bace1 和AMPK∕P65 NF-κB 信号通路促进神经发生和抗炎,从而减少APP∕PS1 小鼠的Aβ 斑块沉积以及改善学习记忆损害。然而,也有报道称单独使用Met 治疗上调BACE 水平,从而增加原代皮质神经元和N2a695神经元中Aβ 的合成,但联合使用胰岛素和Met可以使Aβ水平降低[24]。
众所周知,Aβ是AD的主要病理标志物。有研究表明,相对于细胞外Aβ,神经元内Aβ 的积累是AD 进展中的早期事件[25],随着细胞外斑块的积累,神经元内Aβ 水平降低[26]。因此,本研究假设细胞内Aβ42是AD 在病理进程中较早出现的标志物,检测的指标是细胞内的Aβ42表达量。APP 分别经β 分泌酶和γ 分泌酶的剪切是Aβ 产生的主要来源[25],AβDPs 介导的蛋白降解以及自噬溶酶体途径是Aβ清除的重要途径,Aβ来源与清除之间的动态平衡决定了体内Aβ的水平[10]。本研究结果显示在Met 处理24 h 后APP 和BACE 均没有显著变化。考虑到BACE 与APP 都是与Aβ 产生相关的关键蛋白,由此可以推断:Met处理后Aβ的减少主要与Aβ的清除增多相关,而非Aβ的产生减少。
在Aβ 的清除机制中,AβDPs 及自噬溶酶体途径发挥了重要作用。有研究报道在AD的小鼠模型中,Met通过激活分子伴侣介导的自噬(Chaperonemediated autophagy,CMA),进而激活TAK1-IKKα∕β 信号通路,减少APP∕PS1 小鼠大脑内Aβ 斑块积累,改善AD 行为障碍[27]。因此,我们检测了IDE、NEP 这两种主要的AβDPs 以及检测LC3Ⅱ∕Ⅰ以判断自噬流的活化情况。结果提示Met 对Aβ42的清除作用可能依赖于IDE 表达增强,而不依赖自噬途径。
在Lu 等[18]的研究中,Met 能减轻氧化应激水平,降低APP∕PS1小鼠大脑中的Aβ水平,改善APP∕PS1 小鼠的学习和记忆损害,同时,Met 使p-AMPK以及IDE 的水平升高,但不影响BACE1、PS1 等分泌酶的水平,提示Met 作为AD 治疗药物具有应用前景。我们的研究在此基础上,采用药理学阻断的策略进一步明确Met 对Aβ 病理的改善是通过IDE介导的。
细胞模型具有干扰因素小、方便等特点,本次研究在AD转基因细胞模型中证实Met对胞内Aβ42的积极作用。我们的研究确认了Met对胞内Aβ42异常积累的改善作用,并且明确了其中的机制是通过IDE介导,提示T2DM药物Met作为AD药物的治疗前景。

