补体系统在葡萄膜炎发病机制中的作用
熊 慧,杨明明,于旭辉
0引言
葡萄膜炎是临床常见的一组可致盲的眼内炎症疾病[1]。感染、自身免疫、创伤及理化损伤、免疫遗传等均可引起葡萄膜炎,但葡萄膜炎的发病机制至今尚未完全阐明。近年越来越多证据表明,葡萄膜炎的发生发展与补体系统的失调相关。因此,探究补体在葡萄膜炎发病机制中的作用非常必要。补体系统是人类先天性免疫防御系统的一部分,其稳定状态受补体调节蛋白的严格调控,当调控失衡时,自身细胞、组织受到破坏, 引发多种炎症反应,进而导致葡萄膜炎的发生[2]。本综述对补体系统在葡萄膜炎发病机制中的进展情况进行阐述。
1补体系统及生物学作用
补体系统由血浆补体成分、可溶性和膜型补体调节蛋白、补体受体等多种蛋白构成,是一个具有精密调控机制的蛋白质反应系统。根据补体系统各成分的生物学功能,可将其分为三类:(1)补体固有成分:指存在于血浆和体液中的参与补体激活的蛋白质,包括C1~C9、甘露糖结合凝集素、相关丝氨酸蛋白酶、B因子、D因子和P因子等;(2)补体调节蛋白:指以可溶性或膜结合形式存在,参与调节补体活化和效应的一类蛋白质分子,包括C1抑制物、I因子、C4结合蛋白、H因子、S蛋白、衰变加速因子(DAF,CD55)、膜辅蛋白(MCP,CD46)等;(3)补体受体:指表达于不同类型的细胞表面,能与补体活性片段结合而介导生物学效应的蛋白,包括CR1~CR5、C3aR、C5aR、C1q-R和CFH-R等[3]。
补体系统通过经典途径、旁路途径和凝集素途径激活,均导致C3转化酶(C3bBb)的形成,进一步裂解C5形成C5b,最后与C6、C7、C8、C9结合形成膜攻击复合物(membrane attack complex,MAC),导致细胞溶解或死亡,促进炎症和组织损伤的发展[3],见图1。在该级联反应中,过敏毒素C3a(C3aR的配体)和C5a(C5aR1和C5aR2的配体)是有效的趋化因子,可募集单核细胞、粒细胞和肥大细胞,诱导平滑肌细胞收缩和血管舒张,嗜中性粒细胞和肥大细胞脱颗粒以及多种免疫细胞分泌细胞因子,从而介导炎症介质的释放[4];调理素C3b、C4b与 C5b可增强吞噬细胞吞噬病原体,协助清除血液中的可溶性抗原抗体复合物。补体系统是机体固有免疫的重要组成部分,参与抗感染免疫、调节炎症反应、处理自身抗原、调控免疫相关基因表达等多重作用[5]。
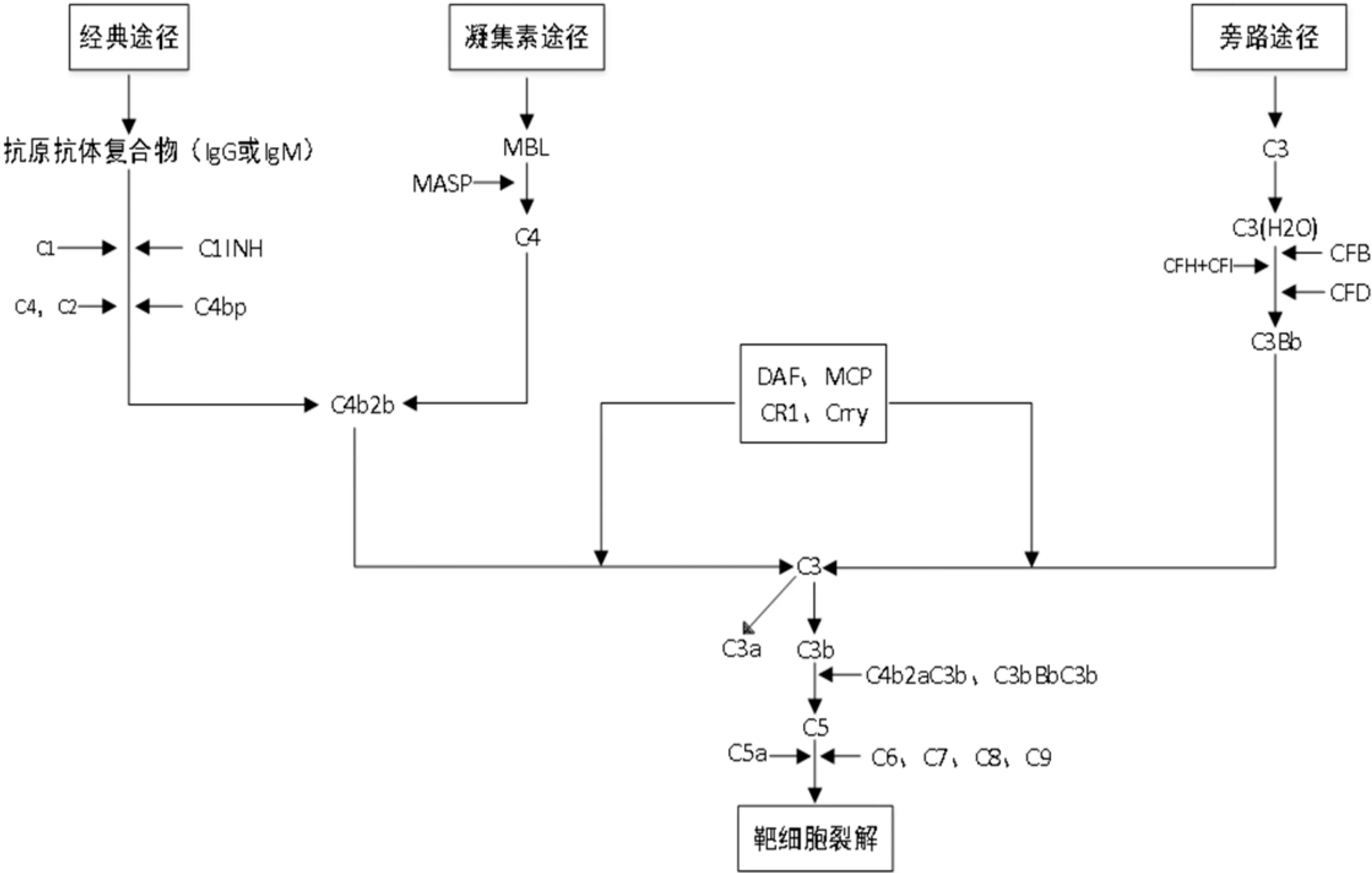
图1 补体激活的3条途径 MASP:甘露糖结合凝集素途径;C3bBbC3b、C4b2aC3b为C5转化酶。
2补体系统与葡萄膜炎的关联分析
2.1补体系统失调导致的炎症反应与免疫失衡参与葡萄膜炎发病补体系统在补体调节蛋白的严格调控下保持平衡稳态以保护机体免受“异己”成分的损伤,当平衡失调时,会介导葡萄膜炎的发展[6-7]。临床研究发现白塞病(Behcet’s disease,BD)患者血浆中的Ba、Bb、C4d和sC5b-9水平升高,BD和小柳原田(Vogt-Koyanagi-Harada,VKH)综合征患者外周血单核细胞C3aR表达增加[8-9]。实验性自身免疫性前葡萄膜炎(experimental autoimmune anterior uveitis,EAAU)的研究也表明,补体系统的激活对EAAU的发生至关重要,相反,宿主补体系统的耗竭可导致EAAU的完全抑制,证实补体系统激活参与了葡萄膜炎的发生[10]。同时遗传学研究表明,补体系统内的多态性可以影响免疫相关疾病的发展,如补体因子H(complement factor H,CFH)、补体因子I(complement factor I,CFI)和补体因子B(complement factor B,CFB)等因子与葡萄膜炎的发生相关[11-13]。综上所述,补体系统与葡萄膜炎息息相关,补体系统调节失衡参与葡萄膜炎的发生和发展。
2.1.1CFH和CFB与葡萄膜炎的关系CFH和CFB是补体旁路调节蛋白,在调节补体旁路途径中发挥重要作用。在补体系统激活过程中,CFB与C3结合形成C3bBb启动下一步级联反应,CFH可与CFB竞争结合C3b,进而使C3b与Bb解离,加速C3bBb的失活,从而抑制旁路途径激活[3]。近年来,CFH和CFB的基因多态性与葡萄膜炎发病的关系越来越成为研究热点。具体机制可能是CFH和CFB蛋白的结构改变会影响其与C3b结合的亲和力,影响旁路途径激活,导致葡萄膜炎的发生[2]。相关研究证实CFH 184G多态性与前葡萄膜炎相关,CFH I62V与非感染性中、后葡萄膜炎相关,呈性别特异性[14-15]。也有研究表明CFH-rs1065489 TT基因型是葡萄膜炎复发率较高的临床标志,与人类白细胞抗原(HLA)-B27有关,CFH的Y402H多态性与后、全葡萄膜炎发病风险增加有关[14,16]。此外,有学者报道CFHR2-rs2986127可作为中国人急性前葡萄膜炎(acute anterior uveitis,AAU)的遗传保护标记[12]。C2和CFB是一对同源基因,位于主要组织相容性复合体(major histocompatibility complex,MHC)的Ⅲ类区域的6p21染色体簇,与感染和自身免疫有关[11]。C2rs3020644位于调控基因表达的启动子处,CFB-rs1048709与AU相关且受HLA-B27状态的影响,也与非感染性中、后葡萄膜炎有关,尤其是VKH综合征[11,17]。以上研究表明补体系统相关基因多态性导致蛋白结构变化,补体系统过度激活驱动炎症反应,在葡萄膜炎发病中起重要作用,不同人群的遗传异质性有待进一步验证。
2.1.2C3和C5与葡萄膜炎的关系C3和C5是联系三种激活途径的枢纽,在血浆中被裂解为C3a和C5a,将炎症细胞募集到补体激活部位,激活补体,消除感染因子[18]。相关研究表明,C3和C5的拷贝数变异和基因多态性影响了葡萄膜炎的发生,Xu等[19-20]研究结果显示C3的高基因拷贝数是BD和VKH综合征的危险因素,C3 rs408290单核苷酸多态性(single nucleotide polymorphism,SNP)与BD的易感性有关,C3 rs408290 GG基因型个体的C3-mRNA表达和细胞因子(包括IL-17和IFN-γ)产生增加;此外,在致病型C5(高拷贝数和rs2269067 GG基因型)中,C5-mRNA和蛋白表达增强,IL-17产生增加,表明C3和C5浓度及蛋白结构的改变打破补体系统的平衡影响葡萄膜炎的进展。最近,有研究[21-22]用实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)模型观察到血浆和房水中C3a和膜攻击复合物C5b-9含量升高,接着他们又发现EAU视网膜C3和C9蛋白水平升高,这种补体差异表达蛋白导致的补体功能失调参与了葡萄膜炎的发病机制。抑制补体激活的药物可以迅速减轻组织炎症反应,为葡萄膜炎的治疗带来新的可能。
2.1.3CFI与葡萄膜炎的关系CFI是一种丝氨酸蛋白酶,在辅助因子存在的情况下抑制补体蛋白C3b和C4b的激活,进而阻止经典与旁路途径中C3bBb的形成,抑制补体级联反应[23-24]。Wang等[25]研究表明,CFI和补体途径的C3级联是AAU发病的重要因素,性别和HLA-B27状态影响CFI等位基因的易感性,且CFI-rs7356506可能降低AAU的发病风险。也有研究发现CFI-rs7356506与VKH综合征的复发情况有关[23]。近年来,Huang等[26]研究证实CFI-rs13104777与AAU的发生有直接关系,遗传影响可能与HLA-B27相关。这些发现均提示CFI通过影响补体经典和旁路途径在葡萄膜炎的发病机制中发挥重要作用,CFI在葡萄膜炎的发病机制中的确切作用,尚需多中心、多种族的研究。
2.1.4CD59和MAC与葡萄膜炎的关系CD59是一种GPI锚定蛋白,存在于大多数有核细胞的膜上,防止C9与C5b-8复合体结合,阻止MAC的形成,在补体级联的终末途径中起重要作用。CD59基因也被证明与一些免疫相关疾病有关。MAC由1个C5b、C6、C7、C8分子和12个C9分子组成,在细胞表面形成跨膜离子通道,释放细胞因子,导致细胞溶解和死亡[3]。AAU是葡萄膜炎中最常见的类型,由免疫介导并受多种内源性因素的影响,Wang等[7]研究首次发现CD59-rs831626可能是HLA-B27阴性队列AAU的遗传保护因子,对AAU的影响可能与HLA-B27和AS状态有关。另外,有学者发现在C9-/-(C9基因敲除)的EAU小鼠中发现视网膜上不能形成MAC,同时伴有NLRP3炎症小体的激活减少,提示MAC可能通过减弱NLRP3炎症小体激活影响葡萄膜炎的发病机制,腺相关病毒(adeno-associated virus,AAV)介导的sCD59表达能有效抑制MAC的沉积,进而抑制NLRP3炎症小体的活化,单次玻璃体腔注射AAVCAGsCD59可有效抑制小鼠EAU的发生,其作为一种潜在的葡萄膜炎基因疗法值得进一步研究[27]。CD59和MAC在葡萄膜炎发病过程中扮演重要角色,更多相关性仍有待我们进一步探索。
2.1.5C1和C4与葡萄膜炎的关系补体成分1r亚组分a(C1ra)是人类C1r的同源物,C1r是一种高水平的特异性丝氨酸蛋白酶,在免疫和炎症反应中诱导经典途径的激活,基于此,Yang等[28]研究首次表明川芎嗪(tetramethylpyrazine,TMP)滴眼液可能通过下调补体系统相关基因(C1ra)在眼部炎症中发挥抗炎作用。C4在自身免疫性疾病中的作用矛盾。虽然大多数缺乏C4的患者(>75%)发展成狼疮样的自身免疫性疾病,其中一些与自身免疫性葡萄膜炎有关,VKH综合症患者中C4拷贝数减少,表明C4具有保护作用,但也有报道称,与对照组相比,活动性BD患者的C4水平显著升高,高C4a拷贝数通过促进C4a和IL-6的表达增加了BD的风险,表明C4具有致病性[23,29-31]。C4在BD与VKH综合征中的作用不同,可能的原因是BD是一种针对微生物抗原的异常反应所介导的自身炎症性疾病,而VKH综合征是一种对黑色素细胞抗原的自身免疫性疾病。C4的作用差异可能与葡萄膜炎复杂的遗传背景和免疫反应失衡有关。
2.2补体系统通过调节T细胞的反应影响葡萄膜炎进展越来越多的证据表明补体系统通过调节适应性免疫系统的T细胞反应影响葡萄膜炎的进展。补体系统对T细胞的调节机制通过磷脂酰肌醇3激酶介导的AKT磷酸化实现:(1)上调T细胞内抗凋亡基因Bcl-2的表达,下调促凋亡分子Fas的表达;(2)激活APC上调表达协同刺激因子CD80(B7-1)和CD86(B7-2),促进产生炎症因子IL-12和IL-23[32]。在葡萄膜炎病程中,抗原诱导致外周交叉反应性T细胞产生,效应T细胞活化穿透血视网膜屏障进入眼内,新抗原释放,积聚到局部淋巴结,自体反应性T细胞随之产生,病情进展。参与葡萄膜炎发病过程的T细胞亚群包括:Th1、Th2、Th17和调节性T细胞(regulatory T cell,Tregs),Th1细胞分泌IL2、干扰素IFN-γ,Th2细胞分泌IL-4、IL-5、IL-6、IL-9、IL13,Th17细胞分泌IL-17A、IL-17F、IL-21、IL-22、TNF-α及粒细胞-巨噬细胞集落刺激因子(granulocyte colony-stimulating factor,GM-CSF),Tregs分泌TGF-β和IL-10[33],各种复杂的细胞因子网络介导自身免疫及炎症反应,细胞之间的相互作用与平衡失衡导致了葡萄膜炎的发生发展。
补体C1、C3和C5对T细胞的调节作用日益受到重视。Schrijver等[34]发现有葡萄膜炎的活动性结核病患者的血清C1q水平比无葡萄膜炎患者高,C1q可以通过降低CD8+T细胞、Th1和Th17细胞的活性,增强Tregs活性来调节T细胞反应,并通过调节1型IFN信号通路增加活动性结核疾病患者葡萄膜炎的发生。有学者报道,C3可以促进T细胞分泌IFN-γ,通过NF-κB活化促进IL-17释放,C3a还可诱导Th17刺激单核细胞产生细胞因子,并促进CD4+T细胞分泌IL-17,抑制IL-10[9,35]。另有实验表明,C5a阻断可通过减少IFN-γ的产生,降低EAU的进展和严重程度[36]。Lajoie等[37]发现C5a通过抑制IL-23的表达,调节Th17的分化和增殖,减少IL-17A的产生。这些研究表明C3、C5可能通过增强IFN-γ和IL-17A的产生参与葡萄膜的发病机制。考虑到补体系统和T细胞的关系,补体抑制剂受到研究者们关注,诺玛科潘(nomacopan)是一种从蜱虫唾液中提取的药物,具有抑制白三烯B4(LTB4)和C5激活的双重功能,显著减少效应Th17细胞和炎性巨噬细胞,对EAU有良好的治疗效果[38]。
过敏性毒素受体C3aR和C5aR作为补体因子直接调节T细胞反应,广受研究者们关注。抗原呈递细胞(antigen-presenting cell,APC)和T细胞都可表达C3aR和C5aR。在APC上,过敏毒素C3a和C5a与C3aR和C5aR结合,促进MHC和共刺激分子的表达,启动级联反应;在T细胞上,C3a和C5a与C3aR和C5aR结合可以抑制T细胞凋亡,促进Th1和Th17效应T细胞分化[18],并抑制Foxp3+T调节细胞的发育[39],导致更严重的T细胞反应。Zhang等[18]对WT和C3aR/C5aR-KO小鼠进行不同的影像学研究和免疫学检测,发现C3aR和C5aR是EAU充分发育和相关Th1和Th17效应反应所必需的重要受体。此外,Wang等[9]研究发现C3aR表达增加可能导致Th17细胞反应过度激活,从而可能参与BD和VKH综合征的发病机制。
C4、MAC等对T细胞的调节作用同样不可小觑。Zhang等[29]通过研究野生型和C4基因敲除(C4-KO)小鼠的EAU发育,发现C4-KO小鼠视网膜炎症减弱,T细胞反应减少及功能受损,证明C4是正常T细胞活化、增殖和存活所必需的,C4通过影响T细胞内在机制调节EAU的发生。Binit等[27]研究发现MAC沉积在EAU视网膜,导致NLRP3炎症小体激活和IL-1β产生,促进Th1和Th17细胞的分化继而诱发葡萄膜炎。综上所述,研究出补体及其受体拮抗剂或阻断补体介导的T细胞反应激活通路的制剂将对葡萄膜炎的治疗有重大意义。
3展望
葡萄膜炎是一种慢性炎症性疾病,其发病和病程多种多样,传统疗法对部分患者很难治愈,给患者带来极大的困扰。与葡萄膜炎有关的补体蛋白贯穿补体激活过程的始终,但补体蛋白在葡萄膜炎发病中的具体机制仍未完全阐明,未来的研究可以着眼于补体蛋白在葡萄膜炎的发病机制、病程变化、信息调控、信号转导、细胞通讯等方面的作用,从而在此基础上找到最佳的治疗靶点。目前C3、C5、CFB、CFH、CFI和CD59抑制剂在干性黄斑变性的临床试验阶段已取得一定成效[40]。Li等[41]研究结果也表明,以VEGF和补体成分为靶点的基因治疗可以为眼部炎症和新生血管疾病提供一种新的、长期的治疗策略。补体抑制疗法和相关基因疗法有望为葡萄膜炎患者的治疗带来新的曙光。

