利用FRET技术检测膜受体与胞外配体相互作用的优化策略
马廷政,曹平平,汪徐春,孙玉洁*
1南京医科大学基础医学院细胞生物学系,2江苏省人类功能基因组学重点实验室,江苏 南京 211166
细胞表面膜受体与其配体相互作用参与调控细胞的增殖、生长、分化等多种生物学过程,并与多种癌症的发生发展密切相关[1-4]。因此,研究膜受体与其胞外配体的相互作用及其动态变化有助于阐明细胞多种生理过程和病理过程的机制。荧光共振能量转移(fluorescence resonance energy transfer,FRET)技术是研究蛋白质相互作用的一种经典方法[5-6],能够精确检测10 nm范围内蛋白间的直接相互作用[7-8]。FRET是指能量从一种受激发的荧光基团转移到另一种荧光基团的物理现象。前者称为供体,后者称为受体。利用荧光供体融合蛋白表达载体和荧光受体融合蛋白表达载体共转染细胞,当目的蛋白间发生相互作用时,使荧光基团间的距离小于10 nm,荧光基团将通过偶极子耦合作用实现能量传递,供体荧光蛋白的能量可部分转移到受体荧光蛋白,使受体被激发而发射荧光。在生物体内,如两个蛋白质分子的距离在10 nm之内,一般认为这两个蛋白质分子存在直接相互作用。因此,通过检测供体和受体荧光强度的变化可观察两种目标蛋白在活细胞中的相互作用及变化。FRET 技术的标准实验流程为,蛋白质三级结构分析、FRET标记策略的选择、荧光对的选择、FRET 效率评估、仪器选择,最后进行FRET 实验的实施[9]。但是,应用FRET 技术研究膜受体与胞外配体的相互作用时存在较多限制因素,其中主要包括膜受体结构对荧光共振能量转移效率的影响、荧光标签对膜受体的亚细胞定位及功能的影响、细胞切除成熟膜受体信号肽时标记在信号肽氨基端的荧光标签会被一同切除等。LRP6 是WNT3A 的经典共受体[10],根据其蛋白质三级结构相互作用模型,WNT3A 蛋白与LRP6 的氨基端都是开放末端,能够使用荧光蛋白进行标记,适用于FRET 技术检测。本研究以LRP6 膜受体与WNT3A 相互作用为模型,针对上述限制因素,通过蛋白截短、调整荧光标签和信号肽的相对位置及增添柔性链接肽等方法,有效提高了FRET 的检测效率和准确性,为利用FRET技术研究膜受体与胞外配体相互作用提供了新的思路和策略。
1 材料和方法
1.1 材料
FV1200 激光扫描共焦显微镜系统(Olympus 公司,日本);DMEM 细胞培养基(Invitrogen Life Tech⁃nologies 公司,美国);Lipofectamine 3000 试剂盒(In⁃vitrogen Life Technologies 公司,美国);胎牛血清(Gibco 公司,美国);anti⁃GFP 抗体(Thermofisher 公司,美国);3.5 cm 玻璃皿(上海WHB 生物技术有限公司);胰蛋白酶(Sigma Chemical 公司,美国);青霉素/链霉素(上海生工生物公司);质粒小提试剂盒(AXYGEN 公司,美国);PCR 试剂(TaKaRa 公司,日本)。
1.2 方法
1.2.1 细胞培养
人肾上皮细胞系293T 所用培养液为DMEM 培养基,并添加10%的胎牛血清、100 U/mL 青霉素、100 μg/mL 链霉素。该细胞传代比例为1∶4,在CO2浓度5%、温度37 ℃的细胞培养箱中进行培养。
1.2.2 质粒构建
将WNT3A 和LRP6 的蛋白编码区(coding se⁃quence,CDS)序列分别克隆到pEYFP⁃C1 或pECFP⁃C1 载体中,构建ECFP⁃LRP6 和EYFP⁃WNT3A 融合蛋白质粒。SP⁃EYFP⁃WNT3A 质粒是以pCDNA3.1为质粒骨架,将EYFP荧光标签插入WNT3A蛋白的信号肽和成熟蛋白之间。SP⁃ECFP⁃LRP6 质粒是以pCDNA3.1 为质粒骨架,将ECFP 荧光标签插入LRP6蛋白的信号肽和成熟蛋白之间(由于FRET 检测要求荧光标签间距离在10 nm范围内。而LRP6成熟蛋白的胞外结构域为棍棒结构,其长度>20 nm,超出FRET实验检测范围。因此,将LRP6成熟蛋白胞外结构域的P1P2 结构域进行截短,保留LRP6 与WNT3A相互作用的P3P4结构域。所有引物序列见表1。所有质粒均经测序确认(上海生工及安徽通用测序公司)。

表1 FRET实验中使用的引物Table 1 Primers used in FRET assays
1.2.3 蛋白质三级结构对接与分析
在PDB 数据库(https://www1.rcsb.org/)中获取LRP6(PDB ID:3S8Z)及WNT3A(PDB ID:7DRT)蛋白的晶体结构文件,下载pdb 格式的蛋白模型数据,用Pymol 软件打开进行后续分析。将需要对接的两个蛋白pdb 格式文件添加到Zdock 网站(https://zdock.umassmed.edu/)中,经对接后可下载蛋白复合物模型文件。在Pymol 软件(https://pymol.org/2/)中打开对接模型文件,分析观察目的蛋白的氨基端与羧基端是否暴露,能否在不影响蛋白质相互作用的前提下进行荧光标签的标记。
1.2.4 FRET实验
根据激光共聚焦显微镜(FV1200激光扫描共焦显微镜,奥林巴斯公司,日本)FRET 实验手册进行了FRET实验的设计与实施。使用敏化荧光发射方法进行FRET 分析。FRET 实验细胞接种在玻璃底培养皿(上海WHB 生物技术有限公司)。质粒通过Lipofectamine 3000(Invitrogen 公司,美国)以50%~70%细胞汇合率转染培养细胞24 h 后进行FRET 分析。根据实验手册调整相关的仪器配置,包括激光功率10%、HV 550 V、电压放大倍数×1、背景补偿0%、图像采集速度2.0 μs/pixel,并使用1 024×1 024的图像格式。ECFP 通道由440 nm 激光器激发,图像采集使用滤波器(SMD510:480/20)。EYFP 通道由488 nm 激光器激发,图像采集使用Mirror:565/50。获取所有图像后,使用FV10⁃ASW软件(奥林巴斯公司,日本)中的敏化荧光发射窗口进行FRET效率及供受体距离的计算。
1.3 统计学方法
使用FV10⁃ASW 4.0 软件进行FRET 效率及供受体距离的统计学计算。采用Graphpad 8.0 软件(https://www.graphpad.com/)进行数据的处理和分析,定量结果表示为平均值±标准误()。
2 结果
2.1 LRP6与WNT3A蛋白质三级结构分析
LRP6膜受体的胞外区由3个结构域组成,依次为P1P2 结构域(PDB ID:5GJE),可结合WNT1、WNT2、WNT6等配体;P3P4结构域(PDB ID:3S8Z),可结合WNT3、WNT3A、DKK1 等配体;LA 结构域(细胞膜锚定结构域)。利用PDB 网站获取蛋白质三级结构,并使用Zdock 数据库进行蛋白对接模型预测显示,LRP6 的P3P4 结构域(PDB ID:3S8Z)与WNT3A(PDB ID:7DRT)的铰链区结合(图1A),并且LRP6 与WNT3A 的氨基端和羧基端都是处于蛋白质外围开放末端,能够连接荧光标签进行FRET实验。LRP6胞外结构域为棍棒状结构,全长>20 nm,超出常规FRET技术10 nm检测范围。因此对LRP6胞外区进行了截短,将LRP6的P1P2结构域截除,保留LRP6的P3P4结构域(LRP6与WNT3A结合区域)与LA结构域。
2.2 FRET荧光融合蛋白的构建与优化
使用经典FRET荧光对ECFP与EYFP作为荧光供受体,分别融合在LRP6 或者WNT3A 蛋白的N 端(图1B)。当两个目的蛋白不存在直接相互作用时,使用440 nm 激发光激发ECFP 荧光标签时不发生FRET,只能使ECFP发出自身476 nm荧光,EYFP不发光;而当2 个目的蛋白存在直接相互作用时,如LRP6 与WNT3A 相互作用,ECFP 与EYFP 之间的距离≤10 nm而发生FRET现象,即440 nm激发光激发ECFP 后,通过FRET 可检测到EYFP 荧光标签发出的527 nm峰荧光(图1A)。

图1 LRP6与WNT3A蛋白相互作用的FRET模式图Figure 1 A diagram FRET pattern of LRP6 and WNT3A interaction
依据PDB与Zdock网站对WNT3A与LRP6的蛋白三级结构分析结果,将构建FRET 荧光融合蛋白荧光标签ECFP及EYFP荧光标签分别融合在LRP6或者WNT3A的氨基端(图2A,上图),利用融合蛋白表达载体转染293T细胞,24 h后进行激光共聚焦显微镜观察,发现LRP6 细胞膜定位不清晰(图2B,上图)。但是,使用pCDNA3.1 作为载体,将ECFP 荧光标签融合在LRP6 蛋白的信号肽与成熟蛋白之间,并使用柔性连接肽进行连接可减少对成熟蛋白结构与功能的影响(图2A,下图)。转染293T 细胞24 h 后进行激光共聚焦显微镜观察显示,LRP6细胞膜定位较为明显(图2B,下图白色箭头指示膜定位)。
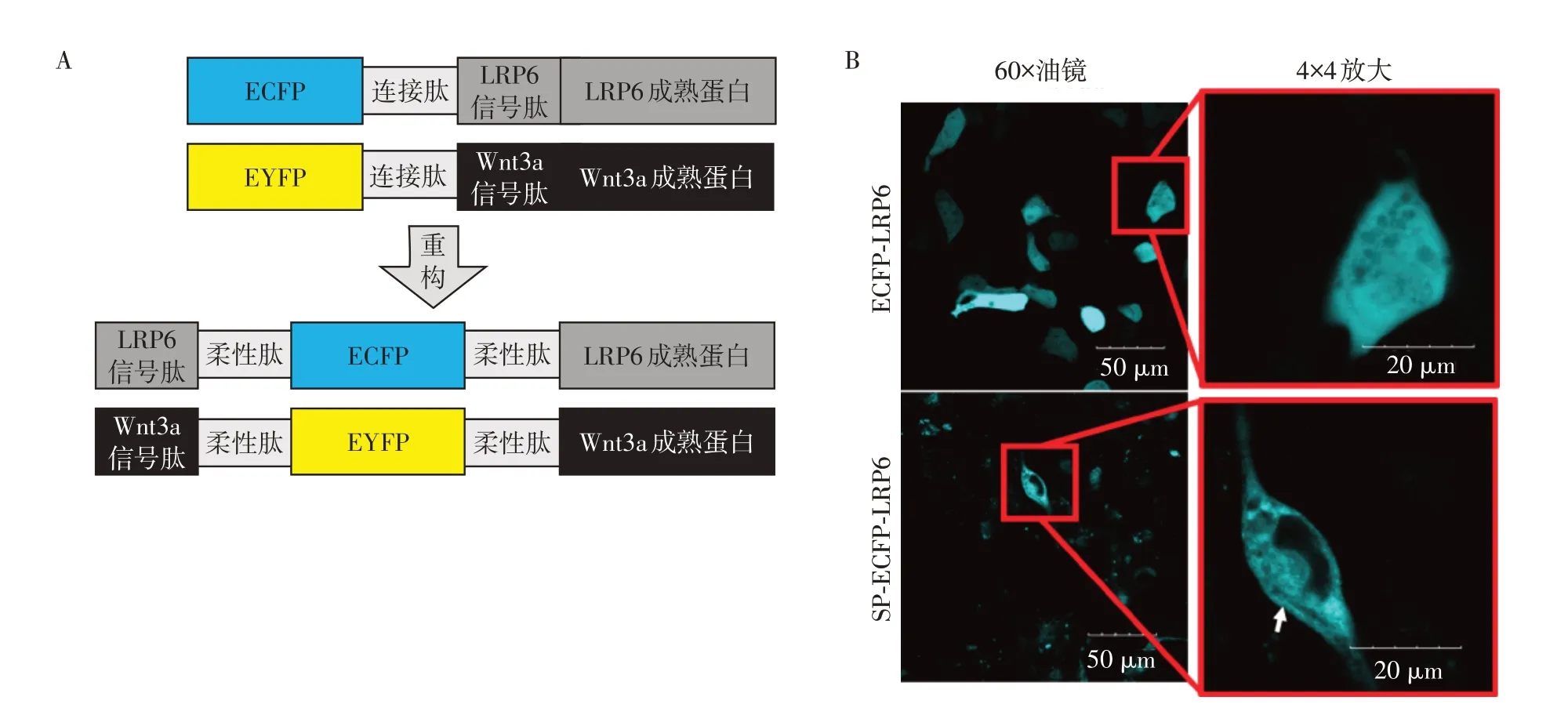
图2 FRET荧光融合蛋白质粒的构建Figure 2 Construction of FRET fluorescent fusion protein
2.3 FRET 技术检测活细胞中LRP6 膜受体与WNT3A的相互作用
使用SP⁃ECFP⁃LRP6 及SP⁃EYFP⁃WNT3A 质粒共转染293T 细胞,24 h 后进行FRET 实验并计算FRET效率及FRET距离(图3)。LRP6⁃ECFP通道显示LRP6 膜定位较为明显;WNT3A⁃EYFP 通道显示WNT3A 与LRP6 相互作用后细胞膜定位也较为显著;经背景校正计算后的FRET(校正)通道显示在细胞膜上LRP6 与WNT3A 有FRET 现象发生;敏化荧光发射FRET计算得到FRET效率图像(FRET Ef⁃ficiency)及供受体距离图像(D⁃A Distance)。红色箭头所指细胞膜区域LRP6 及WNT3A 细胞膜定位较为明显。对细胞膜区域发生FRET 现象的细胞(n=25)进行FRET 效率及距离统计分析,LRP6 与WNT3A平均FRET效率为26.51%,平均供受体距离为7.17 nm,处于FRET 效率(8%~95%)及供受体距离(3~8 nm)的有效区域。该结果显示,通过FRET优化策略,在细胞膜上定量检测到LRP6 膜受体与WNT3A的相互作用。

图3 FRET技术检测WNT3A与LRP6蛋白间的相互作用Figure 3 The interaction between WNT3A and LRP6 protein detected by FRET assays
3 讨论
FRET 技术是研究活细胞中蛋白质相互作用及动态变化的有效手段,为阐明细胞生理过程和病理过程的机制提供了重要帮助。然而,FRET 技术用于检测膜受体与胞外配体相互作用及动态变化时,存在诸多限制因素。首先,经典FRET 技术检测距离要求FRET荧光对的距离在10 nm以内。但是,部分膜受体家族成员的胞外段较长,当受体与其配体在三维结构空间上发生相互作用时,胞外端和配体荧光对的距离大于10 nm(如LRP6 及其配体WNT3A[11]、TNFRSF6B 及其配体TNFSF14[12]等),超出FRET 检测范围,因而不能利用FRET 技术有效检测这一类膜受体和配体间的相互作用。本文针对这一制约因素,以经典的LRP6与其配体WNT3A相互作用模型为基础,提供了一个可能的解决策略。LRP6胞外域全长约为25 nm,当LRP6与WNT3A相互作用时,LRP6 的氨基端与WNT3A 之间的距离约为15 nm。本研究依据LRP6 蛋白三级结构特征,即其胞外域结构为串珠状具有柔性[13]这一特点,将LRP6 膜受体进行截短,截掉P1P2结构域,保留其与WNT3A相互作用的P3P4 结构域。由于结构域之间为柔性连接,截短不影响膜受体与配体的相互作用,同时满足了FRET 技术检测要求。对膜蛋白进行截短时,首先要确定截短对膜蛋白的结构与相互作用不会造成影响。该策略适合检测细胞外有多个结构域的膜受体(如:TNFRSF、LRP 等家族蛋白)与其配体的相互作用;且特别适用于检测有明确相互作用但需要进一步在活细胞水平观察其相互作用动态变化的配体和受体。
其次,膜受体与胞外配体的亚细胞定位由信号肽进行引导,且成熟蛋白的信号肽会被切除[14],导致标记在信号肽氨基端的荧光标签被一同切除。因此,信号肽位置的调整在膜受体与胞外配体相互作用的检测中非常必要,不仅可避免荧光标签被切割,也能够显著增强融合蛋白的膜定位信号。本文通过将信号肽重构在荧光标签的氨基末端,可避免荧光标签的切除。该信号肽重构策略普遍适用于FRET质粒的构建,可避免荧光标签的丢失,增强信号肽的亚细胞定位功能。但是,不同膜受体的信号肽功能多样[15],信号肽重构对于不同膜受体家族的亚细胞定位作用仍需进一步研究。
最后,荧光标签对蛋白质的结构与功能具有一定干扰效应,可影响膜受体与胞外配体的亚细胞定位以及蛋白间相互作用。柔性连接肽在抗体、标签融合蛋白纯化等领域已被广泛应用[14],用于减弱融合蛋白内不同结构域之间的相互影响。与柔性连接肽相比,刚性连接肽可显著降低FRET效率,并且FRET 效率随着刚性连接肽长度的增加而降低[16]。并且,柔性连接肽已应用于生物发光共振能量转移(bioluminescence resonance energy transfer,BRET)实验,用来衔接荧光标签与目的蛋白,可减弱荧光标签对融合蛋白结构与功能的影响[17-18]。基于以上研究,本文采用柔性连接肽来衔接信号肽、荧光标签及成熟蛋白,以降低荧光标签对FRET 体系的影响。柔性连接肽策略同样适用于其他FRET荧光质粒的构建,但也有其局限性,与刚性连接肽相比,不能有效分隔融合蛋白的不同结构域,因此不适用于胞外配体与多结构域膜受体相互作用位点的分析。
综上所述,本文以LRP6 膜蛋白与WNT3A 相互作用为模型,针对FRET 技术在研究膜受体与胞外配体相互作用中的限制因素,建立了有效的改进策略,包括膜受体截短、信号肽的改造及柔性连接肽的使用,为充分利用FRET 技术在活细胞水平研究膜受体与胞外配体相互作用的动态变化提供了新的思路和实验方案。
——一道江苏高考题的奥秘解读和拓展

