TIR/BB环拟似物AS⁃1对小鼠肾缺血再灌注损伤的保护作用研究
刁爱芹,张光际,王 卉,潘爱萍,袁海建,李建涛
1泰州职业技术学院医学技术学院,江苏 泰州 225300;2南京医科大学病理生理学系,江苏 南京 210029
急性肾损伤(acute kidney injury,AKI)是一组以急性肾功能减退为主要表现的临床综合征,具有发病率高、病情凶险、预后差的特点,严重的急性肾损伤会发展为急性肾衰竭,导致肾功能在短时间内急剧减退,肾小球滤过率下降、血肌酐及尿素氮迅速上升,并导致水、电解质及酸碱平衡失调,临床上能采取的治疗措施非常有限,除肾替代治疗外尚缺乏有效的治疗手段[1-2]。肾缺血再灌注(renal ischemia⁃reperfusion,RIR)是引起急性肾损伤的常见原因,当肾部分切除术、肾移植、肾积水等手术恢复供血供氧时,机体启动一系列炎症反应、自由基、氧化应激等刺激因素,使细胞代谢功能障碍及结构破坏更加严重[3-4]。炎症和细胞凋亡是RIR 损伤常见的病理生理过程,一方面肾缺血再灌注损伤发生后能激活TLRs介导的信号通路,激活NF⁃κB介导的炎症反应,促进一系列炎症介质、细胞因子等的表达,导致肾损伤[5];另一方面肾短暂缺血缺氧时凋亡是肾小管上皮细胞主要的死亡模式,缺氧时,细胞内的凋亡信号通路被激活,众多与凋亡相关的基因被诱导表达,而肾小管上皮细胞的调亡可导致肾组织的结构萎缩和肾细胞数目的减少,也能导致并加重肾损伤[5-6]。因此,如何减轻炎症和肾小管上皮细胞凋亡对防治肾缺血再灌注损伤有重要意义。
近年来,研究发现,一种模拟MyD88和IL⁃1R/IL⁃1R 受体同源区域(toll IL⁃1 receptor homology,TIR)BB环状拟似物氢化肉桂基⁃L⁃缬氨酰吡咯烷(hydro⁃cinnmoy⁃L⁃valyl pyrrolidine,AS⁃1)能发挥抗炎作用用于退热[7],并能改善压力负荷诱导的心肌肥大[8]、减轻大鼠心肌缺血再灌注损伤[9],也能保护非酒精性脂肪性肝炎[10],但其在肾缺血再灌注损伤中是否具有保护作用还不清楚。因此,本研究将采用整体小鼠肾缺血再灌注损伤模型,探讨AS⁃1对肾缺血再灌注损伤是否也具有保护作用,如具有保护作用,其作用机制是否与减轻炎症和细胞凋亡相关,以期为临床开发防治急性肾损伤或急性肾衰竭类药物提供理论基础及实验依据。
1 材料和方法
1.1 材料
SPF级8~10周雄性C57BL/6小鼠,体重18~22 g,由南京医科大学实验动物中心提供,将其置于温度(22±2)℃、湿度62%~65%、12 h 光照和黑暗交替的房间中,给予标准食物和水喂养。
1.2 方法
1.2.1 模型建立
所有小鼠术前禁食12 h,自由饮水。用10%水合氯醛(0.4 mL/100 g)腹腔内注射麻醉,待麻醉起效时用手术剪刀剪去腹部鼠毛,然后碘伏消毒,在剑突下约0.5 cm 沿腹正中线切开皮肤和肌肉,暴露腹腔,找到并游离双侧肾蒂,用无创动脉夹夹闭双侧肾蒂。观察肾脏颜色变化,确认血流阻断,夹闭45 min 后取下动脉夹,小鼠肾脏颜色在短时间内由暗褐色逐渐变为鲜红色,提示再灌注良好,逐层缝合,苏醒后继续自由饮水,12 h后自由进食。
1.2.2 动物分组
将40 只小鼠随机分成4 组(n=10):假手术组(sham组)、肾缺血再灌注组(RIR 组)、AS⁃1+肾缺血再灌注组(AS⁃1+RIR 组)、溶剂+肾缺血再灌注组(溶剂+RIR 组)。各组分别做如下处理:sham 组与手术组操作一样,但不夹闭小鼠双侧肾动、静脉;RIR 组在小鼠肾脏缺血45 min 后恢复血液供应;AS⁃1+RIR 组在术前30 min 按剂量50 mg/kg 腹腔注射AS⁃1;溶剂+RIR组在术前30 min按剂量50 mg/kg腹腔注射溶剂。
1.2.3 血清肌酐(Scr)、尿素氮(BUN)测定
术后24 h取各组小鼠眼球血,静置后在室温下离心10 min(3 000 r/min),取上清获得血清,检测Scr、BUN。
1.2.4 肾组织HE染色
术后24 h 处死各组小鼠取肾组织,在10%福尔马林中固定,病理切片后标准HE染色,在普通光学显微镜下观察各组肾组织病理变化,通过计算肾小管损伤面积半定量评估肾小管间质损伤程度。每张切片在200 倍光镜下随机选取皮髓质交界部10个不重叠视野观察肾损伤并评分。评估参数包括:肾小管上皮细胞变形、坏死,刷状缘脱落,管型形成,炎症细胞浸润。评分标准:1 分(≤10%);2 分(11%~25%);3 分(26%~45%);4 分(46%~75%);5分(≥76%)[11]。
1.2.5 ELISA法检测小鼠血清IL⁃6、TNF⁃ɑ水平
按ELISA试剂盒说明书操作,取各组小鼠眼球血血清,检测肾缺血再灌注后24 h的IL⁃6、TNF⁃ɑ水平,用多功能微孔板检测仪(λ=450 nm)测定吸光度(A)。
1.2.6 免疫组织化学染色
取各组肾组织石蜡切片予以常规脱蜡处理,煮沸的枸橼酸缓冲液抗原修复,免疫组化染色步骤则完全参考SP 的试剂盒说明书进行,CD68 和MPO 抗体浓度均为1∶100。
1.2.7 Western blot
取一定量的肾组织,加入预冷蛋白裂解液和蛋白磷酸酶抑制剂,充分研磨裂解后,12 000 r/min 离心30 min,取上清液,BCA法测蛋白浓度。蛋白煮沸冷却后每组取80 μg上样,经电泳、转膜、5%脱脂奶粉溶液封闭1 h 后,加入一抗:Caspase 3(1∶1 000)、Bcl⁃2(1∶1 000)、Bax(1∶1 000)、p⁃p65(1∶1 000),4℃封闭孵育过夜(摇床)。次日复温30 min,TBST洗膜3次,分别加入相应的HRP 标记的二抗(1∶3 000),常温孵育2 h(摇床),TBST洗膜3次,采用ECL化学发光试剂盒(Thermo公司,美国)显色曝光。
1.3 统计学方法
采用GraphPad Prism 5 统计软件分析。计量资料以均数±标准差()表示,实验数据经单因素方差分析(one⁃way ANOVA)比较,组间两两比较采用q检验。P<0.05为差异有统计学意义。
2 结果
2.1 AS⁃1改善肾缺血再灌注损伤的肾功能。
各组小鼠血清Scr 及BUN 水平比较见表1。与sham 组相比,RIR 组Scr 和BUN 均显著升高(P<0.01)。与溶剂+RIR 组相比,AS⁃1 处理后可以明显降低肾再灌注损伤后Scr 及BUN 水平(P<0.01)。与RIR 组相比,溶剂+RIR 组的Scr 和BUN 表达量无明显变化。
表1 血清Scr及BUN水平Table 1 The levels of serum Scr and BUN()

表1 血清Scr及BUN水平Table 1 The levels of serum Scr and BUN()
与sham 组相比,**P<0.01;与RIR 组和溶剂+RIR 组相比,##P<0.01。
2.2 AS⁃1改善肾缺血再灌注损伤的肾组织形态。
肾组织HE 染色结果见图1。光镜下sham 组肾小球、肾小管结构清晰,未见明显炎性细胞浸润。与sham 组相比,RIR 组肾小球毛细血管瘀血,肾小囊囊腔扩张,肾间质毛细血管扩张、弥漫性充血,肾小管扩张严重、上皮细胞变形坏死或消失、刷状边缘脱落,管壁变薄,部分呈蛋白管型,部分肾小管上皮细胞萎缩,细胞浆内可见大小不一的空泡,结构紊乱。AS⁃1 处理后,肾间质毛细血管充血减轻、炎性细胞浸润减少,上皮细胞变形坏死减少,表明肾组织损伤有所减轻。与RIR组相比,溶剂+RIR组的肾组织损伤没有明显变化,仍然损伤较严重。

图1 肾组织病理变化Figur 1 The histopathological changes of kidney tissues
2.3 AS⁃1 降低肾缺血再灌注损伤的肾组织炎症因子表达
各组小鼠血清炎症因子TNF⁃ɑ、IL⁃6 表达水平见图2。肾缺血再灌注损伤后,与sham组相比,RIR组TNF⁃α的表达量升高了107.22%(86.225±4.277vs.178.671±6.303,n=7,P<0.01),IL⁃6 的表达量升高了117.68%(101.980±6.159vs.221.994±7.512,n=7,P<0.01)。AS⁃1 处理后,与溶剂+RIR 组相比,TNF⁃α的表达量降低了36.67%(178.671±6.303vs.113.144±6.700,n=7,P<0.01),IL⁃6的表达量降低了29.60%(221.994±7.512vs.156.272±3.652,n=7,P<0.01)。与RIR 组相比,溶剂+RIR 组的TNF⁃α、IL⁃6表达量无明显变化。
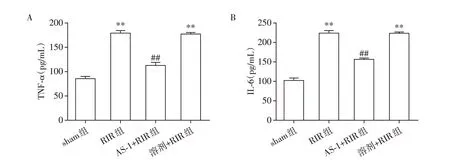
图2 血清炎症因子的表达水平Figure 2 The levels of serum inflammatory factors
2.4 AS⁃1 减轻肾缺血再灌注损伤的肾组织CD68+和MPO炎症细胞浸润
肾组织CD68+和MPO 免疫组化(图3)显示,与sham 组相比,RIR 组CD68+和MPO 炎症细胞明显增多。AS⁃1处理后,炎性细胞浸润减少。与RIR组相比,溶剂+RIR组的炎性细胞浸润没有明显变化。

图3 各组小鼠肾脏炎性细胞浸润情况(免疫组化,×400)Figure 3 Immunohistochemical detection of the infiltration of inflammatory cells in mice kidney of each group(IHC,×400)
2.5 AS⁃1减轻肾缺血再灌注损伤引起的细胞凋亡
各组小鼠Cleaved caspase3、Bcl⁃2、Bax的蛋白表达水平见图4。Western blot 结果显示,肾缺血再灌注损伤后,与sham 组相比,RIR 组的Cleaved cas⁃pase3升高了110.01%(1.000±0.125vs.2.100±0.085,n=3,P<0.01),Bax 的表达量升高了54.47%(1.000±0.050vs.1.545±0.031,n=3,P<0.01),Bcl⁃2的表达量降低了41.85%(1.000±0.062vs.0.582±0.047,n=3,P<0.01)、Bcl⁃2/Bax 的比值降低了62.37%(1.000±0.059vs.0.376±0.029,n=3,P<0.01)。与RIR+溶剂组相比,AS⁃1 处理后,Cleaved caspase3 的表达量下降了22.29%(1.934±0.103vs.1.503±0.060,n=3,P<0.01)、Bax 的表达量下降了26.05%(1.507±0.070vs.1.115±0.031,n=3,P<0.01),Bcl⁃2 的表达量升高了18.65%(0.566±0.027vs.0.696±0.025,n=3,P<0.01),Bcl⁃2/Bax 的比值升高了39.78%(0.376±0.018vs.0.624±0.008,n=3,P<0.01)。与RIR 组相比,溶剂+RIR 组的Cleaved caspase3、Bax、Bcl⁃2、Bcl⁃2/Bax表达量无明显变化。

图4 凋亡指标检测结果Figure 4 The results of apoptosis index
2.6 AS⁃1 抑制肾缺血再灌注损伤的肾组织NF⁃κBp65的磷酸化
各组小鼠在缺血45 min再灌注24 h后p⁃p65蛋白表达如图5 所示,结果显示,与sham 组相比,RIR组的p⁃p65 升高了64.97%(1.000±0.054vs.1.650±0.061,n=3,P<0.01),而经AS⁃1 处理后,与溶剂+RIR 组相比,AS⁃1 介入后p⁃ p65 的表达量下降了35.41%(1.707±0.036vs.1.103±0.021,n=3,P<0.01)。与RIR组相比,溶剂+RIR组的p⁃p65表达量无显著变化。

图5 NF⁃κB p65的磷酸化水平Figure 5 The levels of NF⁃κB p65 phosphorylation
3 讨论
本研究探讨了TIR/BB 环拟似物AS⁃1对小鼠肾缺血再灌注损伤的影响。研究发现小鼠肾缺血再灌注模型建立后肾功能指标血清Scr和BUN的水平明显升高,肾组织明显损伤;同时伴有炎性因子TNF⁃α、IL⁃6的表达增加、肾组织炎症细胞浸润增多;伴有凋亡相关因子Cleaved caspase 3、Bax 的表达增加及Bcl⁃2的表达下降。AS⁃1可降低肾缺血再灌注引起的血清Scr、BUN 的水平升高,减轻肾组织损伤程度;降低TNF⁃ɑ、IL⁃6、Cleaved caspase3、Bax 的蛋白表达及增加Bcl⁃2的表达,并减少炎性细胞浸润,发挥抗炎和抗凋亡作用。
AKI 在临床非常常见,且患病率呈逐年升高趋势,发达国家AKI 的发病率占入院患者的3.2%~9.6%,病死率占入院患者的20%,在ICU患者中病死率甚至达到50%,全球每年死于AKI 的患者有近200 万[1]。肾脏缺血再灌注损伤是肾脏外科手术中无法避免的病理生理过程,也是引起术后AKI 或肾功能不全的主要原因,因此减轻肾脏缺血再灌注损伤是目前临床研究的热点,相关实验性研究有着重要的临床治疗指导意义。已有研究报道提示,TIR/BB 环拟似物AS⁃1 主要通过抑制IL⁃1R 与MyD88 的结合发挥其调控多种病理生理学进程的作用,Zhu等[8]发现AS⁃1 可以抑制心肌肥大诱导的NF⁃κB 结合活性的增加及MAPK 信号的激活,同时抑制心肌肥大诱导的细胞凋亡,发挥心脏保护作用;Cao 等[9]研究发现AS⁃1 能抑制心肌缺血再灌注损伤诱导的NF⁃κB 的核转录活性,降低心肌组织中炎性因子(IL⁃1α、IL⁃1β、IL⁃6、TNF⁃α)的表达水平,保护缺血再灌注引起的心功能损伤。周扬等[10]研究也发现AS⁃1 能减少创伤失血性休克大鼠再灌注引起的IL⁃1β、TNF⁃α的表达发挥肝脏保护作用。因此,本文考虑研究AS⁃1 对肾缺血再灌注的保护作用。本研究依据相关文献报道采用左、右肾蒂结扎缺血45 min,恢复灌注24 h 建立小鼠肾缺血再灌注模型[12-13]。与假手术组比较,手术组肾功能指标血清Scr 和BUN 水平明显升高,肾组织病理形态有明显的损伤,表明模型制备成功,肾功能明显受损。与手术组和溶剂组相比,术前30 min腹腔注射AS⁃1处理后,能有效增加肾脏肌酐及尿素氮清除能力,血清肌酐和尿素氮水平明显降低,肾组织病理形态损伤有所减轻,表明AS⁃1对小鼠肾缺血再灌注损伤具有保护作用。
缺血再灌注损伤的病理反应与炎症反应密切相关,炎症反应可以显著恶化肾缺血再灌注损伤。在缺血缺氧状态下,血小板、巨噬细胞、肾小管上皮细胞等细胞活化,释放大量促炎因子如TNF⁃α、IL⁃6、黏附分子及其他趋化因子,在这些细胞因子、趋化因子及黏附分子的相互作用下,导致血管内皮细胞活化,血管通透性增加,大量炎性细胞浸润和聚集于组织间,增加氧自由基生产,造成炎症反应的级联放大反应,引起肾脏组织的损伤和功能的受损[14-15]。因此,TNF⁃α、IL⁃6等含量的升高及炎性细胞浸润增多可以作为炎症反应的指标。本研究中,小鼠肾缺血再灌注损伤后促炎因子TNF⁃α、IL⁃6 的表达明显增加,CD68+和MPO炎症细胞浸润增多,而给予AS⁃1 处理后,能有效减少促炎因子的释放并减轻炎症细胞的浸润,表明AS⁃1减轻肾缺血再灌注损伤、改善肾脏功能的作用可能与其抗炎症反应有关。
细胞凋亡也是肾缺血再灌注损伤的重要发病机制之一,肾缺血再灌注后可引起氧自由基大量聚集,诱发肾小管上皮细胞的凋亡,肾细胞的凋亡可导致肾组织的结构萎缩和肾细胞数目的减少,甚至诱发肾功能的急剧下降[16]。Caspase 蛋白酶家族在肾缺血再灌注损伤诱导的细胞调亡中发挥着重要的作用,被认为是细胞调亡过程中的关键环节和执行者,Caspase 3 是Caspase 家族中最主要的效应靶点,细胞凋亡发生时,Cleaved caspase3 的表达明显增加[17],本研究中,小鼠肾缺血再灌注损伤后Cleaved caspase3的表达明显升高,而给予AS⁃1处理后,能明显抑制其表达升高的现象。Bcl⁃2家族在细胞凋亡中也发挥着重要的决定作用,其是促凋亡和抗凋亡基因家族中的主要成员,包括促凋亡基因如Bax、Bak等和抗凋亡基因如Bcl⁃2等,细胞凋亡的发生与Bcl⁃2和Bax表达的上调或下调密切相关,相关研究表明,在缺血再灌注损伤过程中存在Bcl⁃2的表达下调和Bax的表达上调、两者的比值降低,而通过预处理干预措施使Bcl⁃2表达上调和Bax表达下调、两者的比值升高后,能够减轻缺血再灌注损伤诱导的细胞凋亡[17]。本研究中,小鼠肾缺血再灌注损伤24 h 后,Bcl⁃2 的表达明显减少,Bax 的表达明显增加,两者的比值降低。而给予AS⁃1 处理后,能明显上调Bcl⁃2 的表达、下调Bax,使Bcl⁃2/Bax 的比值显著增加,说明AS⁃1对缺血再灌注诱导的肾损伤保护作用与其抗凋亡相关。
NF⁃κB作为一种核转录因子在肾缺血再灌注损伤的过程中发挥着关键性作用。NF⁃κB的活化可引起促炎细胞因子及黏附分子等炎症介质的过量表达,引起一系列炎性级联反应,结合相关受体,也会激活相关凋亡基因,导致细胞凋亡,加重肾组织的损伤[15,18]。本研究中小鼠肾缺血再灌注损伤后p⁃p65蛋白表达增加,说明NF⁃κB被活化,NF⁃κB信号通路被激活,引发炎症级联反应,而给予AS⁃1 处理后,与肾缺血再灌注组和溶剂+缺血再灌注损伤组相比,p⁃p65蛋白表达降低,说明NF⁃κB 信号通路的活化程度被抑制,表明AS⁃1 可能通过抑制NF⁃κB信号通路的活化减轻肾局部炎症反应和凋亡损伤,进而改善肾脏功能。
综上所述,TIR/BB环拟似物AS⁃1预处理对小鼠缺血再灌注引起的肾功能损伤有保护作用,其机制可能与其抑制NF⁃κB 信号通路的活化产生抗炎和抗凋亡作用有关,可为临床开发应用防治急性肾损伤或急性肾衰竭类药物提供理论基础及实验依据。

