甲基苯丙胺的神经毒性:基于蛋白组学的靶向神经突触损伤研究
彭 鹏,解翠薇,王 军,肖 杭
1南京卫生高等职业技术学校临床一教研室,江苏 南京 210038;2南京医科大学公共卫生学院毒理学教研室,江苏 南京211166
甲基苯丙胺(methamphetamine,METH)的滥用已成为包括我国在内的全球公共卫生问题。METH滥用不仅造成机体多系统的严重损伤,同时亦对家庭及社会稳定造成极大危害。脑损伤一直是METH滥用引起神经损伤及精神障碍的不良后果。研究显示,METH可作用于多巴胺单胺能神经元,引起多巴胺大量释放,产生兴奋性毒性,导致该区域神经元死亡,引发帕金森样改变[1];我们前期研究显示,METH 暴露亦可引发阿尔兹海默症(Alzheimer’s disease,AD)样病理性蛋白β⁃amyloid(Aβ)、p⁃tau 的显著上调[2];此外,METH 暴露引发精神性疾病,如抑郁、焦虑等[3]。然而,在目前的多数报道中,METH的神经毒性及其机制的研究往往集中于某种病理性改变或某种机制的探讨,对METH 暴露引发的病理性改变仍缺乏系统而全面的认识。基于此,借助于高通量的蛋白组学,本研究探讨了原代神经元METH 暴露后蛋白组及其相关功能信号的改变,旨在从整体方面阐述METH 暴露引起的神经损伤,增强对METH 神经毒性的系统认识。此外,在系统认识的基础上,对神经突触的表达、数量、联系的研究,一方面阐述了METH 引起神经元损伤的部分机制,另一方面也是对组学中神经损伤结果的进一步验证,从而为METH 滥用引起的神经毒性提供潜在的干预靶点。
1 材料和方法
1.1 材料
18 d SD 清洁级孕大鼠均购自南京医科大学实验动物中心,实验动物使用许可证号:SYXK(苏)2021⁃0001。动物饲养温度20~26 ℃,湿度40%~70%,每12 h 昼夜明暗交替实验中原代细胞培养获南京医科大学实验动物福利伦理委员会的批准(伦理号:IACUC⁃1902013)。
Easy nLC 色谱系统、Agilent 1260 infinity ⅡHPLC 系统、Q Exactive 质谱仪(Thermo Fisher Scien⁃tific 公司,美国),激光共聚焦显微镜(Zeiss 公司,德国),低温高速离心机(5430R,Eppendorf 公司,德国),电泳仪、凝胶成像系统(BIO⁃RAD公司,美国),Multiskcan FC 酶标仪(Thermo Fisher Scientific公司,美国),真空离心浓缩仪(LNG⁃T98,苏州太仓华美),超声破碎仪(JY96⁃IIN,宁波新芝公司),MP Fastprep⁃24 匀浆仪(Fastprep⁃24 5G,MP 公司,美国),CO2恒温培养箱(Thermo Fisher Scientific 公司,美国);Pro⁃teome Discoverer 2.1(Thermo Fisher Scientific 公 司,美国),MASCOT 2.6(Matrix Science公司,美国),Per⁃seus 1.3(Max Planck Institute of Biochemistry in Mar⁃tinsried,德国),R version 3.0.3。
Neurobasal medium、B27、L⁃谷氨酰胺、甲酸(Thermo Fisher Scientific 公司,美国),DMEM/F12、胎牛血清(Gibco 公司,美国),Alexa Fluor⁃568(Life公司,美国),BSA、Tris(北京生工公司),木瓜蛋白酶、碘乙酰胺、NH3·H2O、NH4HCO3(Sigma Aldich 公司,美国),乙腈(Merck 公司,美国),BCA 定量试剂盒、SDS⁃PAGE 蛋白上样缓冲液(杭州碧云天),甲基苯丙胺(北京中国食品药品检定研究院),Multiple Affinity Removal LC Column Human 14/Mouse 3(Ag⁃ilent公司,美国)。
1.2 方法
1.2.1 原代神经元培养
取孕18 d SD 大鼠的胎鼠脑皮质,经2.0%的木瓜酶消化,经100 μm及40 μm的滤网过滤,离心后,加入5 mL 神经元培养液,以5×105个/mL 的密度接种,每隔3 d进行半量换液,待神经元长至8~10 d成熟后进行后续实验。
1.2.2 神经元蛋白组学的测定
FASP 酶解:原代培养的神经元与METH(900 μmol/L)处理24 h 后,提取蛋白并测浓度。各组样品取150 μg 蛋白质溶液,分别加入DTT 至终浓度为100 mmol/L,与样本孵育后,加入200 μL UA buffer,混合离心,后加入IAA buffer,经Trypsin 处理后,用C18 Cartridge 对肽段进行脱盐,肽段冻干后加入40 μL 0.1%甲酸溶液复溶,280 nm波长下进行肽段定量。
Easy nLC 色谱分离:每份样品采用纳升流速Easy nLC 系统进行分离。缓冲液A 液为0.1%甲酸水溶液,B 液为0.1%甲酸乙腈水溶液(乙腈为80%)。样品由自动进样器上样到分析柱分离,流速为300 nL/min。1.5 h 梯度:0~5 min,B 液6%;5~75 min,B 液线性梯度6%~38%;75~85 min,B 液线性梯度38%~100%;85~90 min,B液维持在100%。
质谱鉴定:样品经色谱分离后用Q Exactive 质谱仪进行质谱分析。利用多肽和多肽碎片的质量电荷比采集,每次全扫描后采集10 个碎片图谱(MS2 scan),仪器条件设置如下:MS2 Activation Type 为HCD,Isolation window 为2 m/z,二级质谱分辨率35 000,Microscans 为1,二级Maximum IT 为45 ms,Normalized Collision Energy 为30 eV。
蛋白质定性和定量分析:通过Proteome Discov⁃erer 2.1软件内置工具提交到MASCOT2.6 服务器进行数据库检索;通过Proteome Discoverer 2.1 将MAS⁃COT 服务器上形成的查库文件(.dat 文件)传回软件,根据FDR<0.01 的标准对数据进行筛选,获得高度可信的定性结果;使用数据库Uniprot_RattusNor⁃vegicus_36080_20180123,针对质谱分析原始文件用软件Mascot2.6和Proteome Discoverer2.1进行查库鉴定及定量分析。根据上述定量定性分析结果,进行基因本体论(gene ontology,GO)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路的分析。
1.2.3 蛋白免疫印迹分析
神经元裂解提取蛋白后,通过BCA法对蛋白进行定量,每个泳道加入蛋白40 μg后电泳及转膜,5%的脱脂奶粉溶液封闭,后与一抗4 ℃孵育过夜,二抗常温孵育1 h,通过ECL发光检测成像。
1.2.4 免疫荧光分析
神经元固定(4%的多聚甲醛),清洗,透化后加入10%山羊血清,37 ℃封闭60 min后,加入一抗,避光4 ℃过夜,后加入荧光标记二抗及防荧光猝灭DAPI 复合染料,激光共聚焦显微镜下拍照,计数。每皿细胞随机拍摄9个视野,实验重复3次。
1.3 统计学方法
实验数据统计分析处理,使用SPSS20.0软件进行统计学分析,多组定量资料比较采用单因素方差分析(one⁃way ANOVA)检验,多组数据间两两比较选用Dunnett⁃t检验,两组定量数据比较用Student’st检验,P<0.05 为差异有统计学意义,绘图使用GraphPad Prism 7.0。
2 结果
2.1 同位素标记相对和绝对定量(iTRAQ)分析
同位素标记相对和绝对定量(isobaric tag for relative and absolute quantitation,iTRAQ)是一种体外同位素标记的蛋白质定性定量技术。为观察METH 对原代神经元蛋白质的表达改变,通过METH(900 μmol/L)处理原代神经元24 h,然后提取细胞蛋白进行iTRAQ 分析。所鉴定蛋白按差异倍数和P值分布如图1 所示,差异倍数和相应的蛋白质数量呈正态分布(图1A),其中,METH 组与对照组比差异蛋白共51个,其中表达上调的有40个,下调的有11个,METH作用表达上调的蛋白较下调蛋白多(图1B)。

图1 对照组与METH比较后,两组样本蛋白质表达差异分布和火山图Figure 1 Analysis of the protein expression distribution and volcanic map of the control and METH groups
2.2 GO功能注释
用序列比对工具NCBI BLAST+(ncbi⁃blast⁃2.3.0+)将iTRAQ 分析得到的51 种差异蛋白与蛋白序列数据库进行比对,批量提取GO 注释。通过In⁃terProScan 搜索EBI 数据库将相关的功能信息注释给目标蛋白质序列,运行ANNEX以提高GO注释准确性。提取差异蛋白的GO Level2注释并进行分析(图2)。结果显示,METH 引起与细胞生物学过程、分子功能及细胞组分相关蛋白的改变。在细胞生物学过程方面,细胞组分和生物合成、生物调节、免疫功能、神经代谢与发育、对外界作用的应答等过程尤为明显;在分子功能方面,主要涉及转运、催化、分子传递等活性及蛋白结合过程的改变;在细胞组分的改变中,涉及大分子蛋白、细胞膜、细胞器及突触等相关蛋白的改变。

图2 GO注释结果的Level 2统计Figure 2 Level 2 Statistics of GO annotation results
2.3 KEGG通路富集分析
KEGG通路富集分析是蛋白质组学分析细胞功能改变的重要方法。该研究中,基于实验中51个差异蛋白,分析出19个蛋白在KEGG数据库中对应的多个信号通路。在差异蛋白通路富集结果中,依据显著性水平选取了10 个产生明显改变的信号通路(图3),其中与突触相关的多个信号通路发生改变(红框表示),提示METH 暴露对突触的调节通路的改变。

图3 KEGG通路富集Figure 3 KEGG pathway enrichment
2.4 METH暴露引起原代神经元突触表达的改变
突触是评价神经元生理功能的重要指标,在脑学习记忆,情绪及精神作用方面极为重要。基于上述蛋白组学研究发现,METH 暴露引起多种突触功能的改变(GABA 能及谷氨酸能突触,图3红框),以及细胞成分突触及突触部分的作用(图2 红框),我们验证了METH 作用后对突触的影响,观察了突触前,突触后及棘突标志性蛋白的表达。与蛋白组学中METH 影响突触的结果一致,METH 作用于神经元后引发棘突标志性蛋白Drebrin 及突触后标志性蛋白PSD95表达的下调(图4),与对照组比,具有显著性差异(P<0.05)。此外,METH作用引起突触前标志物Synapsin 1 的上调,上述结果提示,METH 暴露引起突触数量的改变,而对于突触后存在明显的损伤作用。
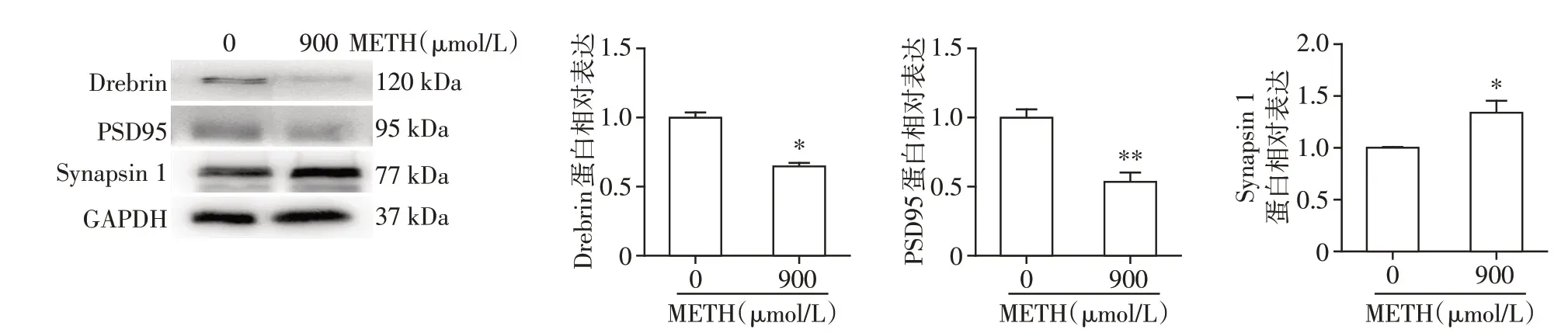
图4 METH染毒对原代神经元突触相关蛋白表达的影响Figure 4 Synapse associated protein levels of METH treated primary neurons
2.5 METH对树突、棘突表达及定位的影响
为进一步验证蛋白组学中METH对突触的作用及阐述METH 暴露引起的原代神经元树突、棘突的影响,我们借助免疫荧光法,利用抗F⁃actin 及Dre⁃brin抗体分别标记神经元的树突及棘突。结果显示(图5),对照组中树突与棘突存在大量的共定位,树突上棘突数量丰富,而METH(900 μmol/L)作用神经元24 h 后,棘突数量及荧光强度明显下降,同时与树突的共定位亦显著降低,提示METH 暴露后可改变树突、棘突结构及数量的改变,证明METH对神经元的毒性作用。
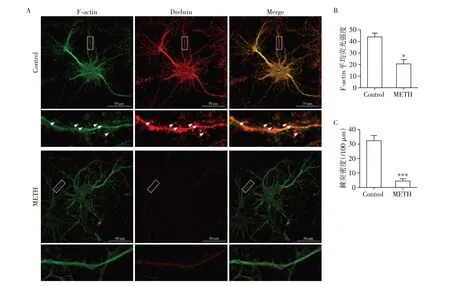
图5 METH对原代神经元F⁃actin表达水平变化及树突脊数量的改变Figure 5 Effects of METH on the expression of F⁃actin and the number of dendritic spines in primary neurons
2.6 METH 对突触前及突触后标志性蛋白表达及定位影响
在METH 引起棘突数量减少了基础上,该研究进一步观察了突触前神经元与突触后神经元之间的作用。以突触后密度蛋白(post synaptic density protein 95,PSD95)特异性标记神经元突触后,同时以Synapsin 1 标记突触后,观察METH 作用前后二者之间的相互作用。在METH 作用前,神经元突触前与突触后相互作用良好,存在较多的共定位;但METH作用24 h后,PSD95与Synapsin 1的共定位明显减少,且与Western blot 结果一致,METH 作用后PSD95 的数量减少,说明METH 作用后突触后损伤严重(图6)。
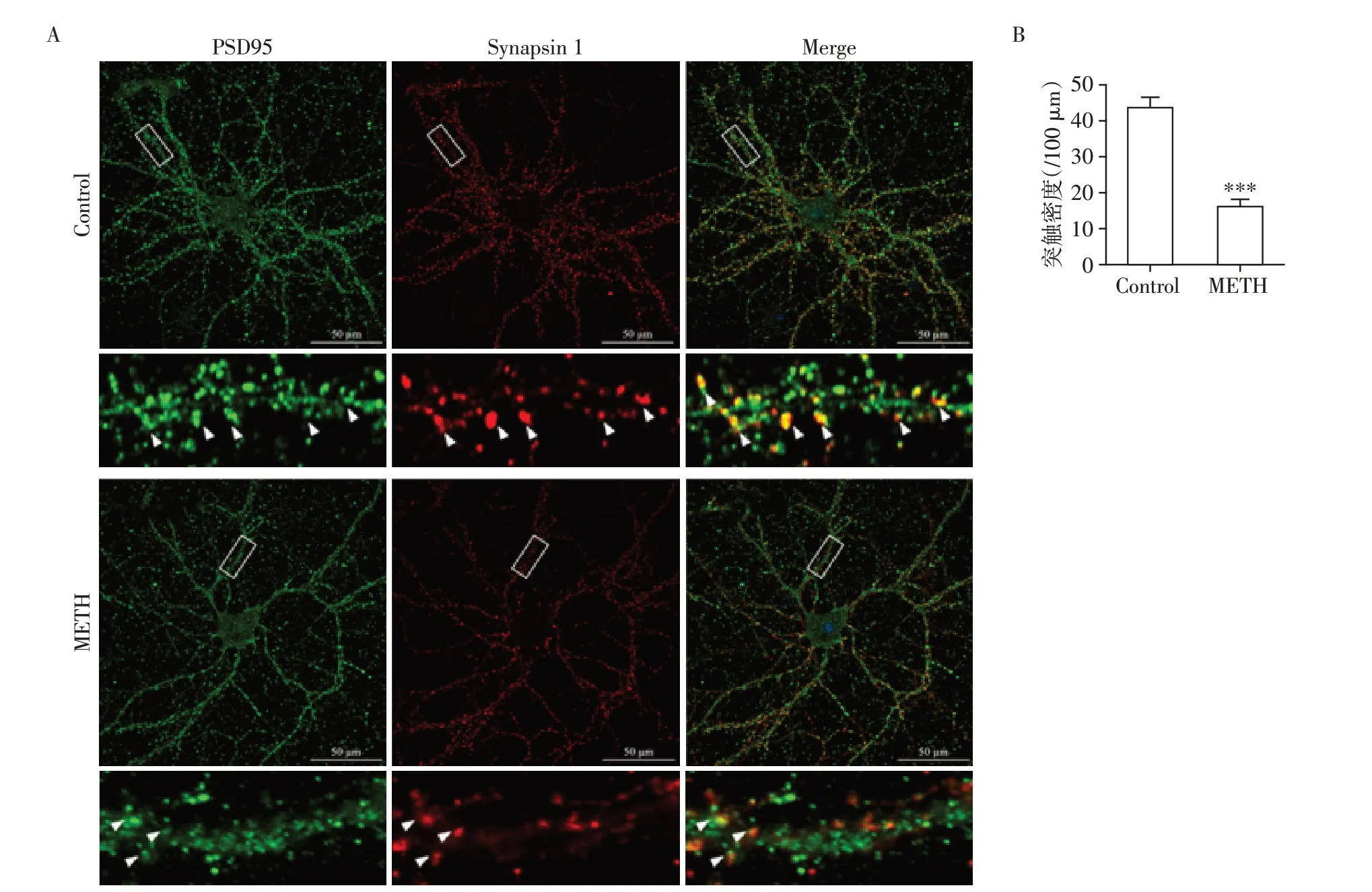
图6 METH染毒原代神经元24 h后突触数量的改变Figure 6 Changes of synaptic number in primary neurons exposed to METH for 24 hours
3 讨论
METH 作用的主要靶器官之一是脑,其滥用直接导致脑微环境的改变,引发脑功能异常,引起神经退行性、抑郁焦虑行为学改变等多种神经及精神性疾病的发生。因此,对METH 神经毒性的深刻揭示可为METH 滥用的干预提供积极指导,并具有重要的理论意义。然而,目前对于METH 神经毒性的研究多集中于对黑质纹状体区域单胺神经元的毒性研究,此外,针对神经炎性反应如对小胶质及星形胶质细胞的激活等研究亦相对较多,如既往借助基因芯片,发现METH 作用后神经元大量炎性因子释放及通路激活,阐释了炎性引起神经元损伤中的作用[5]。尽管如此,对于METH 滥用导致的神经毒性作用仍缺乏总体上的认识。因此,本研究借助蛋白组学的方法,系统观察了METH 作用神经元后,总体蛋白的表达及多种关键信号途径的改变,并基于神经元蛋白组学的数据,从突触损伤角度,剖析了METH 暴露引起神经元突触的损伤作用及部分机制,目前类似报道极少,具有较好的创新性及科学性。
本研究采用900 μmol/L METH 与神经元作用,这一浓度的选择与人体体液中检测出的最大浓度接近(600 μmol/L)[6],同时该浓度在既往研究METH毒性作用的多篇文章中应用,具有稳定的神经毒性作用[5,7],基于此,借助iTRAQ分析,鉴定出神经元多种蛋白发生明显改变,这些蛋白的改变涉及神经元调节、代谢、免疫、增殖、发育等多种细胞生物功能的改变。这与Lee 等[4]报道的METH 引起T 细胞凋亡及钝化,继而影响免疫功能的报道一致。同时,在分子功能方面,本研究亦与METH 暴露影响细胞过程转运、信号传递、应激应答等活动类似[8-9]。值得一提的是,METH暴露可能影响突触的功能,尤其GABA能及谷氨酸能突触通路受到METH暴露后的影响。研究显示,谷氨酸能及GABA 能突触在学习记忆的过程中发挥重要作用[10],而谷氨酸能及GA⁃BA 能突触功能异常或结构改变会导致神经及精神疾病的发生,如癫痫、焦虑、抑郁、阿尔兹海默症[11-12],对谷氨酸能突触的靶向干预能明显减轻学习记忆能力的下降[13],而GABA能突触在神经发育障碍的病因中起着重要作用,包括GABA能神经元的产生、迁移和存活[14]。作为一种突触后信号转导和整合的关键蛋白,PSD95具有参与突触连接的形成、维持突触的可塑性、参与疼痛的调控等多种生物学功能。研究显示,PSD95 的3′UTR 多态性与急性缺血性卒中相关[15],而PSD95 的下调与缺失引发神经元NMDA、AMPA 及GABAA受体表达,阻碍神经发育,导致多种神经疾病,包括自闭和精神分裂[16]。而通过BDNF⁃TrkB⁃CREB上调PSD95后可明显改善Aβ42引起的神经元损伤[17],PSD95 的上调亦可显著改善慢性束缚应激引发的小鼠抑郁样改变,上述PSD95减少引起的病理性现象与本研究中METH暴露引起PSD95显著下调的现象一致。METH暴露促进突触前大量囊泡及囊泡中神经递质的释放,近期有研究充分揭示了Synpasin 1与囊泡数量的关系,即Synpa⁃sin 1 的表达密切调控囊泡的数量[18],提示METH 引起的Synpasin 1 高表达可能与METH 引起囊泡数量及调控改变相关。在棘突方面,METH 引起其表达与数量的明显减少,同时引起突触前与突触后定位的显著下降,提示突触前与突触后的联系降低。
本研究从蛋白组角度系统阐述了METH暴露引起神经元多种活动及信号通路的改变,通过聚焦突触改变,揭示突触损伤、联系减少是METH引起神经元功能降低的重要原因,因此针对性保护突触的损伤,上调PSD95 等关键突触蛋白可能为METH 引起的神经损伤及相关神经性疾病提供治疗策略,具有重要的干预意义。
——壮肾

