检测B 细胞成熟抗原的噬菌体展示单链抗体实时荧光定量免疫PCR方法建立
康子茜,王加利,和似琦,崔鑫铭,石冰洁,王建勋
北京中医药大学生命科学学院,北京102488
多发性骨髓瘤(multiple myeloma,MM)是一种克隆浆细胞异常增多的恶性疾病[1]。近年来,MM患者面临的治疗选择越来越多样化,找到一种快速准确地监控治疗效果的方法非常重要。目前,MM 患者的荷瘤状态是通过监测单克隆蛋白(M蛋白)和血清游离轻链水平来评估的,这两项指标都衡量了恶性浆细胞克隆产生的全部或部分抗体。然而M 蛋白的变化水平缓慢,免疫球蛋白在体内的半衰期很长,这就意味着检测疾病状态变化需要很长时间;M蛋白与血清游离轻链这两项指标在患者肾功能衰竭时则不能准确评估,而肾功能衰竭是MM 患者的常见并发症,这就限制了很多患者的应用。这些患者只能选择更具侵入性和更昂贵的程序进行监测,例如PET-CT检查,然而这项检查并不能经常进行。这些项目的限制性产生了对监测MM 患者状态的新的血清标志物的需求[2-3]。B 细胞成熟抗原(B cell maturation antigen,BCMA)是肿瘤坏死因子受体超家族的成员,可通过B 细胞激活因子(B cell-activating factor,BAFF)和增殖诱导配体(a proliferation-inducing ligand,APRIL)的信号转导促进浆细胞的存活和增殖[4]。BCMA 在恶性浆细胞上的选择性高表达使其成为治疗MM 的理想靶抗原。研究[5]发现,血清BCMA 水平是监测MM 患者病情和总生存期的一个新 的 生 物 标 志 物。2020 年12 月10 日—2022 年1 月1 日,我们构建了一种基于噬菌体展示单链抗体的实时荧光定量免疫PCR(phage display real time-immuno polymerase chain reaction,PDRT-IPCR)检 测BCMA的新方法,现报告如下。
1 材料与方法
1.1 试剂、仪器 BCMA 抗原标准品购自美国ACRO Biosystems 公司,M13KO7 辅助噬菌体购自成都仁域生物技术有限公司,抗BCMA 抗体基因片段ANTI-BCMA、抗CD19 抗体基因片段ANTI-CD19 由本实验室合成保存;E. coliDH5α 感受态细胞购自TIANGEN 生化科技(北京)有限公司,Pyrobest DNA Polymerase 购自TaKaRa 公司,DL 2000 DNA Marker、ELISA 包被液、5%BSA 封闭液购自北京索莱宝科技有限公司,高吸附酶标板购自美国康宁公司,SYBR荧光定量PCR试剂盒、Easy Geno快速重组克隆试剂盒、PEG 8000、NaCl、PBS、Tween-20 均购自北京兰博利德商贸有限公司。HQL150B 大幅度恒温摇床购自上海智城分析仪器制造有限公司,CFX96 real time PCR 仪、T100TM型PCR 仪、ChemiDocTMMP Imaging System 购自美国Bio-Rad 公司,超微量分光光度仪购自美谷分子仪器(上海)有限公司,DYY-6C 电泳仪购自北京六一生物科技有限公司。引物合成及测序由北京擎科生物科技有限公司完成。
1.2 重组噬菌体M13KO7-ANTI-BCMA 的制备及展示抗BCMA单链抗体鉴定
1.2.1 重组噬菌体质粒M13KO7-ANTI-BCMA 的构建 M13KO7 噬菌体载体缺少合适的酶切位点,故采用无缝克隆的形式将抗体片段与载体进行连接。由于完整的载体片段较大,所以将载体预先扩增为两部分,再同抗体片段连接入噬菌体载体。根据M13KO7 的编码序列,设计2 对引物,分别扩增M13KO7-1 和M13KO7-2 两个片段。扩增M13KO7-1编 码 序 列 的 引 物:M13KO7-1-F 为5′-GCGGCCGCAGAACAAAAACTCATCTCAGAAGAGGATCTG-3′,M13KO7-1-R 为5′-CTTCCCTGTTAAGTATCTTCCTGGCATCTTCCAGGAAATC-3′。扩增M13KO7-2 编码序列的引物:M13KO7-2-F 为5′-GGAAGATACTTAACAGGGAAGTGAGAGGGCCGCGGCAAAGC-3′,M13KO7-2-R 为5′-TTCAGCGGAGTGAGAATAGAAAGGAACAACTAAAGGAATT-3′。采用PCR 法扩增载体片段,取扩增产物进行凝胶电泳检测片段后,进行凝胶电泳分离并切胶回收。根据抗体ANTI-BCMA 片段与M13KO7 载体序列设计引物,ANTI-BCMA-F 为5′-CTATTCTCACTCCGCTGAAGATATCGTGCTGACACAAAGC-3′,ANTI-BCMA-R 为5′-GAGATGAGTTTTTGTTCTGCGGCCGCAGCAGCGGCGCTAGAAAC-3′。PCR扩增后进行凝胶电泳检测片段大小,然后凝胶电泳分离并切胶回收抗BCMA单链抗体片段ANTI-BCMA。将M13KO7的载体片段与ANTI-BCMA片段进行无缝克隆重组,获得重组噬菌体质粒M13KO7-ANTI-BCMA。将重组噬菌体质粒M13KO7-ANTI-BCMA转化E.coliDH5α感受态细胞,挑取阳性克隆并测序,将测序正确克隆的菌液加甘油保存于-80 ℃冰箱。
1.2.2 重组噬菌体M13KO7-ANTI-BCMA 的制备取-80 ℃冰箱冻存的测序正确的含有重组噬菌体质粒M13KO7-ANTI-BCMA 的菌液缓慢融化,接种环蘸取菌液划线于卡那霉素抗性的LB 平板,37 ℃培养12 h。挑取单克隆接种于10 mL 的卡那霉素抗性的2×YT液体培养基中,37 ℃、220 r/min振荡培养12 h。培养液在4 ℃条件下3 500 r/min离心15 min以沉淀菌体,取上清液,加入总体积1/5 体积的PEG/NaCl溶液混匀,冰上静置1.5 h,4 ℃条件下10 000 g 离心30 min,即获得重组噬菌体M13KO7-ANTI-BCMA,弃上清液后,用1 mL PBS重悬。
1.2.3 重组噬菌体M13KO7-ANTI-BCMA 展示抗BCMA 单链抗体的鉴定 采用Western Blotting 法。将重组噬菌体M13KO7-ANTI-BCMA 热变性后进行SDS-PAGE,电泳结束后进行转膜,取出硝酸纤维素膜用TBST 漂洗后,加入含5%脱脂奶粉的TBST 封闭1 h,弃去封闭液,加入TBST洗涤2次,弃去TBST,加入用5%脱脂奶粉1∶2 000稀释的抗噬菌体PⅢ蛋白一抗,4 ℃孵育过夜。TBST 洗膜3 次后加入羊抗鼠IgG-HRP 二抗,室温孵育1 h,弃去二抗,TBST 洗膜3次,显影液的A 液和B 液按照1∶1的比例混匀滴加于膜上,避光孵育2 min 显影,使用BIO RAD ChemiDocTMMP Imaging System 凝胶成像系统曝光,观察抗BCMA 单链抗体-PⅢ重组蛋白的分子量。M13KO7 噬菌体通过PⅢ蛋白与抗BCMA 单链抗体连接,其中M13KO7 噬菌体PⅢ蛋白分子量约为42.5 kD,抗BCMA 单链抗体蛋白分子量约为31 kD,若抗BCMA 单链抗体蛋白成功连接到M13KO7 噬菌体PⅢ蛋白上,则抗BCMA单链抗体-PⅢ重组蛋白分子量约为73.5 kD。
1.3 PDRT-IPCR检测BCMA的线性范围、最低检测限测算 取BCMA标准品用包被液稀释(1 000 ng/mL、100 ng/mL、10 ng/mL、1 ng/mL、0.1 ng/mL、0.01ng/mL、0 ng/mL)后,以每孔100 µL 包被96 孔高吸附酶标板,4 ℃孵育过夜。PBST(含0.05%Tween-20 的PBS,pH 7.4)洗板5 次,5% BSA 封闭,37 ℃孵育1.5 h,PBST 洗板5 次。每孔加入100 µL的1×1011copies/mL 的重组噬菌体M13KO7-ANTIBCMA,以不加噬菌体的孔为阴性对照孔,阴性对照孔添加1 000 ng/mL 的BCMA 包被。37 ℃孵育1 h,PBST 洗板5 次,每孔加入100µL 无酶水,95 ℃水浴10 min,将与BCMA 特异性结合的噬菌体热裂解,以裂解噬菌体的DNA 作为扩增模板,进行实时荧光定量PCR。根据M13KO7 噬菌体的PⅢ蛋白基因序列设计通用引物,引物序列如下:PⅢ蛋白-F 为5′-CGTGCTGACACAAAGCCCTC-3′,PⅢ蛋白-R 为5′-ATCAGCAGAGTAGGAGGTTG-3′。PCR 反 应 体 系如下:2×Mix 10 µL,PⅢ蛋白-F(10 µmol/L)1 µL,PⅢ蛋白-R(10 µmol/L)1 µL,M13KO7-ANTI-BCMA噬菌体2 µL,ddH2O 6 µL,反应体系共计20 µL。PCR 反应条件:预变性95 ℃,2 min;变性95 ℃,15 s;退火57 ℃,30 s,39个循环;循坏后添加溶解曲线。观察不同浓度BCMA 的实时荧光定量PCR 扩增曲线,比较最低浓度BCMA 与0 ng/mL BCMA 之间的CT 值差异,确定大致线性范围。同时以不加M13KO7-ANTI-BCMA 噬菌体孔作为阴性对照,判断整个实验操作是否存在污染情况。以BCMA标准品坐浓度为横标,CT 值为纵坐标,运用OriginPro2021软件进行四参数Logistic拟合曲线,根据相关系数R2确定相关性最强的浓度范围为该方法检测的线性范围。根据文献[6]检测限计算方法,以如下公式计算本方法的最低检测限:LoD(Limit of Detection)=LoB+ 1.645(SDlowconcentrationsample),LoB(Limit of Blank)=meanblank+1.645(SDblank)。
1.4 PDRT-IPCR方法检测BCMA的特异性验证为验证基于PDRT-IPCR 方法检测BCMA 的特异性,我们同时构建并制备了展示抗CD19 单链抗体的重组噬菌体M13KO7-ANTI-CD19。将展示重组噬菌体M13KO7-ANTI-BCMA、重组噬菌体M13KO7-ANTICD19和噬菌体M13KO7各100µL,分别投放入包被100 ng/mL BCMA 的酶标板孔和空白孔中,分别记为BCMA 孔、空白孔,37 ℃孵育1 h,PBST 洗板5 次。每孔加入100µL无酶水,95 ℃水浴10 min热裂解已结合的噬菌体,以其DNA 作为扩增模板,根据M13KO7噬菌体PⅢ蛋白基因设计引物,进行PDRTIPCR 反应。以M13KO7-ANTI-BCMA 噬菌体的已知浓度质粒进行10倍梯度稀释作为标准品,以质粒拷贝数为横坐标、CT 值为纵坐标做标准曲线,根据标准曲线换算噬菌体与BCMA 结合的实际拷贝数,比较3 种噬菌体的BCMA 孔及空白孔结合拷贝数,判断每种噬菌体是否与BCMA具有特异性结合。
2 结果
2.1 重组噬菌体M13KO7-ANTI-BCMA 展示抗BCMA 单链抗体的鉴定结果 在75 kD 处有清晰的蛋白条带,表明M13KO7 重组噬菌体PⅢ蛋白上已成功连接了抗BCMA 单链抗体,抗BCMA 单链抗体成功展示在重组噬菌体M13KO7-ANTI-BCMA表面。
2.2 PDRT-IPCR检测BCMA的线性范围、最低检测限 PDRT-IPCR 检测BCMA 的扩增曲线见图1。由图1 可见,随着BCMA 包被浓度的降低,对应扩增曲线的CT值逐渐变大,当BCMA浓度降至0.01 ng/mL时,其CT值与0.1 ng/mL的扩增CT值已经非常接近,已经不具备良好的线性相关性。PDRT-IPCR 检测BCMA 的标准曲线见图2。由图2 可见,PDRT-IPCR检测BCMA的线性范围为0.1 ng/mL~1 000 ng/mL,R2为0.999 3,最低检测限为0.077 ng/mL。

图1 PDRT-IPCR检测BCMA的扩增曲线
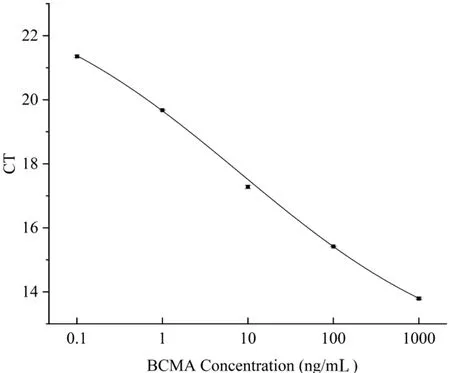
图2 PDRT-IPCR检测BCMA的标准曲线
2.3 PDRT-IPCR 方法检测BCMA 的特异性验证结果 噬菌体M13KO7 与空白孔、BCMA 孔结合的拷贝数分别为1.91×105copies、1.44×105copies,两者相比,P>0.05。重组噬菌体M13KO7-ANTI-CD19 与空白孔、BCMA 孔结合的拷贝数分别为3.07×105copies、1.04×105copies,两者相比,P>0.05。重组噬菌体M13KO7-ANTI-BCMA 与空白孔、BCMA 孔结合的拷贝数分别为1.02×105copies、4.34×106copies,两者相比,P<0.01,提示重组噬菌体M13KO7-ANTIBCMA与BCMA具有特异性结合。
3 讨论
目前,用于检测肿瘤生物学标志物的方法有放射免疫分析法、化学发光免疫法、酶联免疫吸附法、纳米圆弧免疫传感器、液体活组织检查、分子生物学方法等[7-13]。将酶联免疫吸附测定法与PCR 技术进行结合的免疫PCR 技术结合了两种方法的优势,然而也存在DNA 与抗体偶联繁琐耗时的缺点,进而出现了噬菌体展示介导的免疫PCR 技术。噬菌体展示技术由George P. Smith 于1985 年首次创建[14],该技术将一段外源基因插入丝状噬菌体的外壳蛋白基因中,使外源基因以融合蛋白的方式展示在噬菌体表面,进而通过表型筛选就能同时获得其编码基因[15]。噬菌体因其纳米尺寸和对其结构和功能进行遗传修饰的简便性,使其在各种领域都发挥着巨大应用价值,近年来随着各种新兴技术的出现,噬菌体展示技术与纳米金颗粒[16]、高通量测序[17]、磁流体[18]等新技术结合应用,更是对微量物质的检测方法提供了新思路。通过对基因组进行编辑,在噬菌体的表面几乎可以表达任何蛋白质或多肽[19]。此外,噬菌体相对较短的复制时间使大量生产成为可能[20]。噬菌体展示的检测抗体不需要化学偶联或生物素化,易于制备,在PBS 中加入15%甘油即可冷藏数月,具有较好的实用稳定性[21]。本研究构建的检测BCMA的PDRT-IPCR方法将抗原抗体反应的特异性与聚合酶链式反应的灵敏性结合起来,噬菌体既作为检测抗体,其携带的DNA 又可作为PCR 中的扩增模板,PCR 指数级的信号扩增使得此方法的灵敏度和线性范围得到了明显改善[22]。
本研究首先运用无缝克隆技术将抗体基因连接入噬菌体载体中,成功构建了M13KO7-ANTI-BCMA重组质粒。无缝克隆技术简单灵活,连接阳性率高,且连接时间较酶切连接大大减少。阳性质粒测序正确后保存于大肠杆菌中,质粒在大肠杆菌胞内组装合成噬菌体。M13KO7 噬菌体作为一种温和噬菌体,并不会像烈性噬菌体一般将宿主菌裂解,而是会将胞内已合成的噬菌体分泌到胞外,培养过夜通过PEG/NaCl 溶液低温沉降,即可收集到噬菌体颗粒。为了确保单链抗体成功连接到噬菌体尾部的PⅢ蛋白上,我们做了Western blotting 实验检测抗BCMA单链抗体与噬菌体PⅢ蛋白的融合蛋白的分子量大小,符合预期,至此已成功构建并制备出来展示抗BCMA单链抗体的重组噬菌体M13KO7-ANTI-BCMA。为了将该重组噬菌体应用于检测BCMA 的实时荧光定量免疫PCR 的方法,我们对BCMA 的包被浓度进行了摸索,在低于0.1 ng/mL 设置了0.01 ng/mL BCMA,但是更低浓度的BCMA 与CT 值已不再具备线性关系,最终选取了线性相关系数最强的0.1 ng/mL~1 000 ng/mL浓度区间作为检测的线性范围。
为了验证本方法检测BCMA 的特异性,将三种噬 菌 体 M13KO7-ANTI-BCMA、M13KO7-ANTICD19、M13KO7 分别与包被100 ng/mL BCMA 孔及空白孔进行结合并进行实时荧光定量PCR 检测CT值,同时以提取的已知浓度的M13KO7-ANTI-BCMA 质粒作为标准品进行梯度稀释并做实时荧光定量PCR,绘制标准曲线。根据标准曲线换算三种噬菌体与每孔的结合拷贝数,分析拷贝数可知,M13KO7-ANTI-BCMA 噬菌体的BCMA 孔结合拷贝数远大于空白孔,另外两种噬菌体的BCMA 孔结合拷贝数略小于空白孔,可见M13KO7-ANTI-BCMA噬菌体与BCMA 的结合是特异性的,另外两种噬菌体与BCMA 无特异性结合;另外两种噬菌体的BCMA 孔结合拷贝数反而小于空白孔,推测是由于BCMA 的包被阻止了两种噬菌体与板孔的非特异性结合。
综上所述,本研究建立了基于PDRT-IPCR 检测BCMA 的方法,该检测方法具有检测限灵敏、线性范围宽、重复性高、选择性好、准确度高、实用性强等特点,它可用于临床诊断中对BCMA的敏感检测,在肿瘤患者的早期阶段微量生物标志物的检测、中晚期治疗效果的评定、疾病状态的变化预后等方面都有巨大价值,也为临床检测BCMA 试剂盒的开发奠定了研究基础。

