NLK通过维持NF-κB/P53平衡抑制前列腺炎-癌转化
王 建,丁聪聪,陆 岩,李桐
广东医科大学广东省医学分子诊断重点实验室,广东 东莞 523808
前列腺癌是全球男性第二常见癌症。在中国,近年来其发病率显著上升,且确诊病例中的中晚期比例明显高于欧美发达国家,已严重影响到中国男性健康[1-2]。大量研究[3-6]显示,前列腺炎症是促进前列腺癌发生的一个重要因素,但清晰、完整的诱发机制尚未明确。本研究旨在探究调控前列腺炎-癌转化的关键因子,这对于应用抗炎新策略防治前列腺癌具有重要意义。
Nemo样激酶(Nemo-like kinase,NLK)是一种与促分裂原活化激酶家族同源的较特殊的酶类,不仅以丝氨酸/苏氨酸为靶点发挥激酶活性,还具有非激酶依赖的生物学功能。在不同癌症的发生、发展过程中,NLK分别发挥着抑癌或促癌两种截然相反的作用[7-8]。研究[9]发现,前列腺癌组织中NLK的表达水平显著低于良性前列腺组织,并与前列腺癌相关的核受体相关因子1(nuclear receptor related factor 1,Nurr1)的表达水平呈显著的负相关关系,这个负相关源自NLK对Nurr1基因转录的负性调节,对其机制进一步研究发现,NLK可与核因子-κB(nuclear factor-κB,NF-κB)的转录共激活因子CREB结合蛋白(CREB-binding protein,CBP)相互作用,抑制CBP募集到Nurr1基因启动子序列上的NF-κB位点,使NF-κB对Nurr1基因的转录活性显著下调。NF-κB不但在自然免疫及炎症反应过程中发挥重要的调节作用,还是一个内源性的促肿瘤因子,其信号转导通路的激活与前列腺癌变及恶性演变密切相关[10]。NLK是NF-κB转录激活的负性调控分子,其表达减少可能会进一步增强前列腺炎症介导的NF-κB信号转导通路的活化。鼠双微体基因2(murine double minute 2,MDM2)是由NF-κB转录调控的重要靶基因之一,在多种肿瘤中发生突变和扩增,具有E3连接酶活性,介导P53蛋白的泛素化,以促进其经蛋白酶体途径降解,且MDM2/P53被证明是肿瘤发生、发展的重要分子信号转导通路[11-12]。而NLK能以非激酶依赖方式与MDM2相互作用来限制MDM2的功能,抑制P53蛋白进入泛素-蛋白酶体途径,进而减少P53的降解,以维持其发挥生物学效应所需的浓度[13]。由此推测NLK可能作为NF-κB和P53的共同上游调控者,影响前列腺炎-癌转化进程。
因此,本研究建立前列腺炎-癌转化细胞模型,并探讨模型细胞中NLK对NF-κB和P53信号转导通路的影响及相互关联方式,以明确NLK在前列腺由炎症向癌症转变过程中的作用和机制。
1 材料和方法
1.1 细胞、试剂及仪器
人前列腺上皮细胞系RWPE-1和人急性单核细胞白血病细胞系THP-1购自汉恒生物科技(上海)有限公司,NLK基因稳定过表达的细胞株RWPE-1(NLK↑)和NLK基因稳定敲低的细胞株RWPE-1(NLK↓)由广州辉骏生物科技有限公司构建,pcDNA3.1-P53质粒购自广州辉骏生物科技有限公司,NF-κB-Luc质粒购自翌圣生物科技(上海)股份有限公司,双荧光检测试剂盒购自美国Promega公司,LipofectamineTM2000、远红外荧光标记的二抗、Cy3标记的二抗及FITC标记的二抗抗均购自美国Invitrogen公司,鼠抗人Nurr1抗体、鼠抗人NLK抗体、鼠抗人MDM2抗体及兔抗人β-actin抗体均购自美国Santa Cruz公司,兔抗人P53抗体购自英国Abcam公司,胎牛血清、RPMI-1640培养基及K-SFM培养基均购自美国Gibco公司,免疫共沉淀试剂盒购自南京艾思易生物科技有限公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自上海吉玛制药技术有限公司,PCR相关引物由生工生物工程(上海)股份有限公司合成。
Odyssey成像仪购自美国LI-COR公司,GloMaxTM20/20发光检测仪购自美国Promega公司,ABI7500 PCR仪购自美国ABI公司,激光共聚焦扫描显微镜(TCS SP8)购自德国Leica公司。
1.2 细胞培养
培养RWPE-1细胞使用K-SFM培养基(添加50 ng/mL牛垂体提取物、5 ng/mL表皮生长因子和1%青霉素/链霉素/二性霉素B),培养THP-1细胞使用RPMI-1640培养基(添加0.05 mmol/L 2-巯基乙醇和10%胎牛血清),培养条件为37 ℃、CO2体积分数为5%,平均2~3 d传代1次。
1.3 前列腺炎-癌转化细胞模型的建立
①THP-1细胞向M2型巨噬细胞分化:将THP-1细胞以2.5×104个/mL的浓度接种于10 cm培养皿中,加150 nmol/L佛波酯,置于细胞培养箱中培养24 h;将细胞用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)将残留的佛波酯洗净,加入20 ng/mL IL-4和20 ng/mL IL-13,继续培养24 h。② 共培养条件培养基的制备:使用6孔transwell培养板,在下室培养RWPE-1细胞,初始接种量为105个/孔;在上室培养分化的THP-1细胞,初始接种量为4h 105个/孔,共同培养2 d;按上述方法培养多个transwell培养板的细胞,将下室培养基吸出并收集在一起,通过离心除去其中的细胞碎片,再与等量新配制的RWPE-1细胞原培养基混合,制成共培养条件培养基,用于将RWPE-1细胞长时间培养以建立细胞模型。③对照培养基的制备:transwell培养板上室只含有RPMI-1640培养基,不接种THP-1细胞,其他步骤同共培养条件培养基的制备。④ 细胞造模:RWPE-1细胞、NLK过表达的RWPE-1(NLK↑)细胞和NLK敲低的RWPE-1(NLK↓)细胞在共培养条件培养基中培养,2 d更换1次培养基,持续培养3周后进行相关实验处理及指标检测。同时使用对照培养基培养的RWPE-1细胞作为空白对照。本研究实验分组如下:RWPE-1(NLK↑)组为RWPE-1细胞稳定转染pcDNA3.1-NLK质粒,RWPE-1(NLK↓)组为RWPE-1细胞稳定转染shRNA-NLK质粒,RWPE-1/THP-1组为RWPE-1细胞与THP-1细胞共培养,RWPE-1(NLK↑)/THP-1组为RWPE-1(NLK↑)细胞与THP-1细胞共培养,RWPE-1(NLK↓)/THP-1组为RWPE-1(NLK↓)细胞与THP-1细胞共培养。
1.4 细胞转染
P53表达质粒的转染使用6孔板,各组细胞以2.5h 105个/孔的浓度接种到6孔板中,当细胞生长至汇合度达培养板底70%左右时即可转染:首先将细胞原培养液吸净,用PBS洗1次,再加入新鲜的无血清培养基;将250 µL无血清培养基和5 µg目的质粒混合加入到1支离心管中,将10 µL LipofectamineTM2000和250 µL无血清培养基混合加入到另1支离心管中,两管均室温静置5 min;将两离心管内容物合二为一,于室温放置20 min;将混合物以500 µL/孔的量加入到细胞培养板中,在原条件培养箱中温育4 h后,再更换为原培养基。双荧光素酶表达质粒的转染使用24孔板,所用相关试剂的量按相应的比例减少。以上转染过程所用试剂均不添加抗生素。
1.5 软琼脂集落形成实验
制备底层琼脂:分别配制2h 细胞培养基和浓度为1.2%的琼脂糖,两者均以0.7 mL/孔等量混合于6孔板底部,在室温下凝固形成底层琼脂;制备上层琼脂:分别配制2h 细胞培养基和浓度为0.6%的琼脂糖,两者均以0.5 mL/孔等量混合于6孔板底层琼脂之上,同时加入浓度为1.0h 105个/mL的单细胞悬液100 µL,混匀,在室温下凝固形成上层琼脂;将细胞培养板置于原培养条件下持续培养14~21 d,期间每隔48 h以0.2 mL/孔的量加入细胞原培养基和PBS的等量比混合物,以预防干燥;将培养板置于显微镜下,以含有50个细胞以上的细胞团作为计数标准。实验重复3次。
1.6 MTT实验
各组细胞用原培养基制成单细胞悬液(浓度为2.0h 104个/mL),选用96孔板进行接种,每孔加200 µL单细胞悬液,在原培养条件下继续培养;分别于接种后1、2和3 d进行如下检测:向96孔板每孔中加入20 µL MTT溶液(5 mg/mL,pH=7.4),在原培养条件下继续培养4 h;除去培养板孔内液体,每孔再加入150 µL二甲基亚砜,置于摇床轻度振摇约10 min;待结晶物充分溶解后用酶标仪检测490 nm波长处的吸光度(D)值,记录结果并根据检测时间和D值绘制生长曲线。实验重复3次。
1.7 NF-κB转录活性检测
NF-κB转录活性的检测选用NF-κB-luc为目的基因报告质粒,内参为pRL-SV40质粒。使用24孔板,各组细胞接种后同时转染上述两种质粒,在原培养条件下继续培养48 h;终止培养,除去培养基,并用PBS漂洗细胞;向细胞培养板的每孔中加入0.1 mL新配制的裂解缓冲液,用移液器吸嘴反复吹洗后,置于摇床振摇30 min;取1.5 mL Eppendorf试管,加入50 µL LARⅡ及10 µL细胞裂解物,吹打混匀,用发光检测仪进行检测,此读数为报告质粒荧光反应强度(RLU1);将Eppendorf试管从分析仪中取出,再加入50 µL Stop &Glo®试剂,混匀后进行检测,此读数为内参照报告质粒荧光反应强度(RLU2);最终NF-κB转录活性数值以RLU1/RLU2计算。实验重复3次。
1.8 RTFQ-PCR检测
吸出各组细胞培养皿中的培养基,并用预冷的PBS洗净,向每个培养皿中再加入1 mL TRIzol试剂后置于冰上裂解10 min;将细胞在培养皿中反复吹打后吸出移至Eppendorf试管中,室温放置2 min;加入氯仿0.2 mL,振荡混匀,室温放置15 min;4 ℃下12000hg离心10 min,取上层水相移至EP管,并加入0.5 mL异丙醇,混匀,室温放置5 min;4 ℃下12000hg离心10 min,弃上清液收集沉淀,加1 mL预冷的75%乙醇溶液,温和振荡洗涤,真空干燥后加入20 µL经焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理过的去离子水溶解RNA。取少量RNA测量其浓度,按照试剂盒操作说明,其余RNA取适量进行反转录实验生成cDNA,以此为模板,进行RTFQ-PCR检测。PCR扩增条件:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 45 s,共40个循环(两步法)。所用引物序列:Nurr1基因上游为5’-TCCAACGAGGGGCTGTGCG-3’,下游为5’-CACTGTGCGCTTAAAGAAGC-3’;MDM2基因上游为5’-TTATTAAAGTCTGTTGGTGCA-3’,下游为5’-TGAAGGTTTCTCTTCCTGAAG-3’。实验重复3次。
1.9 蛋白质印迹法(Western blot)检测
将各组细胞培养皿中的液体吸净,用预冷的PBS洗3次,每皿加入1 mL放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液,置于冰上0.5 h,提取细胞总蛋白;取一部分蛋白裂解液,采用二辛可宁酸(bicinchoninic acid,BCA)法进行蛋白定量;配制10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离胶进行蛋白电泳(100 V,1 h),转膜采用湿转移法(80 V,2 h),封闭使用5%脱脂奶粉溶液(室温,1 h);一抗杂交(4 ℃过夜)的工作浓度:兔抗人P53抗体的稀释比为1∶2000,鼠抗人Nurr1抗体稀释比为1∶500,鼠抗人NLK抗体稀释比为1∶1000,鼠抗人MDM2抗体稀释比为1∶500,兔抗人β-actin抗体稀释比为1∶1000;二抗杂交(37 ℃ 1 h)的工作浓度为1∶20000;用含吐温-20磷酸缓冲盐溶液(phosphate-buffered saline with Tween-20,PBST)洗膜3次,使用Odyssey双色红外荧光成像仪扫描成像[14]。实验重复3次。
1.10 免疫共沉淀法
RWPE-1细胞转染pcDNA3.1-P53质粒。由于转染了P53的细胞增殖速度减慢,本实验使用6孔板同时转染6孔后,收集所有细胞再接种于10 cm培养皿中,培养至细胞生长密度接近于铺满皿底;吸除培养液,用预冷的PBS洗涤细胞;加入1 mL预冷的RIPA裂解液,用移液器吸嘴不断吹打,并用细胞刮刮净皿底细胞,移至Eppendorf试管中,冰上继续裂解15 min;4 ℃下14000hg离心15 min,取上清液移至Eppendorf试管中;将蛋白A琼脂糖珠与PBS以1∶1的体积比混合制成工作液;向装有蛋白提取液的Eppendorf试管中加入100 µL蛋白A琼脂糖珠工作液,4 ℃下缓慢摇动10 min;4 ℃下14000hg离心15 min,取上清液移至Eppendorf试管中;向Eppendorf试管中加入一抗(鼠抗人Nurr1抗体2 µg或兔抗人P53抗体1 μg),反应总体积为0.5 mL,4 ℃下缓慢摇动过夜;向装有抗原抗体复合物的Eppendorf试管中加入100 µL蛋白A工作液,4 ℃下缓慢摇动12 h;4 ℃下14000hg离心5 s,收集沉淀,用预冷的PBS洗2遍后,进行Western blot检测,实验流程同1.9[14]。
1.11 细胞免疫荧光法
RWPE-1细胞转染pcDNA3.1-P53后接种于共聚焦培养皿中,贴壁生长后吸除培养液用PBS洗涤3次,用固定剂4%多聚甲醛溶液室温下作用20 min;PBS洗涤3次,用透膜剂0.5%Triton X-100室温下作用10 min;PBS洗涤3次,用封闭液5%牛血清白蛋白室温下作用1 h;加入鼠抗人Nurr1抗体(1∶100)及兔抗人P53抗体(1∶100),4 ℃下温育过夜;加入Cy3标记的羊抗鼠二抗(1∶1000)及FITC标记的羊抗兔二抗(1∶1000),37 ℃下温育2 h,PBS洗涤3次后,使用激光共聚焦显微镜扫描成像[14]。
1.12 统计学处理
实验均重复3次,采用SPSS 13.0软件对数据进行分析,计量资料以xfs表示;两独立样本间比较采用t检验,多组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 NLK对前列腺炎-癌转化模型细胞RWPE-1/ THP-1的增殖和转化能力的影响
为探讨NLK在前列腺炎-癌转化中的作用,构建了稳定转染pcDNA3.1-NLK或shRNA-NLK质粒的RWPE-1细胞株,即RWPE-1(NLK↑)或RWPE-1(NLK↓)。Western blot检测结果显示,与亲本细胞RWPE-1组相比,RWPE-1(NLK↑)组的N L K 蛋白水平显著上调,而RW P E-1(NLK↓)组的NLK蛋白水平显著下调,满足后续建立细胞模型进行相互比较的需要(图1A)。
MTT实验检测结果显示,接种后的48及72 h,RWPE-1/THP-1组的D值显著高于RWPE-1组(P<0.01);与RWPE-1/THP-1组相比,RWPE-1(NLK↑)/THP-1组的D值显著降低,而RWPE-1(NLK↓)/THP-1组的D值显著升高(P<0.05,图1B)。
集落形成实验显示,RWPE-1组的集落数为0,RWPE-1/THP-1组、RWPE-1(NLK↑)/THP-1组和RWPE-1(NLK↓)/THP-1组的集落数分别为(15.67f 3.05)、(5.67f 2.52)和(23.67f 2.08)个。与RWPE-1组相比,RWPE-1/THP-1组的集落数显示从无到有的差异性。与RWPE-1/THP-1组相比,RWPE-1(NLK↑)/THP-1组的集落形成能力显著降低,而RWPE-1(NLK↓)/THP-1组的集落形成能力显著升高(P<0.05,图1C)。

图1 NLK对模型细胞增殖和转化能力的影响Fig.1 Effect of NLK on the proliferation and transformation of model cells
2.2 NLK对前列腺炎-癌转化模型细胞RWPE-1/ THP-1的NF-κB转录活性的影响
双荧光素酶报告基因分析检测结果显示,RWPE-1组的相对活性数值为1.09f 0.37,RWPE-1/THP-1组、RWPE-1(NLK↑)/THP-1组和RWPE-1(NLK↓)/THP-1组的相对活性数值分别为13.54f 2.19、7.04f 2.04和19.94f 2.2.69(图2)。与RWPE-1组相比,RWPE-1/THP-1组的NF-κB转录活性明显升高(P<0.01)。与RWPE-1/THP-1组相比,RWPE-1(NLK↑)/THP-1组相比的NF-κB转录活性显著降低,而RWPE-1(NLK↓)/THP-1组的NF-κB转录活性显著升高(P<0.05)。
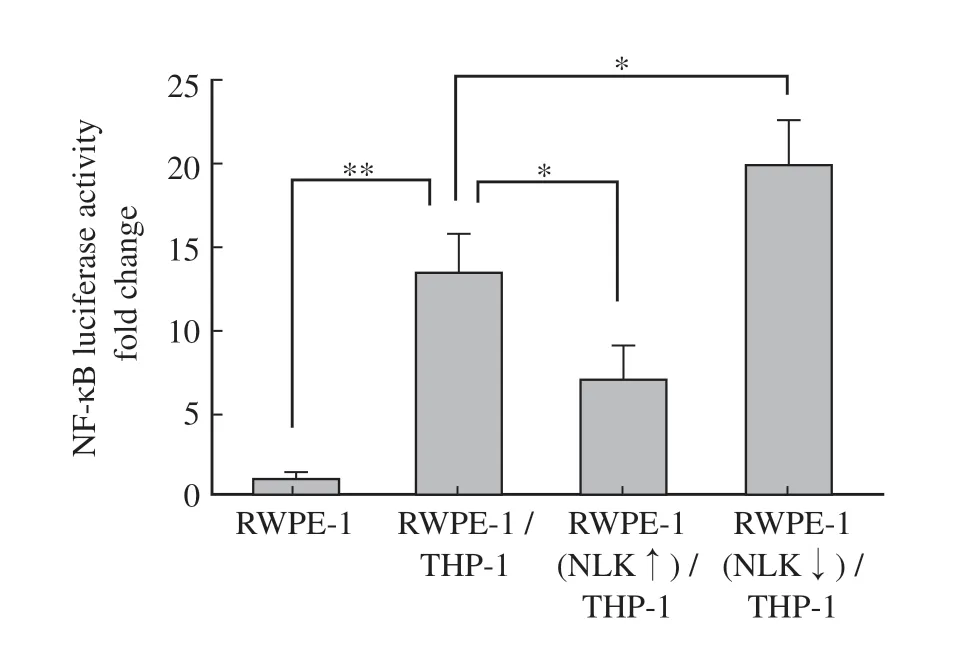
图2 NLK对模型细胞NF-κB转录活性的影响Fig.2 Effect of NLK on the NF-κB transcriptional activity in model cells
2.3 NLK对前列腺炎-癌转化模型细胞RWPE-1/THP-1的Nurr1、MDM2 mRNA表达及蛋白水平的影响
RTFQ-PCR结果显示,与RWPE-1组相比,RWPE-1/THP-1组细胞Nurr1、MDM2 mRNA表达均显著升高(P<0.01,图3A)。与RWPE-1/THP-1组相比,RWPE-1(NLK↑)/THP-1组Nurr1、MDM2 mRNA表达均显著降低,而RWPE-1(NLK↓)/THP-1组Nurr1、MDM2 mRNA表达均显著升高(P<0.05)。

图3 NLK对模型细胞Nurr1、MDM2 mRNA和蛋白质表达水平的影响Fig.3 Effect of NLK on the expression levels of Nurr1 and MDM2 mRNA and protein in model cells
Western blot结果显示,与RWPE-1组相比,RWPE-1/THP-1组细胞Nurr1、MDM2蛋白水平均显著升高(P<0.01,图3B)。与RWPE-1/THP-1组相比,RWPE-1(NLK↑)/THP-1组Nurr1、MDM2蛋白水平均显著降低,而RWPE-1(NLK↓)/THP-1组Nurr1、MDM2蛋白水平均显著升高(P<0.05)。蛋白水平的变化趋势与mRNA相同。
2.4 NLK对前列腺炎-癌转化模型细胞RWPE-1/ THP-1中P53蛋白水平的影响
由于RWPE-1细胞中P53含量低,不利于比较NLK与P53蛋白降解的相关性,因此各组细胞检测前48 h均转染等量P53表达质粒。Western blot的检测结果显示,与RWPE-1组相比,RWPE-1/THP-1组细胞的P53蛋白水平显著降低(P<0.05,图4)。与RWPE-1/THP-1组相比,RWPE-1(NLK↑)/THP-1组的P53蛋白水平显著升高,而RWPE-1(NLK↓)/THP-1组的P53蛋白水平显著降低(P<0.05)。

图4 NLK对模型细胞的P53蛋白水平的影响Fig.4 Effect of NLK on P53 protein levels in model cells
2.5 Nurr1与P53在RWPE-1细胞中的相互作用
RWPE-1细胞转染P53表达质粒48 h后,采用免疫共沉淀法进行检测,结果显示,通过免疫共沉淀,使用抗Nurr1抗体可以捕获P53蛋白,相反,使用抗P53抗体也能捕获Nurr1蛋白(图5),提示在RWPE-1细胞中Nurr1蛋白与P53蛋白之间可能存在相互作用。

图5 Nurr1与P53在RWPE-1细胞中的相互作用Fig.5 The interaction between Nurr1 and P53 in RWPE-1 cells
2.6 Nurr1蛋白与P53蛋白在RWPE-1细胞中的表达定位
RWPE-1细胞转染P53表达质粒48 h后实施细胞免疫荧光实验,Nurr1蛋白与P53蛋白的表达及定位情况通过激光共聚焦显微镜进行观察。结果显示,绿色荧光标记的P53蛋白及红色荧光标记的Nurr1蛋白均主要分布于RWPE-1细胞核,且两种蛋白的荧光可发生部分叠加,显示黄色(图6),提示Nurr1蛋白和P53蛋白可能共定位于RWPE-1细胞核内。

图6 Nurr1与P53蛋白在RWPE-1细胞中的表达定位Fig.6 The co-localization of Nurr1 and P53 in RWPE-1 cells
3 讨论
建立前列腺炎-癌转化模型是探讨前列腺癌变机制不可或缺的研究手段。一个经典的建模方法是先通过将正常前列腺上皮细胞与THP-1细胞共培养获得条件培养基,再用该培养基长时间培养正常前列腺上皮细胞,模拟炎症微环境,最终诱导其恶性转化[15]。本研究采用RWPE-1和THP-1细胞共培养技术建立了前列腺炎-癌转化细胞模型,结合NLK基因敲低或过表达,探讨NLK在前列腺炎-癌转化过程中所发挥的生物学功能。软琼脂集落形成实验等结果证明了在模拟炎症微环境培养基的培养下,RWPE-1细胞可发生恶性转化,说明该前列腺炎-癌转化细胞模型的建立是成功的,并且NLK对这一恶性转化过程发挥出显著的抑制作用。进一步的机制研究显示,发生恶性转化的RWPE-1细胞的NF-κB转录活性显著增强,其靶基因Nurr1和MDM2的转录表达上调,同时,P53的蛋白水平相应地降低。NLK基因的敲低可放大上述效应,反之,NLK的过表达可抑制上述效应。可见,NLK在炎-癌转化过程中分别对NF-κB和P53信号发挥相反的调节作用。
关于NLK对NF-κB信号转导通路的调节,已有研究证明NLK可通过干扰TAK1激酶对IKK的激活,使NF-κB蛋白的核转位受到抑制从而导致活性降低[16,17]。而在本课题组之前的研究[9]中,NLK的敲低对NF-κB蛋白的核转位仅有较弱的促进作用,上调NF-κB的转录活性主要依赖于对CBP转录共激活功能的影响。这可能是由于在前列腺组织细胞中NLK蛋白大多分布在细胞核中,因而主要在细胞核中发挥作用,提示在前列腺炎-癌转化过程中,NLK是NF-κB转录功能激活的细胞核内限速步骤,是防止NF-κB过度活化的重要调节分子。
MDM2作为一个癌基因,是调控P53蛋白水平的关键因子,且其转录表达受NF-κB的调控。本研究中,NLK的敲低能引起炎-癌转化模型细胞中P53蛋白水平显著降低而MDM2的转录表达水平显著升高。以此推断,NLK可能从两方面维持P53蛋白水平:①通过抑制NF-κB转录活性从而下调MDM2水平;② 直接作用于MDM2蛋白本身从而抑制其对P53的促降解作用。此外,有研究[18]表明,Nurr1可与P53蛋白第293~393位氨基酸区域结合并抑制其功能,而本研究的细胞免疫荧光及免疫共沉淀实验的结果也证实在RWPE-1细胞中Nurr1与P53蛋白存在相互作用。由此可见,在前列腺炎-癌转化过程中,NLK还可能通过抑制NF-κB转录活性下调Nurr1水平,进而减轻对P53功能的抑制作用。
癌变是一个复杂的生物学过程,但其最基本的模式可概括为促癌因子的激活和抑癌因子的失活。在机体正常组织细胞中,两类因子的活性及生物学影响处于一定的平衡状态,而一旦平衡向促癌因子倾斜就容易诱发癌变。NF-κB和P53就是相互拮抗、密切联系的两类因子。两者之间的相互影响在多数肿瘤的发病机制中发挥关键作用,也是调控肿瘤发展各个阶段的分子基础,并参与到癌症相关的多个重要途径,包括肿瘤细胞代谢、促炎活性、DNA损伤、线粒体功能和ATP生成等[19-20]。通过本研究,我们对NLK影响前列腺炎-癌转化过程可以作出这样的解读:促炎因子活化NF-κB信号转导通路,促进其核转位;NLK的蛋白水平降低使入核的NF-κB转录功能进一步活化;NF-κB转录功能活化可上调靶基因MDM2的表达,协同NLK水平的降低,导致MDM2的作用增强,进而促进P53蛋白降解;NF-κB转录功能活化还上调靶基因Nurr1的表达,Nurr1发挥竞争性抑制作用,与P53结合从而抑制其活性。概括地说,NLK的蛋白水平降低导致NF-κB进一步活化,增强其促癌功能,并通过NF-κB/P53信号转导通路下调P53蛋白水平及直接结合抑制,依靠对双方生物学作用的相反调节使“NF-κB/P53平衡”显著地倾斜于促癌效应,诱发前列腺癌变。
综上所述,本研究阐述了NLK在前列腺炎-癌转化过程中的作用及对“NF-κB/P53平衡”的“此消彼长”调控方式,为应用抗炎新策略预防前列腺癌提供新的探索思路。下一步研究将建立前列腺炎-癌转化动物模型,探讨NLK在活体内的作用和机制。
利益冲突声明:所有作者均声明不存在利益冲突。
——一道江苏高考题的奥秘解读和拓展

