程序性死亡[蛋白]-1抑制剂诱导小鼠心肌炎模型的建立
陈怡帆,程蕾蕾,沈毅辉,张 卉,汪雪君,许宇辰,葛均波
1.复旦大学附属中山医院心内科,上海 200032;
2.上海市心血管病研究所,上海 200032;
3.国家放射与治疗临床医学研究中心,上海 200032;
4.复旦大学附属中山医院心脏超声诊断科,上海 200032
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)已成为恶性肿瘤治疗的新热点[1],但也诱发了以ICI相关心肌炎(ICIassociated myocarditis,ICIAM)为代表的免疫相关不良反应[2],其发生率虽仅为0.21%~3.30%,但死亡率却高达27.0%~67.0%,居免疫相关不良反应之首[2-4]。程序性死亡 [蛋白]-1(programmed death-1,PD-1)抑制剂是应用最广的ICI,其诱发的ICIAM已成为肿瘤治疗不可忽视的问题[5],亟待通过动物模型探究治疗靶点。既往的小鼠心肌炎症损伤模型均存在成模率低、病变范围小、造模方式与临床治疗方案差异大等问题[6-10],尚未有成熟的PD-1抑制剂诱导的自身免疫性心肌炎模型。因此,本实验拟建立一种能模拟PD-1抑制剂诱导的自身免疫性心肌炎发病过程的小鼠模型,为其机制研究及药物筛选评价奠定基础。
1 材料和方法
1.1 实验动物
30只6周龄健康雄性BALB/c小鼠,体重(22.5f 2.5)g(南京卡莱斯生物科技有限公司,生产许可证号:320114000129353)。本实验经复旦大学附属中山医院伦理委员会批准,实验操作符合3R原则。
1.2 动物分组及模型建立
30 只小鼠编号并随机分为3 组:对照组(control组)、自身免疫性心肌炎组(TnⅠ组)和ICI相关心肌炎组(TnⅠ+anti-PD-1组),每组10只。除control组外,分别于第1、7天给小鼠皮下注射0.1 mL含有0.25 mg小鼠TnⅠ[生工生物工程(上海)股份有限公司,设计序列:HARVDKVDEERYDVEAKVTKNITEIADLTQKI YDLRGKFKRPTLRRVRIS]肽段的完全弗氏佐剂(美国Sigma公司)。TnⅠ+anti-PD-1组自第7天起,按每次5 mg/kg给予腹腔注射PD-1抑制剂(InVivoMab anti-mouse PD-1),每2 d给药1次,共5次,累积剂量为25 mg/kg。Control组每次给予与TnⅠ+anti-PD-1组同等剂量的生理盐水腹腔注射。本研究使用的TnⅠ(0.25 mg)和anti-PD-1剂量(每次5 mg/kg)是基于已发表的研究[7,11]。各组于造模第1、21、56天检测心脏功能和分子水平变化。
1.3 一般状态
造模前:分别给小鼠称重。造模后:记录小鼠每日进食量,观察其一般情况变化,记录死亡情况。
1.4 心脏指数
第56天将小鼠全部处死,开胸,沿主动脉根部游离出心脏,用手术剪将大血管残端、筋膜和脂肪组织剔除,分离出全心,灌注预先配制好的磷酸盐缓冲盐溶液(phosphate-buffered saline,PBS)冲去残留血液,滤纸吸水,分析天平称量全心湿质量,计算心脏指数(cardiac index):心脏指数=全心湿质量(mg)/小鼠体重(g)。
1.5 二维超声心动图
第1、56天用Vevo2100超声系统(加拿大Visual Sonics公司)进行二维超声心动图检查,采用30 MHz高频扫描探头采集图像。小鼠吸入异氟烷麻醉后平卧,胸前区备皮。在胸骨旁左室长轴切面左室内径最大处显示M型图像,连续采集15 s,分析左心室射血分数(ejection fraction,EF)。
1.6 病理学检查
第56天将小鼠处死后,小鼠心脏用10%多聚甲醛溶液固定24 h,用石蜡包埋,然后制成厚5 μm的水平切片。用H-E染色,选取光镜下的代表性图像(放大40倍)进行分析。出现以下病理学特征之一可被判定为发生心肌炎:急性心肌炎期,心外膜下及心肌间质弥漫性炎症细胞浸润,心肌细胞坏死和间质水肿[12];扩张型心肌病期,心肌细胞边界模糊、纤维紊乱,细胞核排列不规则,部分细胞核固缩、碎裂,心肌间质空泡样改变[13]。
小鼠肺、肝脏、肾脏、小肠分别用10%多聚甲醛溶液固定24 h,用石蜡包埋,然后制成5 μm厚的水平切片。分别进行H-E、Masson染色并选取光镜下的代表性图像(放大40倍)进行分析。出现以下病理学特征之一可被判定为发生TnⅠ、PD-1对其他器官的损害:出现弥漫性炎症细胞浸润,间质水肿、空泡样改变、纤维化增加,细胞坏死和细胞核固缩、碎裂[13]。
1.7 血清生物标志物
第56天眼眶取500~1000 μL血液,2000hg离心20 min,取上清液300 μL,24 h内用酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒(武汉云克隆科技股份有限公司,SEA109Mu,MEA479Mu)检测血清肌酸激酶(creatine kinase,CK)和CK同工酶(CK isoenzyme,CK-MB)。
1.8 统计学处理
所有数据均用xfs表示。多组间比较采用单因素方差分析(ANOVA),使用Graphpad Prism 8.0软件进行Turkey法检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
造模前control组、TnⅠ组和TnⅠ+anti-PD-1组小鼠体重分别为(22.4f 1.6)、(21.8f 1.8)和(22.4f 1.2)g,各组间差异无统计学意义(P>0.05);造模第21、56天,与control组相比,TnⅠ组和TnⅠ+anti-PD-1组的体质量均显著下降 [第21天:(22.8f 1.5)gvs(19.5f 1.2)和(18.7f 1.0)g,P均<0.05;第56天:(22.7f 1.4)gvs(19.0f 1.3)和(17.1f 0.4)g,P均<0.01],且TnⅠ+anti-PD-1组较TnⅠ组的体质量也显著下降 [第21天:(18.7f 1.0)gvs(19.5f 1.2)g,P<0.05;第56 天:(17.1 f 0.4)gv s(19.5f 1.2)g,P<0.05,图1A]。
造模开始后,与control组相比,TnⅠ组和TnⅠ+anti-PD-1组进食量均显著下降 [第21天:(4.7f 0.2)gvs(4.0f 0.3)g,P<0.05,(4.7f 0.2)gvs(3.5f 0.1)g,P<0.01;第56天:(4.8f 0.2)gvs(3.4f 0.1)g,P<0.05,(4.8f 0.2)gvs(2.4f 0.2)g,P<0.01,图1 B],伴精神状况差、活动强度减弱,TnⅠ+anti-PD-1组更严重。Control组至第56天均无小鼠死亡;TnⅠ组至第21天无小鼠死亡,死亡率为0%,与control组相比,差异无统计学意义(P>0.05),第56天累计1只死亡,死亡率为10%,与control组相比,差异有统计学意义(P<0.05)。TnⅠ+anti-PD-1组第21天累计1只死亡,死亡率为10%,第56天累计2只死亡,死亡率为20%,与control组相比,差异均有统计学意义(P<0.05,P<0.01,图1C)。
2.2 心脏指数
第56天将小鼠全部处死,分离全心并称量心脏湿质量,计算各组心脏指数。第56天,与control组相比,TnⅠ组的心脏指数未显著增加[(4.6f 0.2)mg/gvs(4.4f 0.2)mg/g,P> 0.05],而TnⅠ+anti-PD-1组的心脏指数显著增加 [(5.4f 0.1)mg/gvs(4.4f 0.2)mg/g,P<0.05,图1D]。

图1 小鼠一般状态、死亡率及心脏指数Fig.1 General status,mortality and cardiac index of mice
2.3 二维超声心动图
采用Vevo2100超声系统对小鼠进行二维超声心动图检查。图2A为造模第56天扩张型心肌病期典型M型超声图像。与control组相比,TnⅠ+anti-PD-1组的左心室EF显著下降(45.3%f 5.2%vs63.7%f 4.6%,P<0.001),且较TnⅠ组下降更显著(58.6%f 2.8%vs63.7%f 4.6%,P<0.01,图2B)。
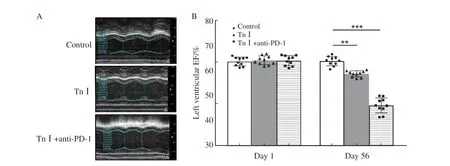
图2 扩张型心肌病期典型M型超声心动图图像及左心室EFFig.2 Typical M-mode echocardiographic images and left ventricular EF during dilated cardiomyopathy stage
2.4 心肌病理学改变
造模第21、56天分别取小鼠心脏以多聚甲醛溶液固定、石蜡包埋、切片行H-E染色。每组1只小鼠的典型病理学切片如图3所示。
第21天急性心肌炎期:control组心肌细胞排列整齐、组织致密,该组10只小鼠均具有此特征;TnⅠ组见心外膜下少量炎症细胞浸润,细胞形态结构尚完整,该组9只小鼠具有此特征;TnⅠ+anti-PD-1组心外膜下大量炎症细胞浸润,细胞边界不清、坏死,间质水肿形成,该组10只小鼠均具有此特征,死亡的1只小鼠病理学改变最典型(图3)。
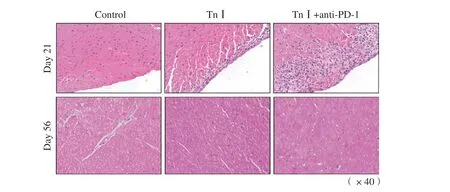
图3 心肌H-E染色Fig.3 H-E staining of myocardium
第56天扩张型心肌病期H-E染色:control组心肌细胞仍排列整齐、形态正常,该组10只小鼠均具有此特征;TnⅠ组较第21天,浸润的急性炎症细胞明显减少,但心肌细胞有轻度边界不清、间质空泡化,该组10只小鼠均具有此特征,死亡的1只小鼠该改变最典型;TnⅠ+anti-PD-1组急性炎症细胞浸润减少,但细胞边界不清、纤维紊乱、间质空泡化更显著,部分细胞核呈异形、多核、核固缩、碎裂等病理学改变,该组9只小鼠具有此特征,其中死亡的2只小鼠病理学改变更显著(图3)。
2.5 其他器官病理
造模第56天分别取小鼠肺、肝脏、肾脏、小肠,以多聚甲醛溶液固定、石蜡包埋、切片行H-E、Masson染色。每组1只小鼠的典型病理学切片如图4所示。Control组和TnⅠ+anti-PD-1组肺、肝脏、肾脏、小肠的细胞排列规则、形态基本正常,无明显炎症细胞浸润和间质水肿、纤维化增加,无明显细胞坏死及细胞核固缩、碎裂,control组和TnⅠ+anti-PD-1组的10只小鼠均具有以上特征。H-E染色下,TnⅠ组肺、肝脏、肾脏、小肠则出现不同程度的炎症细胞浸润,细胞排列及形态紊乱,相比于以上两组,出现明显间质水肿、空泡样改变,以及细胞坏死和核固缩、碎裂;Masson染色下,各器官出现较明显的纤维增生性改变,TnⅠ组的10只小鼠均具有以上特征。

图4 其他器官H-E和Masson染色Fig.4 H-E and Masson staining of myocardium
2.6 血清生物标志物
第56天各组小鼠眼眶取血,2000×g离心20 min,取上清液检测CK和CK-MB水平。与control组相比,TnⅠ+anti-PD-1组小鼠血清CK和CK-MB显著升高 [CK:(2833.0f 115.7)U/Lvs(1025.0f 74.8)U/L;CK-MB:(86.4f 2.6)U/ Lvs(40.3f 3.5)U/L,P均<0.001],且较TnⅠ组升高更显著 [CK:(2833.0f 115.7)U/Lvs(1578.0f 99.7)U/ L,P<0.01;CK-MB:(86.4f 2.6)U/Lvs(58.8f 5.6)U/L,P<0.05,图5]。
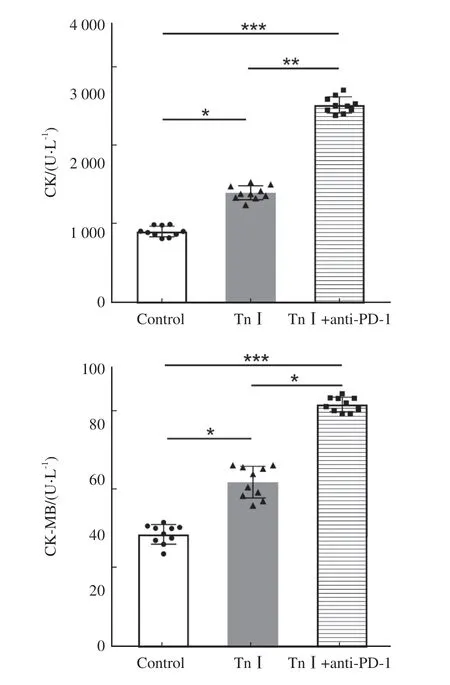
图5 血清生物标志物Fig.5 Serum biomarkers
3 讨论
防治PD-1抑制剂诱发的ICIAM是免疫治疗的热点[14],小鼠模型具有简单、经济、重复性高的特点。因此,建立模拟PD-1抑制剂诱导心肌炎发病的小鼠模型,是促进其机制研究及药物筛选评价的有效方法。
目前已有小鼠自身免疫性心肌炎模型和PD-1抑制剂诱导的心肌损伤模型。其中,第一种多以重组肌球蛋白重链-α诱导[9]、直接细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)和PD-1基因敲除[15]、柯萨奇病毒感染[16]构建,但其大多只能建成急性心肌炎模型,未能模拟出慢性期心脏扩张、纤维结构紊乱等特点,成模率不足60%,心肌病变范围仅15%~40%,甚至有脾脏、胰腺等免疫反应强于心脏本身的情况[15],且成本高、重复性差、与临床PD-1抑制剂给药方法差异大[9,11,15],这些均极大地干扰了模型的有效性评估。第二种虽成模率能达到70%~90%,但通常需与程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)抑制剂联合、短时间大剂量给药(6~10 d,每天各5~10 mg/kg),难以反映真实的ICIAM用药和发病过程,其心肌损伤程度较第一种模型更轻,心肌病变面积仅为10%~20%,血清心肌酶波动常无显著差异[7,17],与部分患者能由PD-1抑制剂诱发3~4级免疫性心肌炎差距大。综上,这两种模型均不是模拟人类ICIAM发病过程及特点的理想模型。
PD-1抑制剂多以每2 d给药5~10 mg/kg以模拟临床治疗方案,但其累积剂量超过30 mg/kg时小鼠急性炎症期的死亡率高达40%,且造成广泛的肺、肠、肾、肝等靶器官外急性炎症浸润,严重影响造模成功率[7,18]。TnⅠ是引起ICIAM的主要自身免疫反应抗原,有研究[11]曾以2次0.25 mg TnⅠ皮下注射构建自身免疫性心肌炎模型。构建小鼠TnⅠ肽段诱导自身免疫性心肌炎,再以PD-1抑制剂强化,有望增加成模率,减少靶器官外损伤。因此,本实验采用的造模方案为:每次5 mg/kg腹腔注射PD-1抑制剂,每2 d给药1次,共持续5次,累积剂量25 mg/kg,同时辅以2次0.25 mg TnⅠ诱导,既可以使小鼠生物学变化更接近患者的真实情况,又可以避免短时大量给药而增加死亡率。小鼠体重、进食和死亡率是评价其一般状态和造模成功率的重要指标[19],TnⅠ+anti-PD-1组在急、慢性心肌炎期体重和进食情况下降更显著,提示在TnⅠ诱发自身免疫心脏损伤的同时,ICI更加重了此损伤,与小鼠死亡率随anti-PD-1累积剂量增加而上升的趋势相近。尽管如此,本方法anti-PD-1组小鼠死亡率仍不高于20%,保证了造模成功率。
左心室EF是心功能评估较重要的指标之一,有研究[20]报道,PD-1抑制剂诱发ICIAM致左心室EF下降。TnⅠ+anti-PD-1组左室EF下降较TnⅠ组更显著,提示PD-1抑制剂不仅能在有TnⅠ等心肌炎诱发基础的环境下诱导ICIAM,更可能下调免疫负反馈通路,加重炎症和心肌损伤。心脏指数的变化也为此提供了佐证,心脏指数能直接反映心肌增生肥厚并间接提示心室重构、左心功能不全[21]。TnⅠ组该指数无显著增加,而TnⅠ+anti-PD-1组则显著增加,进一步证明了联用TnⅠ和anti-PD-1能造成更典型的自身免疫性心肌损伤。
H-E染色是评估心肌细胞形态变化、判断炎症细胞浸润的重要手段[22]。既往自身免疫性心肌炎模型以心肌坏死、间质水肿、小簇状单核细胞和CD62L-CD4+T细胞、CD3+CD8+T细胞、CD68+巨噬细胞的浸润为特征,未见明显心肌纤维化[8-9]。PD-1抑制剂诱导的心肌损伤模型也仅见4%~8%的间质性心肌纤维化[7,10]。本研究模型的心肌病理学改变与上述两种模型差异较大,除能观察到大量急性炎症细胞浸润,还能继续随访慢性扩张型心肌病期的特点,TnⅠ+anti-PD-1组无论急、慢性心肌炎期细胞形态异常都最显著,尤其是出现心肌纤维紊乱、空泡化等慢性特征性改变。CK和CK-MB在心肌损伤的全程中都可维持较高水平[23]。本研究模型在慢性期仍有明显的CK和CK-MB升高,提示联合用药造成显著而长期的心肌损伤,这是既往模型不具备的,突出了本研究模型的长期稳定性和有效性。
本研究探索出一种全新的、效果良好的小鼠自身免疫心肌炎模型的构建方法。通过给予小鼠腹腔注射PD-1抑制剂和皮下注射经特殊设计的小鼠TnⅠ肽段来构建模型,并确定了合理而成熟的剂量和给药间隔,有效地提高了建模的成功率和稳健性,且方法简单易行,便于推广。同时,也为ICIAM发病机制研究、治疗药物筛选、药物疗效评价提供了经济实用的实验对象。
本研究模型仍存在一定的局限性。首先,剂量关系上,不同的单次给药和累积给药剂量对各评价指标的影响需进一步探索,以模拟临床PD-1抑制剂多种治疗方案的心肌损伤效果。其次,时间关系上,指标采集点时间间隔较长,可设置更多采集点,以评估各指标随时间推移的动态的变化趋势。
本实验建立了一种PD-1抑制剂诱导的、低死亡率的小鼠心肌炎模型,以心肌急慢性自身免疫炎性改变、左心室EF下降、心肌酶谱升高为突出特征。同时,设计合成了一种特殊的小鼠心肌TnⅠ肽段,强化了PD-1抑制剂的造模效果。
利益冲突声明:所有作者均声明不存在利益冲突。

