陆地棉ACX 基因家族的鉴定与功能分析
田一波,潘奥,陈劲,周仲华,袁小玲,刘志
(湖南农业大学生物科学技术学院,长沙 410128)
20 世纪初以来, 全球平均气温上升了约1.5 ℃,且将来温度会持续升高[1]。 随着全球气候的变暖,高温逆境已成为影响棉花产量的重要非生物胁迫因素之一, 因此鉴定高温耐性相关基因,进而培育耐高温棉花品种尤为重要。
研究表明, 高温影响棉花和小麦脂肪酸代谢, 导致花药发育异常, 甚至造成雄性不育[2-3]。Chen 等[4]运用转录组和小RNA 测序技术深入分析了棉花花药发育过程中的表达谱变化及其对高温胁迫的响应,发现脂肪酸代谢在花药发育及育性表现上有重要作用。 随后,在耐高温与敏感棉花材料不同发育时期的花药显著性差异表达的基因中鉴定到一个与高温耐性相关的酰基(脂酰) 辅酶A 氧化酶 (acyl coenzyme A oxidase,ACX)基因[5]。 ACX 与3- 酮酰基- 辅酶A 硫解酶(硫解酶)和多功能蛋白烯酰基- 辅酶A 水合酶/3- 羟基酰基辅酶A 脱氢酶是高等植物过氧化物酶体中脂肪酸β 氧化(β-oxidation)的代谢酶[6],而脂肪酸β 氧化是生长发育过程中快速降解储备脂质以提供碳源和能量的主要代谢途径[7],其中ACX 是该途径中催化第1 步反应的限速酶[8]。植物中存在多种ACX 同工酶, 其大小及亚基组成不同,且具有底物(短链、中链和长链脂肪酸)特异性。 Hooks 等[9]首先在玉米中鉴定到2 个ACX,发现其活性受生长发育和代谢调控,且具有组织特异性。拟南芥(Arabidopsis thaliana)中的5 个ACX 分别催化不同碳链长度脂肪酸的降解,其中AtACX1和AtACX5基因参与茉莉酸(jasmonic acid, JA) 合成, 在雄蕊和花粉中高表达,与花药发育、花粉育性和逆境响应相关[10-11]。拟南芥acx4突变体中组蛋白乙酰化减少,而DNA 甲基化程度提高, 暗示该基因可能参与基因组表观修饰[12]。水稻OsACX1和OsACX3在除种子外的多种组织器官表达,而OsACX2在种子中优势表达, 其中OsACX1受损伤和JA 诱导表达,可能参与JA 的生物合成[13]。 番茄ACX1和茶树CsACX1与CsACX3也与JA 生物合成相关,参与损伤和病害应激反应[14-15]。
尽管人们在玉米[9]、水稻[13]和拟南芥[16]等植物中相继开展了关于ACX基因家族的全基因组鉴定和功能研究,但在棉花中未见该基因家族的相关报道。本研究基于陆地棉(Gossypium hirsutumL.)遗传标准系TM-1 基因组数据,利用生物信息学方法鉴定ACX基因家族成员,对其理化性质、染色体分布、基因结构、系统进化关系、基因复制以及表达模式等进行全面分析,并利用病毒诱导的基因沉默 (virus-induced gene silencing, VIGS)技术初步验证高温耐性相关的GhACX16基因的生物学功能, 为后续陆地棉中ACX基因功能的深入研究奠定基础。
1 材料与方法
1.1 棉花ACX 基因家族成员鉴定
在Pfam[17]数据库(http://pfam.xfam.org/)中搜索编号PF01756,下载ACOX 结构域的隐马尔可夫模型, 从棉花功能数据库(https://cottonfgd.org/)中下载异源四倍体陆地棉[18]、海岛棉[18](G.barbadenseL.)及二倍体亚洲棉[19](G.arboreum)、雷蒙德氏棉[20](G.raimondii)的全基因组数据,利用HMMER 3.0[21]中的Hmmsearch 功能比对得到ACX基因家族成员, 并在美国国家生物技术信息中心(NCBI)的Conserved Domain(CDD)[22]数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、SMART (http://smart.embl-heidelberg.de/)软件中进一步确定其保守结构域,鉴定ACX基因家族成员。 在拟南芥数据库TAIR10[23](https://www.Arabidopsis.org/)中下载拟南芥ACX基因家族成员蛋白序列[24],与棉花TM-1 基因组进行比对鉴定, 进一步搜索棉花中ACX基因家族成员。
1.2 陆地棉ACX 蛋白的理化性质、 亚细胞定位及保守基序预测分析
利用在线网站ExPASy[25](https://web.expasy.org/compute_pi/) 获得GhACX 蛋白的理论等电点和分子质量等信息。 利用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/) 进行亚细胞定位预测。 用MEME[26](http://meme-suite.org/)在线网站分析其保守基序,参数设置:最大查找数量为10,其他为默认参数;最后用TBtools[27]软件对其进行可视化处理。
1.3 系统进化树构建和基因结构分析
利用ClustalX 1.83[28]软件对陆地棉、亚洲棉、雷蒙德氏棉、海岛棉、拟南芥ACX基因家族成员的蛋白序列进行比对分析,采用IQ-TREE[29]软件搜索到最佳碱基替代模型LG+G4, 然后利用最大似然法(maximum likehood, ML)构建系统发育进化树,自展值设置为1 000。最后使用GSDS 2.0在线工具(http://gsds.gao-lab.org/)将基因结构可视化。
1.4 陆地棉ACX 基因的染色体定位和基因复制分析
从陆地棉基因组注释文件中提取ACX基因染色体位置信息,用MapChart 2.32[30]软件进行基因的染色体定位分析。利用软件MCScanX[31]检测陆地棉全基因组复制基因对,参数设置:蛋白比对E值小于1×e-10,至少75%序列相似度。 利用KaKs_Calculator 2.0[32]软件计算陆地棉复制基因对的非同义突变率(non-synonymous mutation rate,Ka)和同义突变率(synonymous mutation rate,Ks)以及二者的比值(Ka/Ks)。
1.5 陆地棉ACX 基因启动子区顺式作用元件分析
利用perl 脚本提取陆地棉ACX家族基因编码区(coding sequence, CDS)上游2 000 bp 序列作为启动子区域,将获得的序列在启动子预测网站PlantCARE[33](http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)中检索,鉴定启动子区顺式作用元件, 整理得到的文件信息,用TBtools[27]软件进行可视化展示。
1.6 陆地棉ACX 家族基因表达模式分析
从NCBI 的SRA 数据库[34](http://www.ncbi.nlm.nih.gov/sra/)中下载陆地棉TM-1 在非生物胁迫(37 ℃高温,4 ℃低温,0.4 mol·L-1NaCl 盐胁迫,200 g·L-1的PEG 6000 溶液模拟干旱胁迫)下的相关转录组测序数据, 序列号为PRJNA490626,高温胁迫下陆地棉花药转录组的序列号为SRP218740[4]。 利用fastap、hisat 和StringTie 等软件包分析转录组测序数据并进行表达量计算,提取ACX基因的表达数据,用log2(FPKM)将表达数据标准化处理后,利用R/pheatmap 将表达数据可视化。
1.7 陆地棉GhACX16 功能的初步验证
参照潘奥等[35]的方法,以陆地棉TM-1 为材料,通过VIGS 技术初步验证GhACX16的功能。菌种: 农杆菌GV3101; 烟草脆裂病毒(tobacco rattle virus, TRV)载体:病毒复制酶载体pYL192:RNA1;目的基因插入载体pYL156:RNA2-GhACX16 , 阳 性 对 照 载 体 pYL156 : RNA2-GrCLA1,阴性对照载体pYL156:RNA2。 试验所用引物信息参见附表1。
将棉苗置于光照14 h/ 黑暗10 h, 昼夜温度为28 ℃/25 ℃条件下培养。 待子叶完全展开时,分别将含pYL156:RNA2-GhACX16 重组载体的菌液和含有pYL192:RNA1 空载体的菌液按1∶1的比例混合均匀后对棉苗子叶进行接种。 当阳性对照棉苗叶片出现白化现象时,采集阴性对照和试验组的叶片进行实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR),选取Actin 9(AY305737)作为内参基因[36]。 采用2-ΔΔCt 法[37]计算目的基因的相对表达量。
在4 片真叶期, 将GhACX16基因沉默棉苗与阴性对照棉苗置于42 ℃培养箱中高温处理3 d,期间保证正常水分供应。 处理3 d 后基因沉默棉苗和阴性对照棉苗的表型出现明显差异时,取倒2~3 片真叶,使用Solarbio(索莱宝)公司试剂盒分别测定叶片中脯氨酸含量、 丙二醛含量、叶绿素含量和过氧化氢酶活性。 所有材料均是随机取样,每次试验设置至少3 次重复。
1.8 数据处理与统计分析
试验数据均使用SPSS Statistics 软件进行单因素方差分析(ANOVA),并根据分析结果使用GraphPad Prism 8 软件进行绘图。
2 结果与分析
2.1 陆地棉ACX 基因家族的鉴定
从陆地棉基因组中共鉴定出20 个ACX基因,分别命名为GhACX1~GhACX20。ACX家族基因的CDS 长度为1 302~2 070 bp, 编码的蛋白质含433~689 个氨基酸, 分子量为47.7~77.3 ku。 等电点为6.57~9.02,平均等电点为8.16,表明该家族蛋白偏碱性。 亚细胞定位预测结果显示,ACX 蛋白定位于过氧化物酶体中(附表2)。
陆地棉20 个ACX基因分布在13 条染色体上。A 亚组和D 亚组的ACX基因数量一样多,均有10 个; 大多数ACX基因分布在染色体两端;A01、A11、A12、D01、D09、D11,D12 染 色 体 均 存在2 个ACX基 因,A03、A09、A10、A13、D02、D10 染色体各存在1 个ACX基因(图1)。

图1 陆地棉ACX 家族基因染色体分布Fig. 1 Chromosome distribution of ACX genes in G. hirsutum
2.2 陆地棉ACX 系统发育进化分析
为了解陆地棉ACX家族成员的进化关系,分别从陆地棉、海岛棉、亚洲棉、雷蒙德氏棉和拟南芥中鉴定出20、20、11、11 和6 个ACX家族成员。 聚类结果显示,陆地棉、海岛棉、亚洲棉、雷蒙德氏棉和拟南芥的ACX家族成员都可分为4 个亚 族, 分 别 为Clade_I、Clade_II、Clade_III 和Clade_IV 亚族。 陆地棉和海岛棉的ACX家族基因在4 个亚族中的分布数量完全一致, 其中在Clade_I 和Clade_III 亚族中的数量最多, 各有6和8 个ACX成员,在Clade_II 亚族中均有4 个,而在Clade_IV 亚族中均只有2 个。 亚洲棉和雷蒙德氏棉中ACX家族基因在4 个亚族中的分布数量也完全相同,在Clade_I 和Clade_III 亚族中各有3 和4 个ACX成员,在Clade_II 和Clade_IV 亚族中均只有2 个ACX成员。拟南芥中ACX家族基因在Clade_I 和Clade_III 亚族中均有2个,而在Clade_II 和Clade_IV 亚族中均只有1 个(图2)。
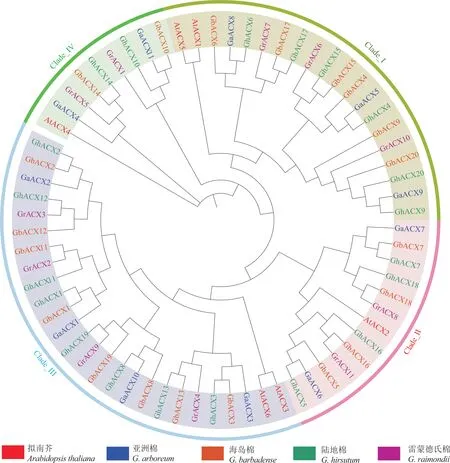
图2 ACX 家族成员的系统进化树Fig. 2 Phylogenetic tree of ACX family members
2.3 陆地棉ACX 基因的染色体复制分析
为了解陆地棉ACX基因的进化复制关系,对该家族成员进行了复制基因比对。 除GhACX2、GhACX10、GhACX14、GhACX20没 有 找 到 复 制的同源基因对外,共检测出20 个同源基因对(图3), 其中A 亚组有4 对同源基因 (蓝色连线:GhACX3/GhACX8、GhACX4/GhACX6、GhACX4/GhACX9、GhACX6/GhACX9),D 亚 组 有3 对(红色连线:GhACX11/GhACX13、GhACX13/GhACX19、GhACX15/GhACX17),A、D 亚组间有13 对(绿色连线:GhACX1/GhACX11、GhACX3/GhACX12、GhACX3/GhACX13、GhACX3/GhACX19、GhACX4/GhACX15、GhACX4/GhACX17、GhACX5/GhACX16、GhACX6/GhACX17、GhACX7/GhACX18、GhACX8/GhACX13、GhACX8/GhACX19、GhACX9/GhACX15、GhACX9/GhACX17)。这些同源基因对的Ka/Ks值均小于0.5 (附表3), 说明陆地棉ACX基因在进化过程中经历了较为强烈的纯化选择,暗示ACX基因进化保守,功能稳定。
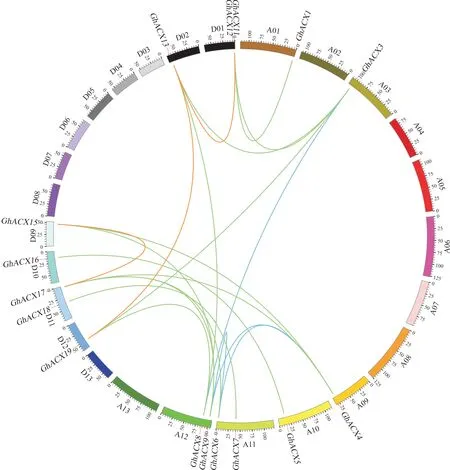
图3 陆地棉ACX 家族成员染色体分布和共线性关系Fig. 3 Chromosome distribution and collinearity of ACX family members in G. hirsutum
2.4 陆地棉ACX 蛋白保守基序和基因结构分析
经预测分析, 陆地棉ACX 蛋白序列含有10个保守基序, 其中motif 1、motif 2、motif 7、motif 10 存在于所有ACX 家族成员中, 说明这些基序为该家族成员的保守基序(图4A)。 Clade_I 亚族所有基因均含有14 个外显子;Clade_II 亚族中所有基因均含有7 个外显子;Clade_III 亚族中只有GhACX3有12 个外显子,其余基因都含有13 个外显子;Clade_IV 亚族基因均含有13 个外显子(图4B)。 陆地棉ACX基因家族有高度相似的蛋白基序和外显子数量, 说明陆地棉中ACX基因较为保守,可能具有相似的功能。
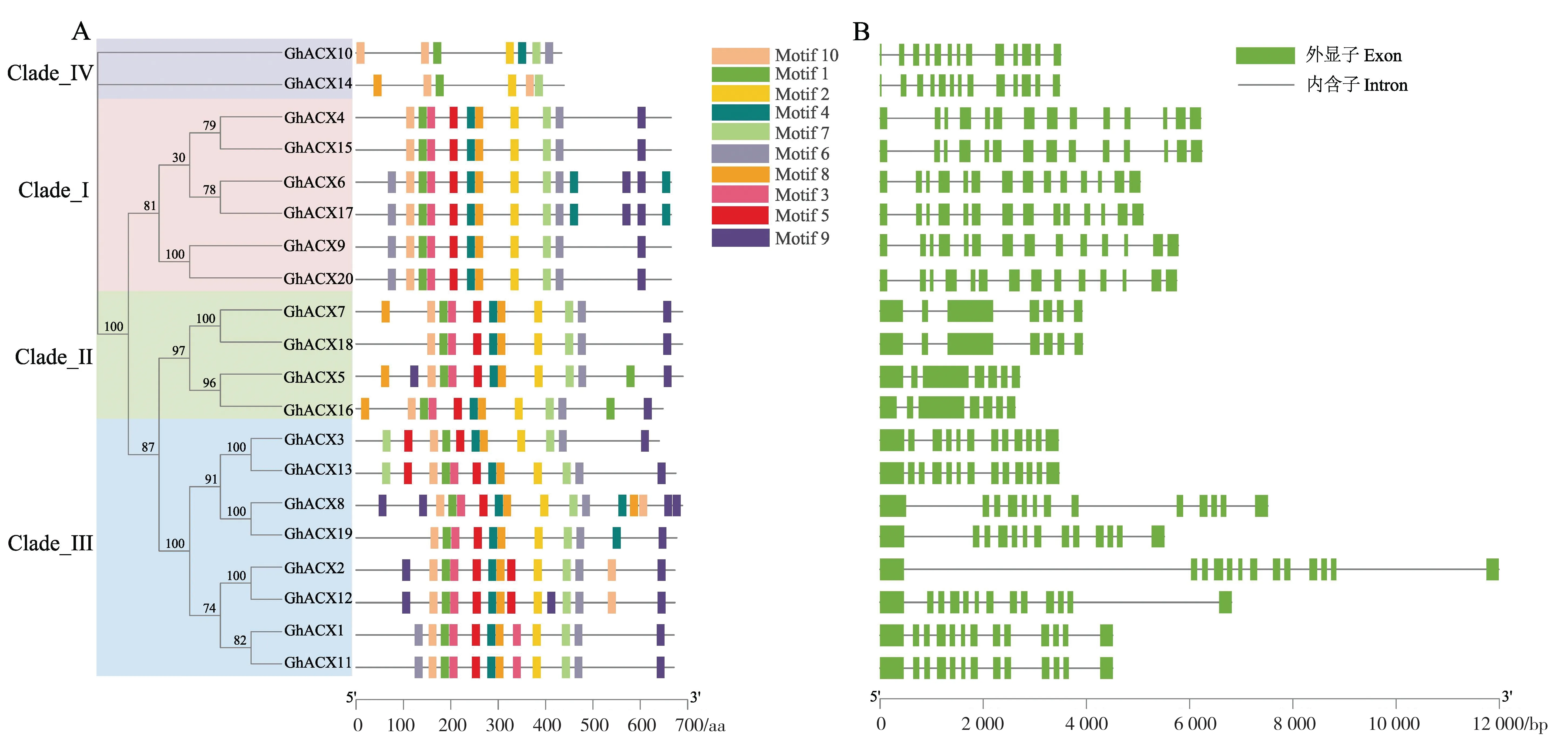
图4 陆地棉ACX 蛋白保守基序(A)和基因结构(B)Fig. 4 Conserved motifs (A) and gene structure (B) of ACX in G. hirsutum
2.5 陆地棉ACX 基因顺式作用元件分析
经预测, 陆地棉ACX基因启动子区含有热 应激(CCAAT-box、AT-rich element)、植物激素 (TGACG-motif、CGTCA-motif、TGA-element、GARE-motif、ABRE)、干旱(MBS、MYC)、光应答(P-box、G-box、AE-box、TCT-motif、GATA-motif)和 防 卫 与 胁 迫 响 应 (TC-rich repeats、W-box、MRE)等相关顺式作用元件(附图1)。 其中热应激 元 件 (AT-rich element) 存 在 于GhACX14、GhACX7、GhACX5、GhACX16和GhACX19的启动子区, 即该热响应元件主要集中在Clade_II亚族中,说明Clade_II 亚族可能在热响应中发挥重要作用。 干旱响应元件(MBS、MYC)和防御与胁迫响应调控元件(TC-rich repeats)存在于大部分陆地棉ACX基因的启动子区,且数量最多,暗示陆地棉ACX基因家族在胁迫响应中发挥作用。
2.6 陆地棉ACX 基因家族在不同胁迫处理下的表达模式分析
陆地棉ACX基因在不同胁迫处理下的表达分析结果 (图5) 显示:37 ℃高温处理1 h后,GhACX6、GhACX17、GhACX7、GhACX18、GhACX5、GhACX16、GhACX1和GhACX11的表达量明显升高;而在处理3 h 后,这6 个基因表达量降低,随后又升高。 4 ℃冷胁迫处理1 h后,GhACX10、GhACX6、GhACX17、GhACX5、GhACX16和GhACX11的表达量明显降低,处理3 h 后,这些基因的表达量又升高。 盐胁迫处理后1 h,GhACX10、GhACX7、GhACX18、GhACX5、GhACX16、GhACX19、GhACX1和GhACX11明显上调表达。 PEG 6000 模拟干旱胁迫处理后3 h,GhACX6、GhACX17、GhACX7、GhACX18、GhACX5和GhACX16下调表达, 处理后6 h 又上调表达(图5)。 陆地棉ACX基因在不同非生物胁迫下的表达量均发生不同程度的变化,表明它们可能在高温、低温、盐胁迫和干旱胁迫响应中发挥重要作用。从以上分析结果来看,GhACX5和GhACX16基因的表达量在高温、低温、盐和干旱胁迫中均发生明显变化, 二者可能是重要的逆境响应基因。
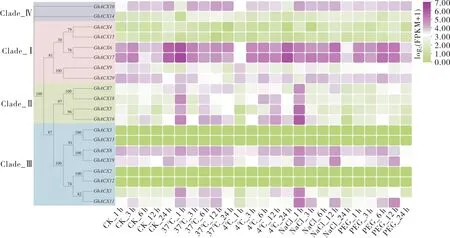
图5 陆地棉ACX 基因在不同胁迫处理下的表达模式Fig. 5 Expression pattern of ACX gene in G. hirsutum under different stress treatments
2.7 高温胁迫下棉花花药中ACX 基因的表达模式分析
利用实验室前期获得的高温胁迫下耐高温与高温敏感型棉花材料不同发育时期的花药转录组测序数据, 分析ACX基因家族成员的表达谱(图6)。 在高温与正常条件下, 除了GhACX4、GhACX15、GhACX3、GhACX13、GhACX2和GhACX12基因处于稳定的低表达水平外, 其他基因的表达量在不同发育时期的花药中均发生不同程度的变化。 但在高温胁迫与正常条件下,GhACX10、GhACX14、GhACX6、GhACX17、GhACX9 、GhACX20、GhACX7、GhACX18、GhACX8、GhACX19、GhACX1和GhACX11基因在2 种耐热性不同的棉花材料中的表达趋势相似, 或者无明显差异。GhACX5和GhACX16基因的表达量在高温胁迫与正常条件下的耐高温和敏感棉花不同发育时期的花药中均存在明显差异,推测这2 个基因可能参与高温胁迫响应。

图6 高温处理和正常条件下耐高温与高温敏感棉花不同发育时期的花药中ACX 基因的表达模式Fig. 6 Expression patterns of ACX genes in the anthers at different developmental stages of the high temperature tolerant and sensitive cotton lines under high temperature and normal control conditions
2.8 利用VIGS 技术初步验证GhACX16 基因的功能
结合以上ACX基因的表达模式和前期转录组分析[2],采用VIGS 技术对GhACX16基因的功能进行初步验证。 当阳性对照组棉苗出现白化症状时 (图7A), 利用qRT-PCR 鉴定试验组棉苗GhACX16基因的沉默效果 (图7B), 然后将TRV:GhACX16 棉苗和TRV:00 棉苗置于42 ℃培养箱连续处理3 d。TRV:GhACX16 棉花材料表现出较好的高温耐受性,而阴性对照棉花材料叶片表现为较严重的枯黄萎焉(图7C)。 生理生化指标检测结果显示, 与阴性对照组相比,TRV:GhACX16 棉花叶片的丙二醛含量显著降低,而脯氨酸含量、叶绿素含量和过氧化氢酶活性显著升高(图7D~G)。 以上结果表明沉默GhACX16基因增强了棉苗的高温耐受性, 说明GhACX16是一个重要的高温响应基因。

图7 高温胁迫下GhACX16 基因沉默棉花幼苗表型及生理生化指标测定Fig. 7 Phenotype and physiological and biochemical indexes of GhACX16 gene-silenced cotton seedlings under high temperature stress
3 讨论
近年来,随着棉花基因组测序工作的陆续完成,基因家族鉴定为研究基因功能提供了重要线索, 但关于陆地棉ACX基因家族的研究还未见报道。 本研究利用生物信息学分析方法,在陆地棉和海岛棉中均鉴定到20 个ACX基因,在亚洲棉和雷蒙德氏棉基因组中均鉴定到11 个,ACX基因数量差异可能是棉花基因组加倍的结果[38-39]。20 个陆地棉ACX基因分布在13 条染色体上,A亚组和D 亚组各10 个。 聚类分析将陆地棉ACX基因分为4 个亚族,其他棉种(海岛棉、亚洲棉和雷蒙德氏棉) 的ACX基因在这4 个亚族中均有分布,说明其在进化过程中较为保守。 基因结构和蛋白保守基序预测结果显示,20 个陆地棉ACX蛋白均含有4 个相同的基序,且同一亚族的基因有高度相似的保守基序和基因结构,说明其进化高度保守, 可能具有相似的功能。 只有GhACX10和GhACX14基因 (拟南芥AtACX4的同源基因)没有ACOX 结构域,可能是进化过程中发生功能分化所致。 共线性分析预测到20对同源基因,没有发现串联重复基因,说明片段复制是ACX基因的主要扩张动力。 基因复制和基因组加倍为生物进化提供原料和动力[40]。如果Ka/Ks比值大于1 表示有正选择效应; 如果Ka/Ks值小于1 则认为存在纯化选择作用; 如果Ka/Ks值等于1 说明有中性选择[41]。 陆地棉ACX同源基因的Ka/Ks值均小于0.5, 说明ACX基因家族高度保守,经历了较强烈的纯化选择作用。
ACX基因编码的酰基辅酶A 氧化酶是脂肪酸β 氧化中的限速酶,同时参与生长发育调节和JA 合成。 脂肪酸代谢不仅与油料种子萌发和生长发育中的能量代谢有关,还参与逆境胁迫响应过程,已有研究表明与脂肪酸降解相关的基因在植物对非生物胁迫的响应中具有重要作用[42]。 陆地棉ACX基因的启动子区存在高温、低温、干旱和激素响应等相关顺式作用元件,可能有助于适应生长发育中遭遇的各种逆境胁迫。 在高温、低温、盐和模拟干旱胁迫处理下,陆地棉ACX家族基因的表达量发生明显变化,表明该家族基因可能在非生物胁迫中发挥着重要作用。 高温胁迫下棉花花药转录组数据分析结果显示,在花药发育后期部分ACX基因的表达水平明显降低, 耐高温棉花花药中部分ACX基因的表达量低于高温敏感棉花材料, 其中GhACX16基因的表达量变化最为明显。 高温胁迫下GhACX16基因沉默的棉花幼苗表现出明显的耐高温表型,其叶片丙二醛含量显著低于阴性对照,脯氨酸含量、过氧化氢酶活性和叶绿素含量显著高于阴性对照,由此推测抑制GhACX16的表达能够提高棉花对高温胁迫耐受性,本研究为棉花耐高温遗传改良提供了重要的基因资源。
4 结论
在陆地棉中鉴定到20 个ACX基因家族成员,聚类分析将其分为4 个亚族。 基因片段复制是ACX基因的主要扩张动力。ACX家族基因在高温、低温、盐和模拟干旱胁迫下表达量均发生明显变化,可能是非生物胁迫响应的重要调节基因。GhACX16基因沉默的棉花幼苗在高温胁迫下表现出明显的耐高温表型,说明其在高温胁迫响应中可能发挥着重要的功能。
附件:
详见本刊网站(http://journal.cricaas.com.cn/)本文网页版。
附表1 本研究所用引物
Table S1 Primers for this study
附表2 陆地棉ACX基因家族成员基本信息
Table S2 Basic information ofACXgene family members inG.hirsutum
附表3 陆地棉ACX基因家族同源基因对Ka/Ks分析
Table S3Ka/Ksanalysis of homologous gene pairs inACXgene family inG.hirsutum
附图1 陆地棉ACX基因家族顺式作用元件
Fig. S1Cis-acting elements ofACXgene family inG.hirsutum

