陆地棉衰老相关基因GhSAG101 的克隆及抗病功能分析
吴健锋,樊志浩,武连杰,胡晓旺,韩知里,高巍,龙璐
( 河南大学生命科学学院/ 棉花生物学国家重点实验室,河南 开封 475004)
棉花(Gossypiumspp.)是世界上最重要的天然纤维作物,也是主要的油料作物[1]。中国70%以上的棉花种植区受到黄萎病的威胁, 黄萎病导致棉花产量大幅度下降,造成严重的经济损失[2-3]。黄萎病菌大丽轮枝菌(Verticillium dahliae)可以在土壤中以微菌核形式休眠长达15 年, 在适宜环境下被激活,萌发菌丝向寄主根系生长。 黄萎病菌侵入寄主植物后,在病株的根、茎和叶维管束内大量繁殖, 激发邻近细胞产生胶状物堵塞导管,影响植物的蒸腾作用和营养物质运输,同时分泌毒素蛋白,导致病株叶片枯萎、变黄,最终引起植物死亡[4]。
自然界存在的黄萎病菌复杂多样,菌系之间存在落叶型和非落叶型、不同致病力的差异[5]。同一个菌系在不同的温度下也会导致菌丝生长速度、产孢和毒素产生变化,从而影响致病力[6]。 番茄(Lycopersicum esculentum)中克隆的Ve1基因编码1 个类受体蛋白激酶,是目前报道的唯一一个植物抗黄萎病主效基因。 Ve1 蛋白可特异性识别大丽轮枝菌和黑白轮枝菌(V.albo-atrum)的无毒蛋白Ave1,激活番茄的抗病性[7]。 然而由于国内的黄萎病菌普遍缺乏Ave1 蛋白, 超表达Ve1的棉花转基因材料因缺乏Ave1 识别过程, 不能激活Ve1 介导的下游抗性,因此Ve1在棉花育种中的应用受到限制[8]。EDS1(enhanced disease susceptibility 1 gene)、NDR1(non-race-specific disease resistance 1 gene)、促分裂原活化的蛋白激酶激酶基因MKK2和BAK1等基因位于Ve1调控通路的下游,参与Ve1介导的番茄抗黄萎病反应[9],棉花中也存在相似的抗病反应。 沉默GhNDR1、GhMKK2、GhBAK1和GbEDS1均 可 降 低棉花对黄萎病的抗性[10-12]。 此外,土壤中存在的其他病原生物,如线虫等会加剧大田中黄萎病的发病率和发病程度。 这些因素使棉花生产中的黄萎病防控变得尤为困难。 因此,解析棉花抗黄萎病的分子机理,发掘关键抗病基因,利用生物技术培育抗病新品种,是当前棉花抗病育种的重点[13]。
棉花与黄萎病菌的互作涉及多种生物学过程。 研究表明,细胞壁加固、次生代谢激活、抗病基因表达、激素介导的细胞信号转导等生物学过程都与棉花对黄萎病菌的响应相关[14-17]。Gao 等[14]通过蛋白组学分析结合病毒诱导的基因沉默(virus-induced gene silencing, VIGS)研究,证明了棉酚、茉莉酸和油菜素内酯参与了棉花对黄萎病菌的抗性。 Mo 等[15]克隆了1 个多胺氧化酶(polyamine oxidase, PAO)基因GhPAO,其产物GhPAO 通过增加双氧水(H2O2)、水杨酸和植保素的含量来增强植物对黄萎病的抗性。Xu 等[16]利用差异转录组和生化分析,发现木质素在棉花抗黄萎病中有重要作用。随后的研究证明GbERF1-like、GhMYB43、GhWAT1/2/3等基因编码的蛋白质通过调控下游信号通路,激活木质素的生物合成来影响棉花抗病性[18-20]。
植物激素乙烯(ethylene,ET)在棉花抗病中的作用比较复杂。 黄萎病菌可诱导棉花体内ET含量和ET 合成相关基因表达量的上升, 研究人员推测黄萎病菌可能通过ET 促进叶片衰老、脱落,来提高致病力[21-22]。 接种黄萎病菌后,拟南芥(Arabidopsis thaliana) 乙烯不敏感基因(ethylene insensitive gene,EIN) 突变体etr1-1、ein3-1叶片黄化、衰老程度显著低于野生型[23-24]。 然而敲除EIN2、EIN4和EIN6的拟南芥抗病性显著降低[25]。上述文献说明ET 在植物抗黄萎病的过程中存在双重调控作用。Robison 等[26]通过用ET 抑制剂和ET 前体处理接种黄萎病菌的番茄, 证明了双重调节作用的存在,并提出理论认为:黄萎病侵染后ET 处理能增强番茄的感病性, 而在黄萎病侵染时ET 处理能抑制病害的发展。 这些研究结果揭示棉花与黄萎病菌之间的相互作用机理非常复杂,需要更深入和系统的研究,从而为棉花抗病的分子机理提供理论基础。
衰老相关基因 (senescence-associated gene,SAG)广泛存在于各种植物中,可编码转录因子、激酶、转运子等各种类型的蛋白。SAG基因的表达变化,是植物进入衰老过程的标志。 如在拟南芥中,SAG101在叶片衰老初期表达, 反义RNA干扰SAG101表达的转基因拟南芥与野生型相比,叶片衰老起始时间延迟4 d,说明SAG101的超表达导致了转基因拟南芥的早衰[27]。在拟南芥、水稻(Oryza sativa)等作物中,一些SAG基因被发现参与植物对病毒、细菌和真菌等病原菌的抗性[28],但在棉花中未见相关报道。在拟南芥叶片衰老相关突变体中筛选鉴定的SAG101编码EDS1类的酰基水解酶蛋白[28]。 本研究在陆地棉(G.hirsutum)中鉴定到1 个受黄萎病菌诱导的SAG101基因, 通过整株、 离体叶片接种黄萎病菌,研究该基因在棉花抗黄萎病中的作用,可为棉花抗病育种提供候选基因。
1 材料与方法
1.1 研究材料
陆地棉遗传标准系TM-1 由棉花生物学国家重点实验室保存。 棉花VIGS 载体pTRV1、pTRV2 由荷兰瓦赫宁根大学Bart P. H. J. Thomma教授惠赠[9]。 棉花强致病力落叶型黄萎病菌菌系V991 由中国农业科学院植物保护研究所简桂良研究员提供,带绿色荧光蛋白(green fluorescent protein, GFP) 标签的黄萎病菌强致病力菌株Vd592-GFP[29]由中国科学院郭慧珊研究员惠赠。
1.2 棉花培养
挑选饱满的TM-1 种子在28 ℃、高湿度环境中催芽至胚根萌发长度为1.0~1.5 cm;选择萌发良好且一致的种子播种到营养土中,在25 ℃、相对湿度70%、16 h 光照/8 h 黑暗的条件下培养。取两叶一心期幼苗的根、茎、叶用于GhSAG101表达量检测。
1.3 棉花总RNA 提取及反转录
称取0.1 g 棉花各组织鲜样,使用RNA 多糖多酚提取试剂盒DP441 (天根生化科技有限公司, 北京) 进行棉花总RNA 提取。 取1 μg 总RNA,用M-MLV 反转录酶M1701(普洛麦格生物技术有限公司,北京)进行反转录。 反转录产物用双蒸水(ddH2O)稀释50 倍,保存于-20 ℃,用于后续的实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)扩增。总RNA 提取和反转录的具体操作方法参考试剂盒说明书。
1.4 GhSAG101 的克隆和多重序列比对
用本实验室前期表达谱分析中所获得的序列片段,在陆地棉基因组数据库(https://cottonfgd.org/)中进行相似性BLAST 搜索,找到与目标序列片段匹配度最高的基因,并设计基因全长引物SAG101-OF/OR(表1)进行PCR 扩增。 PCR 扩增的具体操作方法参考TaqDNA 聚合酶P101 (诺唯赞生物科技有限公司,南京)试剂说明书。 在美国国家生物技术信息中心 (National Center for Biotechnology Information, NCBI)数据库(http://www.ncbi.nlm.nih.gov/)中搜索下载与陆地棉Gh-SAG101 氨基酸序列一致性最高的拟南芥蛋白序列AtSAG101, 使用DNAMAN 软件进行蛋白质多重序列比对。 用NCBI 数据库中蛋白BLAST工具预测GhSAG101 蛋白的保守结构域。

表1 本研究中用到的引物Table 1 Primers used in this research
1.5 实时荧光定量PCR
用SYBRGreen 染料法, 在ABI7500 Fast 实时荧光定量PCR 系统上进行反转录产物的扩增, 反应使用的试剂为ChamQ SYBR Qpcr 混合液Q711-02(诺唯赞生物技术有限公司,南京)。扩增的目标基因为GhSAG101A/D, 内参基因为GhUB7(GhA12G1102),扩增引物见表1。 每个试验样品设置4 个技术重复,目标基因的相对表达量用2-△△Ct 法计算。qRT-PCR 的体系和程序设置参考试剂盒说明书和Long 等[30]的方法。
1.6 VIGS 载体构建
根据GhSAG101A/D的编码序列设计引物GhSAG101-VF/VR(表1),以TM-1 的cDNA为模板扩增SAG101基因开放阅读框第27~421 bp 的VIGS 目标片段, 片段长度为395 bp。并在正向引物GhSAG101-VF 的5' 端加入交换臂序列(AGAAGGCCTCCATGG)和BamHI 酶切位点(GGATCC);在反向引物GhSAG101-VR 的5' 端加入交换臂序列(GAGACGCGTGAGCTC)和KpnI 的酶切位点(GGTACC)。 用一步克隆的方法构建VIGS 载体: 扩增的PCR 产物纯化回收; 同时用XbaⅠ和KpnⅠ双酶切VIGS 病毒载体pTRV2 质粒, 酶切产物经琼脂糖电泳胶回收目的片段。 使用重组酶ExnaseⅡ(诺唯赞生物科技有限公司,南京)进行目的片段与PCR 产物的一步克隆连接, 连接产物转化至大肠杆菌中,通过菌液PCR 筛选阳性克隆, 送北京六合华大基因科技有限公司测序,选择含有正确目标片段的克隆提取质粒,获得重组载体pTRV2∷SAG101。通过电转化法将提取的质粒导入农杆菌菌株GV3101 中, 挑取单克隆菌落扩繁进行PCR 检测,阳性克隆保存于-80 ℃备用。
1.7 VIGS 转化
在10 mL 的LB 液体培养基中分别加入100 μL 保 存 的pTRV1、pTRV2 和pTRV2 ∷SAG101农杆菌, 在28 ℃、220 r·min-1摇床中过夜培养至OD600为1.2~1.5。 离心收集菌体细胞,用重悬液 (含10 mmol·L-1MgCl2,10 mmol·L-12-(N-吗啉代)乙磺酸溶液,200 μmol·L-1乙酰丁香酮) 调节菌液浓度至OD600为0.6~0.8。 将pTRV1 重悬液分别与pTRV2 重悬液、pTRV2-SAG101 重悬液以1∶1 体积比混匀,在室温自然光条件下静置2 h 后注射生长7 d 的TM-1 幼苗子叶。 空载体pTRV2 转化的对照材料记为TRV:00,pTRV2-SAG101 转化的GhSAG101沉默材料记为TRV:SAG101。 注射后的幼苗避光培养12 h 后恢复光照培养(温度25 ℃,相对湿度70%,16 h 光照/8 h 黑暗)。 注射10 d 后取幼嫩真叶提RNA, 通过qRT-PCR 检测目标基因沉默效率[14]。
1.8 黄萎病菌接种试验
取保存于-80 ℃的黄萎病菌V991 或Vd592-GFP 孢子液300 μL,均匀涂布在马铃薯葡萄糖琼脂固体培养基上,25 ℃恒温暗培养4~5 d。 用无菌水刮洗培养基上的黄萎病菌孢子,并用双层纱布过滤。 用血球计数器计算孢子含量,接种前用纯水将孢子含量调整为106mL-1[31]。 生长至两叶一心时,将野生型幼苗从营养土中取出,用伤根接种法接种V991 孢子液, 以无菌水处理作为对照组,每组包含至少20 株棉花幼苗,设置3 次生物学重复。 将长势一致的棉花幼苗浸泡于黄萎病菌孢子液中约30 s, 用吸水纸吸去多余孢子液。将棉花幼苗重新移植到营养土中。 接种后的棉花放置于25 ℃恒温培养箱中培养 (16 h 光照/8 h黑暗)。在接种后1 d、3 d、5 d、7 d 和9 d 时取对照组和试验组的根系,提取RNA,利用qRT-PCR 验证GhSAG101的诱导表达模式。
将VIGS 注射3 周后的TRV:00 和TRV:SAG101 棉花幼苗用伤根接种法接种黄萎病菌孢子液,接种后每天观察植株发病情况,并统计相关数据。 发病率和病情指数计算方法参照国家标准(GB/T 22101.5-2009)[32]。 接种黄萎病菌后15 d,取接种棉花材料子叶节下侧1 cm 茎段,30°角斜剖茎段,在体式显微镜下观察茎段维管组织褐化情况并拍照[33]。黄萎病菌离体叶片的接种方法:选取VIGS 处理后长势一致的植株第2 片真叶进行叶片接菌。 将叶片平铺在湿润滤纸上,在叶片中央叶脉处制造直径为0.5 mm 的伤口, 在伤口处滴入15 μL 的Vd592-GFP 孢子液, 覆膜保湿并在25 ℃下避光培养[34]。每组包含至少10 片棉花真叶,设置3 次生物学重复。 每天观察并记录病斑大小,使用ImageJ 软件统计病斑面积。 病斑处黄萎病菌菌丝的绿色荧光观察使用MVX10 荧光体式显微镜(奥林巴斯,日本)。
2 结果与分析
2.1 GhSAG101 的序列分析
在本实验室前期研究棉花响应黄萎病菌的RNA-seq 数据库中,筛选到1 条黄萎病菌侵染后表达量升高的核苷酸序列。 在陆地棉基因组数据库中进行BLAST 搜索,发现目标基因是位于7 号染色体上的Ghir_A07G023460和Ghir_D07G023540,注释为SAG101,因此将Ghir_A07G023460和Ghir_D07G023540分别命名为GhSAG101A和GhSAG101D。GhSAG101A和GhSAG101D的编码区长度均为1 764 bp, 没有内含子, 编码包含587 个氨基酸残基的蛋白质。 多重序列分析结果显示,GhSAG101A 和GhSAG101D 的氨基酸序列一致性为95.7%,与拟南芥中的同源蛋白AtSAG101 氨基酸序列一致性为74.4%, 说明GhSAG101A/D 和AtSAG101可能存在相似的功能。 GhSAG101A/D 蛋白质N端具有水解酶保守结构域 (第110~212 个氨基酸残基),其中包含1 个亲核基序GHSLG(第141~145 个氨基酸残基)。 水解酶保守结构域广泛存在于蛋白酶、脂酶、过氧化物酶等具有重要功能的蛋白中,核心的催化位点通常包括1 个丝氨酸、1 个谷氨酸或天冬氨酸和1 个组氨酸。GhSAG101A/D 蛋白质C 端具有保守EP 结构域(第358~463 个氨基酸残基), 这种高度保守的结构域存在于EDS1 及其家族成员中,通过疏水相互作用、盐桥和大量的氢键形成(图1)。

图1 GbSAG101A/D 和同源蛋白AtSAG101 的多重序列比对Fig. 1 Multiple sequence alignments of GbSAG101A/D with orthologous protein AtSAG101
2.2 GhSAG101 的表达模式分析
在两叶一心时提取棉花幼苗根、 茎、 叶的RNA,研究GhSAG101基因的组织表达模式。 由于GhSAG101A和GhSAG101D基因高度同源,qRT-PCR 技术难以区分2 个基因, 因此本研究中扩增的GhSAG101包括GhSAG101A和GhSAG101D基因的转录本。 如图2A 所示,GhSAG101在棉花幼苗中的表达模式具有组织特异性。GhSAG101在根系中表达量最高,在茎中表达量略低, 约为根中表达量的40%左右。GhSAG101在叶片中表达量最低,为根中表达量的0.1%。
对黄萎病菌侵染后不同时间的GhSAG101表达分析结果(图2B)表明:在水处理的对照组中,GhSAG101转录水平未出现较大的变化;在黄萎病菌接种的试验组中,GhSAG101在接种后5 d 和7 d 明显上调表达,在接种后5 d 左右达到峰值,随后逐渐下降,在接种后9 d 恢复到本底表达水平。说明GhSAG101响应了黄萎病菌侵染棉花的过程,在侵染的中后期(5~7 d)被诱导上调表达。

图2 GhSAG101 的表达模式分析Fig. 2 Expression analysis of GhSAG101
2.3 GhSAG101 负调控棉花对黄萎病的抗性
VIGS 试验结果显示:GhSAG101沉默的棉花植株TRV:SAG101 在形态上与空载体转化的对照材料TRV:00 无显著区别, 说明GhSAG101在幼苗时期不影响棉花的生长发育。 在VIGS 注射后10 d 时用qRT-PCR 技术检测GhSAG101基因的沉默效率,结果显示GhSAG101沉默的棉花叶片中该基因的表达量仅为对照植株叶片中表达量的1/5,基因沉默效果显著(图3A)。 由于GhSAG101A和GhSAG101D基因高度同源,根据VIGS 技术的原理无法单独沉默GhSAG101A或者GhSAG101D, 因此本研究中构建的VIGS 载体同时沉默了GhSAG101A和GhSAG101D的表达。
将注射pTRV2 和pTRV2∷SAG101 后3 周的棉花幼苗用伤根法接种V991 孢子液, 在接种4~5 d 后,2 种材料都开始出现黄萎病的典型病征,包括叶片黄化和萎蔫。 随着黄萎病菌在维管组织中的扩散和释放毒素,棉花病害加重。 在侵染后持续观察2 种材料的病症, 发现pTRV2 处理的棉苗随后的病程进展快于pTRV2-SAG101处理的。pTRV2 处理的棉花叶片黄化、枯萎明显,而pTRV2-SAG101 处理的棉花叶片黄化、枯萎程度较轻(图3C)。在接种后10 d,pTRV2 处理的棉苗发病率达到了58%,pTRV2-SAG101 处理的棉苗发病率为32%; 病情指数也存在类似的差异,在接种后10 d,pTRV2 和pTRV2∷SAG101 处理的棉苗病情指数分别为21 和10(图3B)。
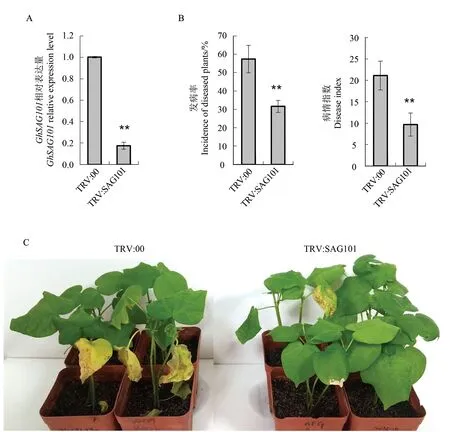
图3 TRV:00 和TRV:SAG101 幼苗的抗病性分析Fig. 3 Disease resistance assay of TRV:00 and TRV:SAG101 seedlings
黄萎病菌从寄主根部入侵,在维管组织中从下往上扩展, 堵塞导管和分泌毒素杀死邻近细胞。 通常发病植株茎、叶柄和侧枝的维管束会变成褐色或黑褐色。 因此,剖秆观察维管束是初步判断大田棉花是否感染黄萎病的指标之一[33]。 在接种后15 d,对对照棉株(TRV:00)和基因沉默棉株(TRV:SAG101)茎秆同一部位维管组织的观察结果 (图4) 显示, 两者都出现维管褐化现象,TRV:00 的褐化程度重于TRV:SAG101, 说明在同等条件下, 黄萎病菌在TRV:00 中造成了更严重的扩散和细胞死亡。以上结果暗示,GhSAG101负调控棉花对黄萎病的抗性。
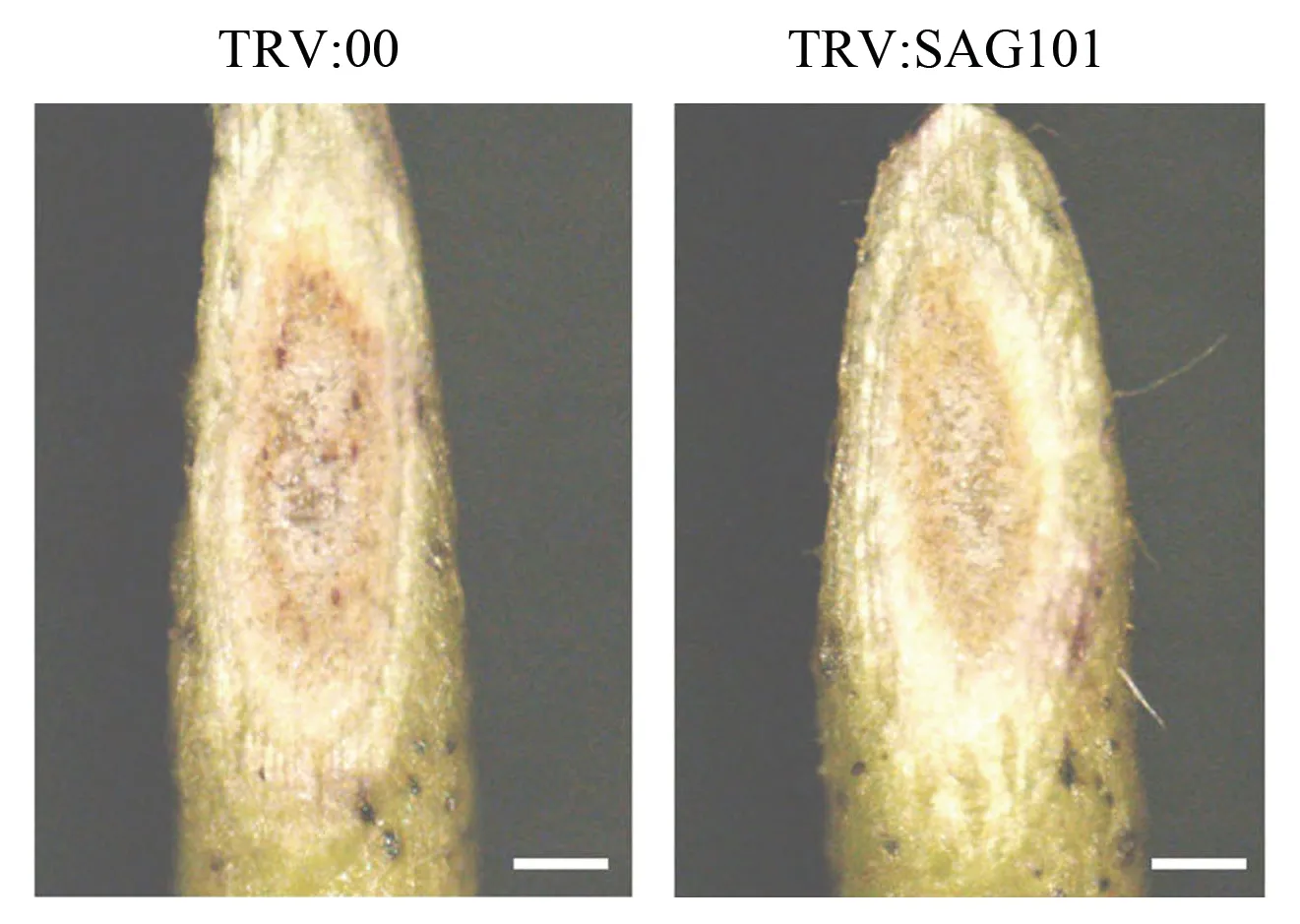
图4 TRV:00 和TRV:SAG101 接菌后15 d 的茎部观察Fig. 4 Observation of the stems of TRV:00 and TRV:SAG101 at 15 d after V. dahliae infection
2.4 GhSAG101 调控黄萎病菌在棉花中的扩散
选同一部位、 长势一致的TRV:00 和TRV:SAG101 叶片接种黄萎病菌并进行离体培养,通过每天测定黄萎病菌引起的病斑大小来定量黄萎病菌扩散情况[32]。 在接菌后3 d,可以观察到TRV:00 叶片上的病斑比TRV:SAG101 扩展更快,2 个材料间的病斑大小差异达到统计学显著水平(图5A)。 在接菌后5 d 和7 d,TRV:00 叶片的病斑面积分别是TRV:SAG101 叶片病斑面积的1.4 和1.1 倍(图5A)。 说明沉默GhSAG101在一定程度上抑制了黄萎病菌在棉花叶脉组织中的扩散。 为了进一步验证上述结论,利用带绿色荧光标签的强致病力黄萎病菌菌系Vd592-GFP对其入侵过程进行了可视化研究。 在接菌后1 d,TRV:00 和TRV:SAG101 离体叶片上都观察到带绿色荧光的菌丝沿着叶脉向外扩散, 但在TRV:00 组织中定植的菌丝更多(图5B)。
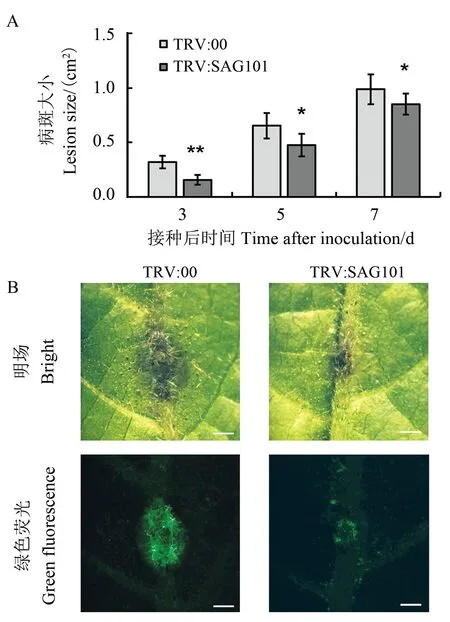
图5 TRV:00 和TRV:SAG101 离体叶片的抗病性分析Fig. 5 Disease resistance assay by using the detached leaves of TRV:00 and TRV:SAG101
3 讨论
研究棉花抗病分子机理、 挖掘抗病相关基因、创制棉花抗病新种质,是棉花育种的主要目标之一[35-36]。VIGS 作为一种简单、快捷的技术,对于棉花等遗传转化周期长、 工作量大的作物而言, 可以快速得到目标基因表达水平降低的材料,在棉花抗病基因的功能分析上有重要的作用[10,14,31]。 本研究克隆到1 对受黄萎病菌诱导的同源基因GhSAG101A和GhSAG101D, 通过VIGS 技术沉默了棉花的GhSAG101基因, 并用qRT-PCR 技术验证了本研究中VIGS 有效性。 对GhSAG101沉默和对照棉花材料进行整株接种黄萎病菌,然后对其病情指数进行分析,发现沉默GhSAG101的棉花植株对黄萎病抗性显著提高。对棉花离体叶片接菌后观察发现, 在GhSAG101沉默植株的叶片中,菌丝扩散速度显著低于对照材料。这些研究结果证实了GhSAG101基因负调控棉花对黄萎病菌的抗性,今后可以通过规律间隔成簇短回文重复序列(clustered regularly interspaced short palindromic repeats, CRISPR)技术在棉花中敲除GhSAG101基因来创制棉花抗病新种质[35-37]。
SAG101 属于EDS1 蛋白家族, 该蛋白家族成员广泛存在于植物中,在免疫信号网络中发挥关键作用。 EDS1 蛋白家族, 调控植物激素和NLR 蛋白介导的免疫信号,对植物抵抗活体营养型病原菌尤其重要[38-39]。 拟南芥和烟草Nicotiana tabacum中EDS1基因的进化分析与功能研究发现,EDS1-SAG101 异源二聚体介导细胞死亡和免疫反应[40]。 Zhang 等[11]在海岛棉G.barbadense中沉默GbEDS1基因,可显著降低棉花对黄萎病菌的抗性和水杨酸、H2O2的积累水平; 在拟南芥中异源表达GbEDS1则可诱导水杨酸和H2O2的合成,增强了拟南芥的抗病性,说明EDS1正调控棉花对黄萎病菌的抗性。 然而,在本研究中沉默GhSAG101增强了棉花对黄萎病菌的抗性,说明GhSAG101是棉花抗黄萎病的负调控因子,与GhEDS1的功能相反。 根据以上结果, 我们推测EDS1和SAG101在拟南芥中存在的协同抗病作用在棉花中可能受到影响。
在拟南芥中,SAG101在开始衰老的叶片中表达。 诱导SAG101过表达后,转基因拟南芥附着叶和离体叶片均表现出早衰现象[28]。 说明SAG101在叶片衰老过程中发挥重要作用, 且目前未证明该功能与EDS1相关[28]。 在黄萎病菌侵染的中后期,病原菌扩散到衰老组织,并从活体营养型转变为死体营养型,寄主植物出现生长发育迟缓和叶片黄化等典型症状[41-42]。 叶片黄化、脱落等病理性早衰现象是棉花黄萎病发病的典型病征[43]。转录组分析发现黄萎病菌侵染拟南芥后,会诱导衰老相关基因SAG12、SAG13和WRKY53等的表达变化[44-45],早衰有助于黄萎病菌在死体营养型阶段的扩散和定植[42-43,46]。棉花GhSAG101在接种的中后期在根系上调表达可能是黄萎病菌诱导棉花的衰老造成的。 叶片接种试验通常在避光环境下进行,暗处理可能会诱导加剧叶片衰老进程,从而进一步诱导GhSAG101的表达。 在接种黄萎病菌后,水处理对照材料中的GhSAG101表达量上调; 而在GhSAG101沉默的材料中,接菌的诱导作用会被抑制, 这些可能是接菌后TRV: SAG101 叶片比TRV: 00 叶片更抗黄萎病菌扩散的原因。沉默GhSAG101会显著降低棉花的发病率和病情指数,可能是由于衰老途径被抑制, 从而影响了黄萎病菌侵染的结果。 研究GhSAG101基因在棉花抗黄萎病中的功能和作用机理,可为棉花抗病育种提供理论基础和候选基因, 但GhSAG101在棉花中如何调控抗病反应,以及是否可以通过抑制早衰来增强棉花的抗病性有待进一步的研究。
4 结论
从棉花中克隆到1 对EDS 蛋白家族的同源基因GhSAG101A和GhSAG101D, 表达模式分析表明GhSAG101基因在根中表达量最高,在叶中最低;GhSAG101响应黄萎病菌入侵, 在其侵染的中后期被诱导上调表达。 通过VIGS 沉默及抗病性分析发现,沉默GhSAG101会增强棉花对黄萎病菌的抗性, 进一步研究发现沉默GhSAG101能抑制棉花体内黄萎病菌的扩散。 综上所述,GhSAG101基因负调控棉花对黄萎病菌的抗性,可作为抗病育种的候选基因。

