金团簇电催化二氧化碳还原反应的研究进展
杨 丹,刘 旭,戴翼虎,祝 艳,杨艳辉
(1.南京工业大学化学与分子工程学院,南京 211816;2.南京大学化学化工学院,南京 210093)
二氧化碳是一种可持续的C1资源,有效地将CO2转化为液体燃料和高附加值化学品对于减缓全球变暖和能源供应具有重要的意义. 目前,CO2的资源化利用技术包括催化加氢、光化学还原、光电催化还原及电化学还原等[1]. 其中,电化学技术由于反应条件温和,可有效利用太阳能、风能、潮汐能等可再生能源产生的电能将CO2转化为多种含碳化合物,且催化效率高,能够通过控制电解条件调控目标产物的选择性,实现可持续的碳循环等优势,从而受到广泛关注. CO2电还原反应(CO2RR)是一个涉及多电子的反应,根据转移的电子数目,CO2RR通常分为2,4,6或8电子反应,且可能发生的几种反应之间的热力学电势能相差不大,得到的产物往往是几种含碳化合物的混合物(表1). 目前,实现CO2高效电催化转化存在诸多挑战:阴极存在析氢反应(HER),导致产物选择性降低;CO2分子结构稳定,得电子生成过电势高. 近年来,研究者通过开发新结构催化剂来降低过电势、抑制HER副反应以提高CO2RR 的反应活性和选择性[2,3]. 尽管各种金(Au)、银(Ag)、铜(Cu)等金属纳米催化剂表现出优异的催化性能[4,5],但因具有尺寸多分布特性和表面结构的复杂性,其催化性质反映所有粒子的平均行为,难以将结构与催化性质准确地关联,对于有效阐述催化剂的构效关系和理解反应机理存在很大的挑战. 对于复杂的CO2RR反应,揭示其反应机理更具挑战. 结构明确的金团簇为深入理解CO2RR的反应机理提供了新机会.

Table 1 Major products,reactions and potentials of CO2RR
与目前普遍采用的多相复合电催化剂相比,金团簇是介于金原子与金纳米颗粒之间的聚集体,尺寸为1~3 nm,具有精确的原子排列结构. 以Au25(PET)18(PET=苯乙硫醇)晶体结构为例:由Au13二十面体内核结构和6组二聚体Au2(PET)3“订书钉”外壳结构组成[图1(A)][6]. 以Au25(PET)18为模板,通过异质金属原子掺杂形成的双金属团簇也陆续被报道,如M1Au24(PET)18团簇,晶体结构如图1(B)所示. 钯/铂(Pd/Pt)原子取代Au25(PET)18的中心Au 原子,镉(Cd)原子取代内壳“订书钉”的Au 原子,汞(Hg)原子取代外壳“订书钉”的Au原子[7~9]. 其它各种结构和尺寸的金团簇晶体结构也被陆续报道,如Au9[10],Au11[11],Au13[12],Au16[13],Au18[14],Au20[15],Au21[16],Au23[17],Au24[18],Au28[19],Au30[20],Au32[21],Au36[22],Au38[23],Au40[24],Au42[25],Au43[26],Au44[27],Au49[28],Au52[29],Au60[30],Au92[31],Au102[32],Au130[33],Au144[34],Au191[35],Au246[36],Au279[37],Ag2Au50[38],Au43Ag38[39],Pd2Au36[40],Pt2Au36[40],Cd2Au19[41],Cd2Au47[42],Cd4Au38[43],Au19Cu30[44]和Au57Ag53[45]等. 与Au 纳米颗粒催化剂相比,Au 纳米团簇在深入探讨催化剂结构与催化性能之间的关系方面具有明显的优势:利用不同的合成方法,在控制Au纳米团簇的结构、尺寸相同的情况下,研究催化剂表面配体和金属电荷对反应的影响;在控制团簇的内核结构、尺寸相同的情况下,研究表面结构对催化反应的影响;也可以在保持内核结构不变的情况下,通过控制掺杂原子种类、数量和位点研究掺杂对催化性能的影响. 例如,以Au9,Au11和Au36[46],Au8n+4(TBBT)4n+8(n=3,4,5,6,TBBT=对叔丁基苯硫酚)[47],以及棒状Au24和Au25团簇为催化剂体系[48],分别研究了团簇不同表面结构、内核结构演变和团簇结构中内部空位对催化CO2加氢反应的影响. 研究结果表明,不同结构的金团簇可以选择性调控反应中间物种及产物在团簇表面的吸脱附能力,从而调控CO2加氢反应的产物,不仅可以得到甲烷、甲酸、甲醇等C1产物,也可以得到乙醇、二甲醚等C2产物.以钌(Ru)掺杂的合金团簇Au4Ru2和Au5Ru2为催化剂,揭示了催化剂单活性位点和双活性位点对N-甲基化反应的影响[49]. 以体心立方(bcc)结构bcc-Au38S2、六角密堆积(hcp)结构hcp-Au30和面心立方(fcc)结构fcc-Au21团簇,以及Au20Ag1和Au19Ag4团簇为催化剂,分别研究了不同内核结构以及不同Ag活性位点对CO2环加成反应的催化性能的影响[50,51]. 结果表明,即使是金纳米团簇中单个原子的差异也能引起团簇催化性能发生显著变化[52]. 因此,在原子水平上探究催化剂的构效关系和反应机理方面,精确的金团簇具有独特的优势.

Fig.1 Crystal structures of Au25(PET)18(A)and M1Au24(PET)18(M=Pd,Pt,Hg,Cd)nanoclusters(B)
关于金团簇合成、表征及结构-性能关系等方面的研究都已经取得了重大的进展,并有多篇综合评述报道[53~55]. 然而,关于金团簇常温催化CO2RR的综合评述报道较少. 鉴于金团簇作为模型催化剂解析反应机理方面的重要作用,本综合评述重点介绍了纯金团簇和掺杂金团簇常温催化CO2RR的研究进展,探讨了金团簇的尺寸效应、电荷效应、配体效应、原子排列结构以及掺杂效应等对CO2RR性能的影响,并重点阐述了团簇结构与性能之间的关系以及CO2RR 的反应机理. 此外,提出了金团簇在CO2RR中所面临的机遇和挑战.
1 纯金团簇对CO2RR性能的影响
金团簇具有确定的原子排列结构,尺寸分布均一,其不同的尺寸、电荷、配体及结构等均可以有效地调控氧化还原电位,作为高级的电子转移介质在CO2RR中已经得到广泛研究.
1.1 尺寸效应
Jin 等[56]首次将团簇用于CO2RR,研究了不同尺寸(1,2,5 nm 和块体)的金催化剂在0.1 mol/L KHCO3电解液中催化CO2RR 的性能. 由图2(A)~(D)可见,在整个测试电位(vs. RHE)范围内,尺寸约为1.2 nm[6])在CO2电还原生成CO过程中表现出良好的电催化性能,其生成一氧化碳(CO)的起始过电位低至90 mV,大大低于大尺寸的Au 纳米颗粒催化剂(200~300 mV),最高催化效率接近100%,是不同尺寸Au 纳米颗粒催化剂的7~700 倍,且反应后团簇结构依然保持完整. 他们利用原位非水溶剂光谱电化学法研究了Au25团簇与CO2分子之间的相互作用,发现带负电荷的Au25团簇与CO2分子之间存在可逆、较弱的电子相互作用,可改变团簇的光谱性质[图2(E)],而CO2分子与传统Au纳米颗粒催化剂几乎没有电子相互作用,因此推测这一弱相互作用可能是金团簇产生良好催化性能的主要原因. 密度泛函理论(DFT)计算表明,这一电子相互作用主要是CO2分子中的氧原子与Au25壳层中的3个硫原子相互作用诱导电荷再分配引起的. 从图2(F)可以看出团簇表面吸附1个CO2分子后,其价电子会发生明显变化,尤其是硫原子电子的耗损. 因此,证实了Au25团簇具有优异的电催化活性主要是Au25-CO2可逆弱相互作用诱导团簇内电荷重新分配引起的. 同时,该研究结果也证明了CO2分子的物理吸附可以扰动金团簇的电子结构、光学性质和电化学性质.
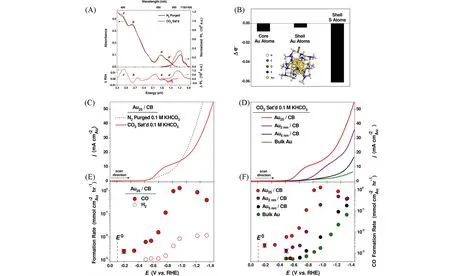
Fig.2 Catalytic performance of metal nanoclusters in CO2RR[56]
1.2 电荷效应
在多相催化反应中,带电活性位点被认为是关键的反应活性中心,如带正电的Auδ+物种通常被认为是催化CO 氧化反应的活性位点[57,58]. 然而,带电活性位点的概念很少扩展至电化学反应体系. 由图3可见,Au25团簇具有3种电荷(−1,0,+1),分别具有1S21P6,1S21P5和1S21P4超原子构型,为研究带电Au活性位点在电催化反应体系中的作用提供了良好的平台[59]. Kauffman等[60]探究了团簇表面电荷对CO2RR 性能的影响,发现3 种金团簇催化产物均为CO 和氢气(H2),且电催化活性依次为此外,还发现3种金团簇在CO2RR过程中具有相似的起始过电位和Tafel斜率,说明不同电荷的Au25团簇催化CO2RR存在相同的反应机理. DFT理论计算表明,带负电荷的对底物具有较强的吸附作用,通过稳定CO2和H+的共吸附来更好地促进CO2的电还原,从而表现出最高的CO2RR电催化活性. 另外,带正电荷的通过稳定CO和OH−的共吸附可以促进CO的电催化氧化,同时生成的产物CO2在表面具有较强的吸附,抑制了O2的还原速率,从而表现出最好的电催化CO氧化活性,而却表现出最差的催化活性. 因此,可以通过调控催化剂电荷改变催化体系中反应物、中间体和产物的相互作用,进而调控其催化性能.
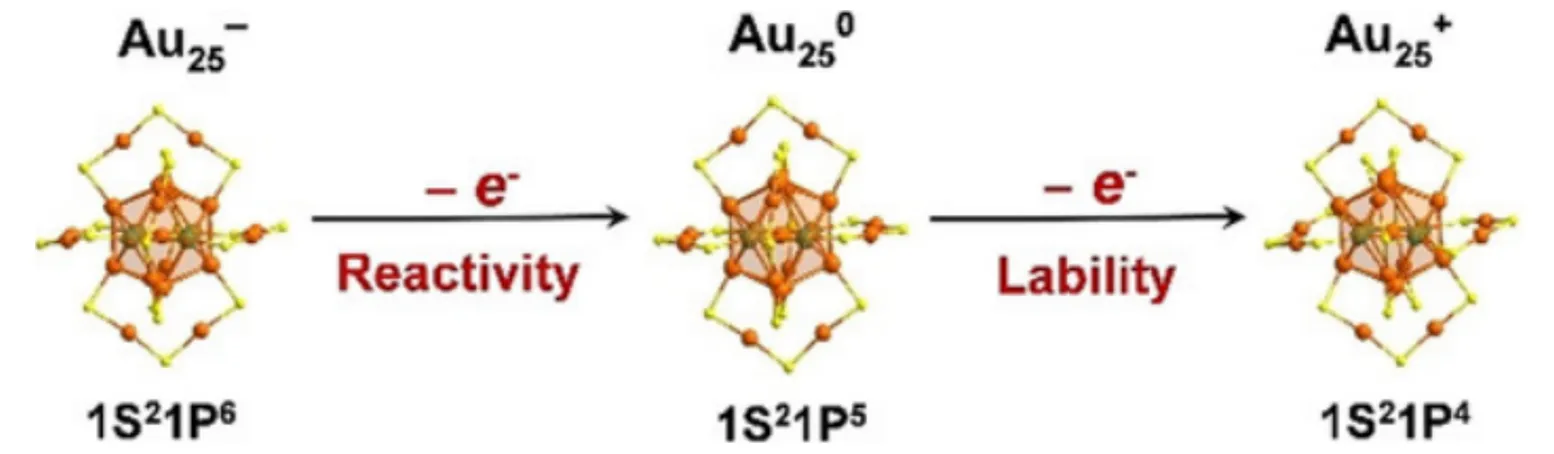
Fig.3 Scheme of gaining and losing electrons of Au25(PET)18 nanocluster[59]
1.3 配体效应
金团簇表面被有机配体保护,有机配体会影响金团簇的结构稳定性、催化活性以及产物选择性.Tsukuda等[61]利用不同取代基的N-杂环卡宾(NHC)与Au11(PPh3)8C-12(PPh3=三苯基膦)团簇进行配体交换反应,合成了一系列NHC/PPh3混合配体保护的Au11团簇(图4),其中团簇的热稳定性依此为2<3a<3b<3c. 他们研究了团簇2,3a 和3c 对CO2RR 性能的影响,结果显示团簇3c 表现出最高的CO 法拉第效率(Faradaic efficiency,FE)、电流密度和稳定性,而同样是NHC保护的团簇3a却表现出最差的电催化性能,这可能与配体空间位阻和配体自身的电子密切相关.

Fig.4 Reaction of[Au11(PPh3)8Cl2]-with NHC precursors to form new NHC⁃containing gold nanoclusters
Wang 等[62]合成了首个全脒配体[仅含有金-氮(Au—N)共价键]保护的金团簇[Au28(Ph-form)12]2+(Ph-form=N,N'-二苯基甲脒). Au28具有紧凑的Au4@Au24四面体核-壳T对称结构,该结构被12个桥联甲脒配体完全保护,表现出优越的热稳定性,可以在80 ℃的甲苯溶液中存放6 d,其结构依旧保持完整.Wang 等探究了Au28/多壁碳纳米管(CNTs)负载型催化剂在CO2RR 中的电催化性能,与金前体催化剂Ph-form Au/CNTs和聚乙烯吡咯烷酮(PVP)包覆的Au纳米粒子(~12 nm)相比,Au28表现出更高的电催化性能[图5(A)]. 由图5(B)~(D)可见,在整个测试电位范围内,Au28/CNTs催化CO2RR的FECO均保持在80%以上,且质量活度和电流密度随测试电位的增加而逐渐增大,尤其在−0. 69 V(vs.RHE)条件下,反应40 h依然保持稳定的FECO和电流密度. 因此,全脒配体保护的Au28团簇在CO2RR过程中表现出良好的催化活性和循环稳定性,且反应后团簇结构未发生明显变化,这主要是金原子与含氮配体脒之间存在较强的共价键作用引起的. 因此,金团簇含有Au—N共价键可以提升其结构稳定性,从配体策略来看,含氮配体可能会成为下一个被广泛研究的用于合成高稳定、高活性金纳米团簇的有机配体.
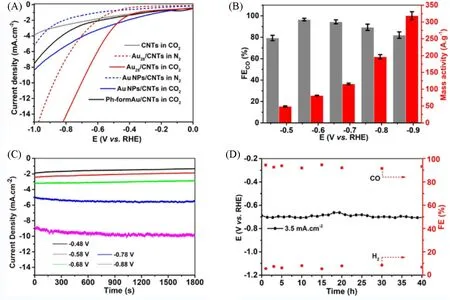
Fig.5 Catalytic performance of metal nanoclusters in CO2RR[62]
2021年,Jin等[63]研究了3种有机配体[(2-苯乙硫醇(PET)、1-萘硫酚(Nap)和苯硒醇(SePh)])保护的Au25(XR)18团簇(X=S,Se)催化CO2RR反应过程的配体效应. 如图6(A)所示,这3种团簇具有相同的核壳结构和不同的表面配体. 他们将3种金团簇负载在炭黑(XC-72R)载体上进行CO2RR,发现炭黑虽然是惰性载体,但改善了电子转移,有利于CO2RR. 研究结果表明,3种金团簇催化CO2RR的产物均为CO和H2,且在−0.5~−1.0 V(vs.RHE)的电位范围内,PET和Nap两种硫醇配体保护的Au25团簇表现出更高的FECO和CO分电流密度[图6(B)和(C)],而SePh保护的Au25团簇表现出更高的FEH2. 同时,3种金团簇表现出相似的总电流密度[(图6(D)],进一步说明3种团簇催化的CO分电流密度不同. DFT理论计算表明,有机配体去除碳链暴露的S/Se原子是CO2RR的催化活性中心,对产物选择性具有显著影响. 其中,硫活性位点的电子密度比硒活性中心的高,促进了COOH*和CO*中间体的形成,维持了较高的CO选择性,而硒位点表现出更高的析氢倾向,维持了较高的H2选择性. 值得注意的是,尽管Au团簇表面的配体部分脱落,但在整个反应过程中团簇结构未发生显著变化. 因此,利用混合配体保护的金团簇可调控CO2RR的产物选择性.
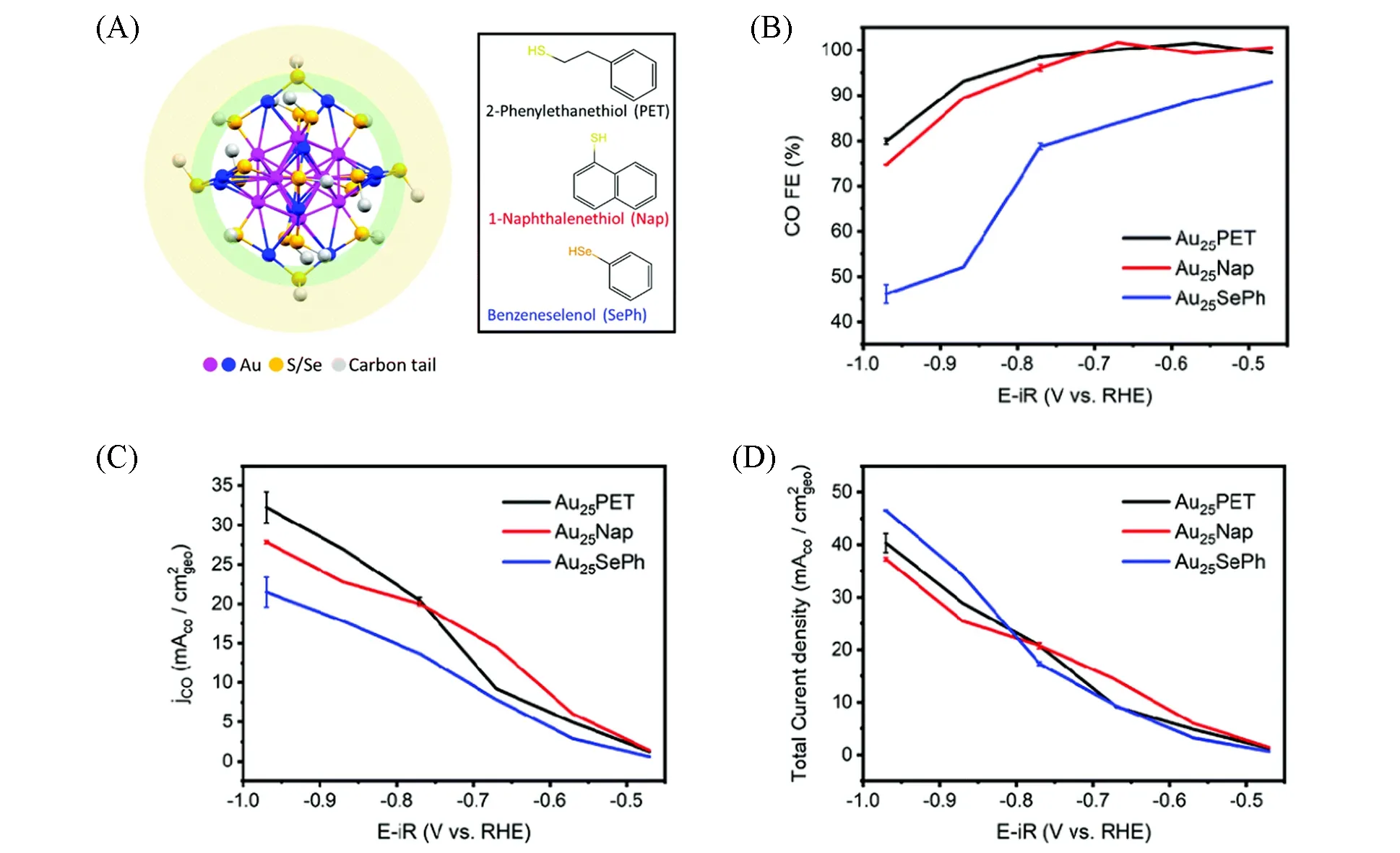
Fig.6 Catalytic performance of metal nanoclusters in CO2RR[63]
1.4 表面构型影响
研究者通过设计电催化剂的结构来调控CO2RR的催化活性和产物选择性,然而,目前普遍采用的多相复合电催化剂的结构和组成较为复杂,催化性质反映所有粒子的平均行为. 金团簇为揭示催化剂表面构型对CO2RR过程的影响机制提供了新的机会. Jin等[64]以2种尺寸相同(25个Au原子)、原子堆积结构不同的球状和棒状[Au2(5PPh3)1(0PET)5Cl2]2+团簇[晶体结构见图7(A)]为电催化剂,研究了催化剂的不同表面构型对CO2RR 性能的影响. 如图7(B)~(E)所示,在所有测试电位条件下,球状Au25团簇的FECO均保持在75%以上,并表现出更高的电流密度和CO生成速率,其最高的CO生成速率达到33.3 μL/min,是棒状Au25团簇的(11.7 μL/min)2.8 倍,且团簇结构未发生明显变化.DFT理论计算表明,球状Au25团簇表面的配体更容易部分脱除,暴露Au活性位点以稳定COOH*中间物种. 另外,球状Au25团簇所具有的负电荷也有利于稳定COOH*中间物种,从而获得更优异的电催化性能.
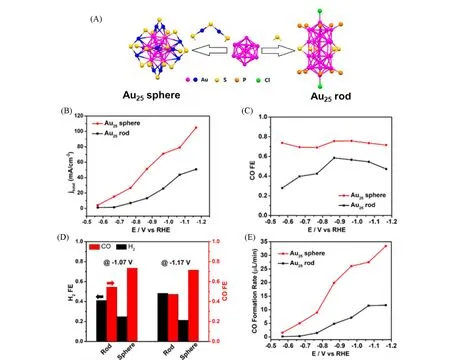
Fig.7 Structures and catalytic CO2RR performances of Au25 nanosphere and nanorod nanoclusters[64]
2021年,Wang等[65]探究了fcc结构的[Au55(p-MBT)24(Ph3P)6]3+(p-MBT=4-甲基苯硫酚)团簇和金纳米颗粒催化CO2RR的性能. 在0.1 mol/L KHCO3溶液中,碳负载型Au55催化剂具有更高的电催化性能,在−0.6 V(vs.RHE)条件下,FECO高达94.1%. 另外,在相同测试电位条件下,Au55电催化CO2还原产生CO 的质量活度比Au 纳米颗粒催化剂高12~30 倍. DFT 理论计算表明,这主要是由于Au55团簇表面的有机配体覆盖了fcc结构中的拐角位点,而此位点更有利于HER. 因此,表面配体抑制了HER 竞争反应,从而促进了主反应的进行. 该工作对设计更多高效CO2RR的金属纳米颗粒催化剂具有重要的借鉴意义. 例如,通过有机分子对fcc构型的金属纳米颗粒催化剂的拐角位点进行选择性修饰,提高金属纳米颗粒催化剂电催化CO2的转化效率.
另外,在多相催化体系中,催化剂表面配位数低或者配位不饱和的金属原子一般被认为是催化活性中心,不同有机配体保护的金属团簇表面也具有不同的局部配位环境,对催化性能具有不同的影响. 2022 年,Wang 等[66]报道了金氢化纳米团簇[Au22H3(dppe)3(PPh3)8]3+(dppe=1,2-双二苯基膦基乙烷)的表面配位不饱和原子对CO2RR性能的影响. Au22H3纳米团簇的内核由2个Au11单元通过2个三角形面结合而成,此外,3个H原子桥接2个三角形界面上的6个配位不饱和Au原子. 研究表明,H原子和配位不饱和的Au原子在电催化CO2还原为CO的过程中发挥了关键作用. 由图8(A)和(B)可见,在整个测试电位范围内,Au22H3团簇比Au11团簇表现出更高的FECO和质量活度,如在−0.6 V(vs.RHE)下,其FECO为92.7%,质量活度为134 A/gAu,且反应10 h后CO分电流密度和FECO几乎保持不变,且反应后团簇的催化性能未发生变化,说明Au22H3是一种良好的CO2RR催化剂. DFT理论计算表明,氢化物配位的不饱和Au原子是催化活性中心,有利于关键COOH*中间体的形成. 此外,计算发现Au22H3团簇中H原子可以直接与CO2加氢生成吸附态COOH*物种,然后发生电化学质子还原形成吸附态CO*和H2O[图8(C)]. 从反应历程来看,虽然CO*在Au22H3上的解吸能垒比在Au11上的高,但Au11表面形成COOH*中间体要比在Au22H3表面上困难得多,这主要是由于Au11团簇需要电解质中的质子还原才能形成COOH*,致使Au22H3表现出更好的催化性能. 因此,在金团簇结构中引入Au—H共价键,也是提高团簇结构稳定性和催化活性的有效方法. 值得注意的是,Au22H3中晶格氢化物的行为与Cu-H团簇体系中的不同,后者主产物为甲酸[67].

Fig.8 Selectivity and activity of[Au22H3]3+and[Au11]3+in CO2RR to CO[66]
2 异原子掺杂的金团簇对CO2RR性能的影响
2.1 镉(Cd)原子掺杂
金团簇的核心或壳层原子被其它异金属原子取代,往往会改变金团簇的电子特性,进而改变其催化性能. Wu等[42]通过两相反伽伐尼还原法,以Au44(TBBT)28(TBBT=对叔丁基苯硫酚)团簇为模板进行金属Cd 原子掺杂,合成了具有硬球随机密排列结构的Au47Cd2(TBBT)31团簇,并研究了掺杂对CO2RR性能的影响. 线性伏安扫描曲线[LSV,图9(A)]表明,与Au44团簇和传统的金纳米粒子相比,Au47Cd2团簇表现出最高的电流密度,其起始过电位比Au44和1.5 nm金纳米粒子分别低85和122 mV,说明Cd原子掺杂促进了CO2RR. 另外,由图9(B)和(C)可见,在整个反应电位范围内,Au47Cd2表现出最高的FECO和CO电流密度,在−0.57 V(vs.RHE)条件下,FECO达到96%,CO电流密度达到3.2 mA/cm2,且具有优异的电催化稳定性[图9(D)]. 此外,Au47Cd2,Au44和Au纳米颗粒的塔菲尔斜率分别为151,166和203 mV/dec,说明这3种催化剂催化CO2RR过程中的决速步为吸附态的CO2得到1个电子形成中间体;同时也说明Au47Cd2催化形成中间体的速度快于Au44和金纳米粒子,有助于降低反应过电位,提高催化活性. DFT理论计算表明,Cd原子的引入改变了COOH*物种在团簇表面的吸附构型,Cd原子更倾向于与氧原子结合,形成Cd-O-C(OH)-Au以稳定COOH*中间体. 另外,DFT计算还表明,Cd原子掺杂可以抑制HER竞争反应,进一步提高FECO.

Fig.9 Selectivity and activity of metal nanoclusters in CO2RR to CO[42]
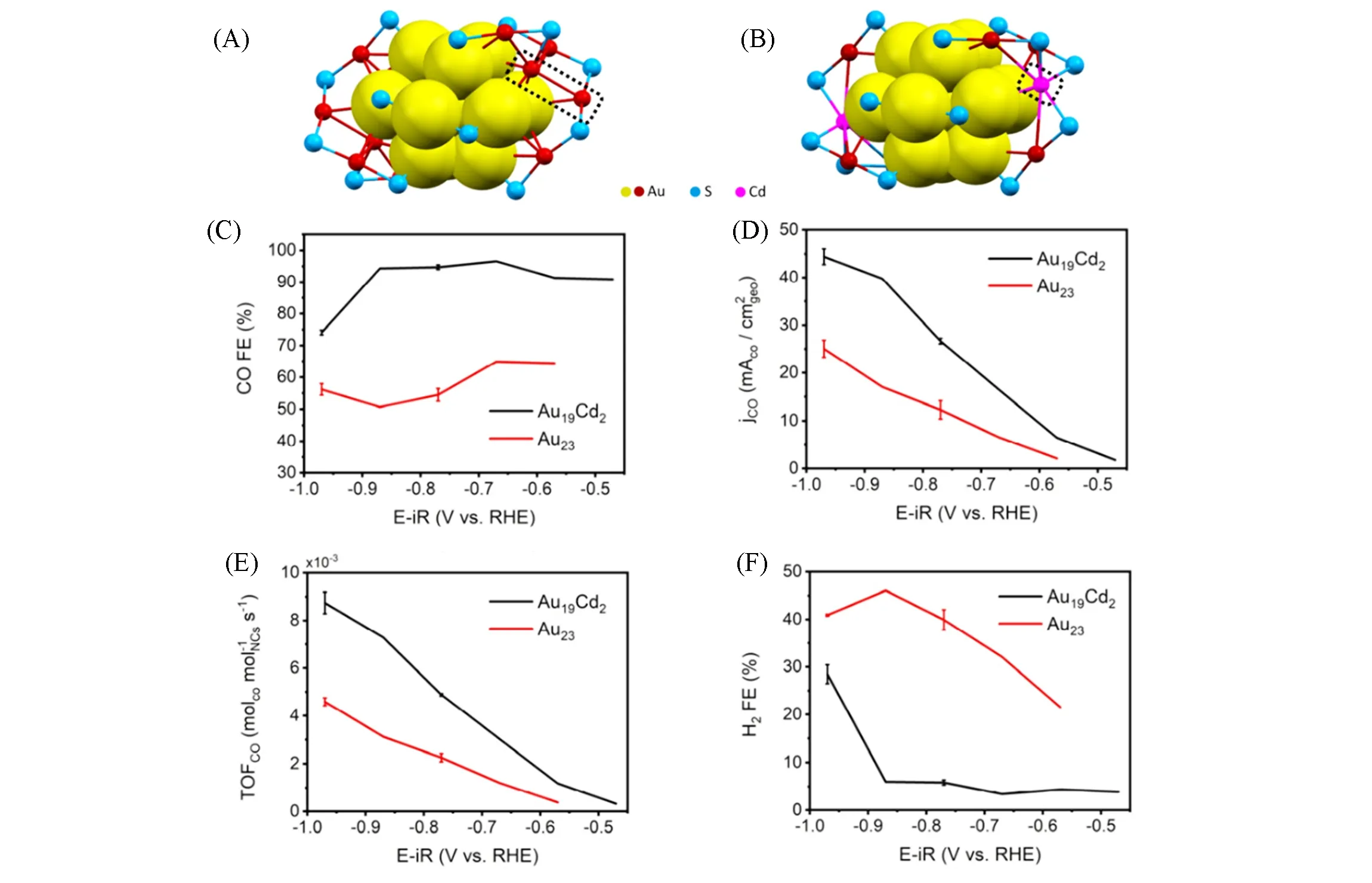
Fig.10 Catalytic performance of metal nanoclusters in CO2RR[41]
Jin等[41]在Au23(S-c-C6H11)16(S-c-C6H11=环己硫醇)团簇的基础上,通过引入Cd原子对其表面进行修饰,合成了Au19Cd2(S-c-C6H11)16团簇. 从图10(A)和(B)所示团簇晶体结构可以看出,Au23和Au19Cd2团簇具有相同的内核结构,表面结构因Cd原子的引入略有不同. 他们将该团簇用于CO2RR,研究了表面掺杂对CO2RR 性能的影响. 结果表明,Au19Cd2团簇在−0.5 V~−0.9 V(vs.RHE)范围内,保持了90%~95%的FECO,是Au23团簇的2 倍[图10(C)],CO 分电流密度和周转频率(TOF)也有类似的趋势[图10(D)和(E)],且反应后团簇结构几乎未发生改变. 此外,Cd原子掺杂可以很好地抑制HER竞争反应,在测试电位范围内,FEH2仅为5%,远远低于Au23团簇体系[图10(F)],这与Au47Cd2团簇催化CO2RR的结果一致[42]. DFT理论计算表明,完全受配体保护的金团簇对CO2RR没有催化活性. 对比两个团簇中分别脱除配体有机碳链(—R)或整个硫醇配体(—SR)基团暴露硫原子和金原子所需的能量,发现脱除部分—R基团比去除—SR基团需要的能量更低,且发现暴露的Au活性位点更有利HER. 因此,推测暴露的硫原子是CO2RR的活性中心. 另外,通过计算两个团簇上—R脱除后的CO2RR和HER的反应自由能,发现在Au19Cd2上CO*中间体的生成程度远高于Au23,说明Cd原子的掺杂有利于CO*中间体的形成,从而促进了CO2RR的整体反应过程.
Zhu等[68]以Au25(PET)18,Au24Cd1(PET)18,Au19Cd3(S-tol)18(S-tol=对甲基苯硫酚)和Au38Cd4(d-MBT)30(d-MBT=3,5-二甲基苯硫醇)团簇为催化剂,研究了Cd 原子掺杂以及不同取代位点的Cd 原子掺杂对CO2RR 催化性能的影响. 由图11 可见,Cd1Au24团簇中Cd 原子取代内核“订书钉”结构上的Au 原子,Cd3Au19和Cd4Au38团簇中Cd 原子取代外壳“订书钉”结构上的Au 原子,这也说明通过控制合成可以将Cd原子掺杂到金团簇的特定位置. 图12(A)中LSV曲线表明,这些团簇均可以有效地发生CO2RR,且Cd1Au24表现出最高的电流密度,其次是Cd4Au38和Au25,Cd3Au19表现出最小的电流密度,CO 产物的分电流密度具有同样的趋势. 由图12(B)~(E)可见,Cd1Au24在所测试电位范围内FECO最高,保持在70%~85%,具有最大的CO分电流密度,且甲酸盐的选择性随测试电位的增加逐渐降低. 在−0.4 V(vs.RHE)的电压下,Cd1Au24上的CO 和甲酸盐的法拉第效率加和[FE(CO+HCOO−)]高达96.3%,而Cd3Au19和Cd4Au38团簇具有最低的FE(CO+HCOO−). 此外,图12(F)所示稳定性实验结果表明,Cd1Au24和Cd3Au19双金属团簇均具有良好的电催化耐久性,而Cd4Au38在反应24 h后电流密度降低,可能是发生轻微的聚集. 这说明Cd原子掺杂在团簇内核“订书钉”结构上的Cd1Au24的催化活性和稳定性要优于外壳“订书钉”结构上Cd取代的Cd3Au19和Cd4Au38. 因此,并不是所有位点的Cd原子掺杂均可以提升团簇催化CO2RR的性能. DFT理论计算表明,团簇表面配体有机碳链脱除(S—C键断裂)暴露的硫位点有利于CO2RR,而随后金属-硫键(M—S)断裂暴露的金属位点反而有利于HER 反应的发生. Au25团簇结构中会同时发生S—C和M—S键断裂,在发生CO2电还原的同时也有利于HER;而Cd原子掺杂的Cd1Au24,仅发生S—C键断裂,不仅避免了Cd—S键本身的断裂,同时保护了Cd1Au24团簇的远端Au—S键不受电化学还原的影响,从而阻止了M—S键的断裂,减少了HER的发生,表现出显著的FE(CO+HCOO−). Cd3Au19中断键类似于Cd1Au24,但其催化性能较低,主要归因于其S—C键断裂暴露活性位点较晚. Cd4Au38中M—S键断裂的起始过电位与Au25相似,但机制不同. 研究还发现,通过配体修饰可以实现更早的S—C键断裂或阻止M—S 键的断裂,进一步提高Cd1Au24的电催化CO2RR 性能. 如正丁硫醇配体保护的Cd1Au24发生S—C键断裂的起始过电位更低,FECO较苯乙硫醇保护的Cd1Au24稍有提高;而对叔丁基苄硫醇和3,5-二甲基苯硫酚保护的Cd1Au24由于其S—C键断裂起始电位较晚而降低了活性物质的浓度. 因此,金团簇表面的有机配体不仅影响团簇结构的稳定性,同时影响团簇在催化反应中的性能.
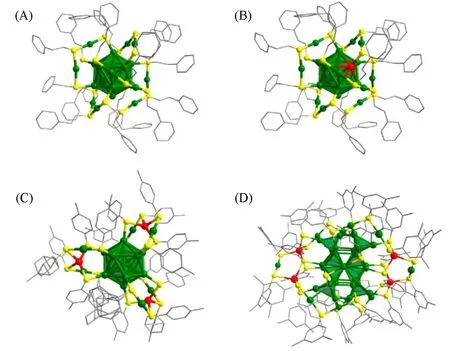
Fig.11 Crystal structures of Au25(PET)18(A), Au24Cd1(PET)18(B), Au19Cd3(S⁃tol)18(C) and Au38Cd4(d⁃MBT)30 nanoclusters(D)[68]
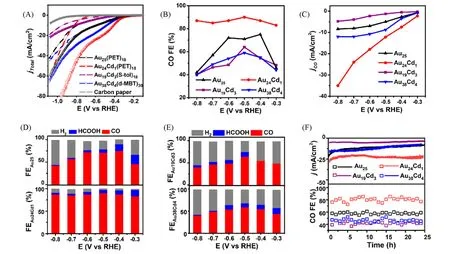
Fig.12 Catalytic performance of metal nanoclusters in CO2RR[68]
2.2 钯(Pd)原子掺杂
Jin 等[69]对比研究了中心原子掺杂的Pd1Au24(PET)18和未掺杂的Au25(PET)18团簇[晶体结构见图13(A)]在CO2RR中的催化性能. 由图13(B)~(D)可见,在−0.6~−1.3 V(vs.RHE)测试电位范围内,Pd1Au24的电催化性能优于Au25团簇,尤其在较高测试电位条件下,Pd1Au24表现出接近100%的FECO. 同时表现出极高的CO 分电流密度和质量活度,如在−1.2 V(vs.RHE)时,Pd1Au24的质量活度(1770 mA/mg)约为Au25(980 mA/mg)的2 倍. DFT 理论模拟表明,金团簇在中等过电位的条件下脱除配体中有机碳链以暴露硫原子活性位点更有利,但在足够大的过电位条件下,整个硫醇配体会发生脱除并暴露金原子活性位点. 硫原子被认为是选择性CO2还原的活性位点,而Au原子则被认为更有利于HER.与Au25相比,Pd原子掺杂可以诱导配体在反应过程中的稳定性,从而保留更多的S原子活性位点,扩大了选择性CO2还原的电位范围. 此外,研究还表明,去除整个配体或脱除配体中有机碳链部分均不会显著改变纳米团簇的结构,其中Pd原子仍然处在金团簇内核的中心位置.
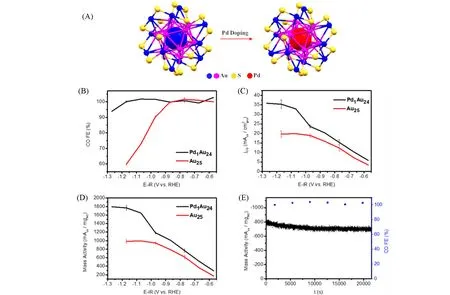
Fig.13 Catalytic performances of different metal nanoclusters in CO2RR[69]
2.3 铂(Pt)原子掺杂
2021年,Yoo等[70]将团簇、炭黑、Nafion溶液和四氢呋喃溶液滴涂在气体扩散电极(GDE)上制备了复合工作电极,在0.1 mol/L KHCO3和0.4 mol/L KCl电解液中进行控制电位电解实验(CPE),以探究Pt原子掺杂的Pt1Au24团簇在CO2RR 中的电催化性能,其中加入KCl 是为了增加KHCO3缓冲溶液的电导率. 由图14(A)~(D)可见,在低过电位条件下,Au25团簇上几乎只产生CO,随过电位的增加,CO分电流密度逐渐增大至趋于稳定,总电流密度和H2分电流密度逐步增大. 与Au25团簇相比,Pt原子掺杂的Pt1Au24更倾向于发生HER 得到H2产物. 有意思的是,将其与Au25团簇简单混合,即可控制得到不同H2/CO比的合成气产物. 由图14(E)可见,在GDE上将Au25∶Pt1Au24催化剂质量比设定为1∶0,2∶1,1∶2和0∶1,可以制备H2/CO摩尔比分别接近为1,2,3和4的合成气. 这项工作为电催化CO2RR产生不同比例的合成气提供了一种有效策略.
3 金团簇结构对CO2RR机理的影响
水相CO2RR分为3个步骤:(1)CO2分子吸附到催化剂表面;(2)电子转移/质子迁移;(3)目标产物从催化剂表面脱附并扩散到电解质中. 研究人员普遍认为金团簇催化水相CO2RR生成CO的反应步骤为式(1)~式(3);同时,水相CO2RR过程中还存在HER竞争反应,其反应步骤为式(4)~式(6). 不同结构的金团簇主要通过影响关键中间物种的形成及其稳定性影响CO2RR的反应路径. 金团簇表面由有机配体包裹,研究表明,完全受配体保护的金团簇对CO2RR没有催化活性. 因此,在CO2RR反应过程中,有机配体在过电位的作用下会发生部分脱落以暴露活性位点. 配体脱落或配体中有机碳链部分脱落以及脱落的具体数量等,对活性位点产生显著的影响,进而影响中间物种如*COOH,CO*和H*等形成,最后影响反应路径和产物选择性. 因此,通过调控金团簇表面的有机配体、内核结构以及掺杂等可有效调控CO2RR过程,进而调控其催化活性和产物选择性.
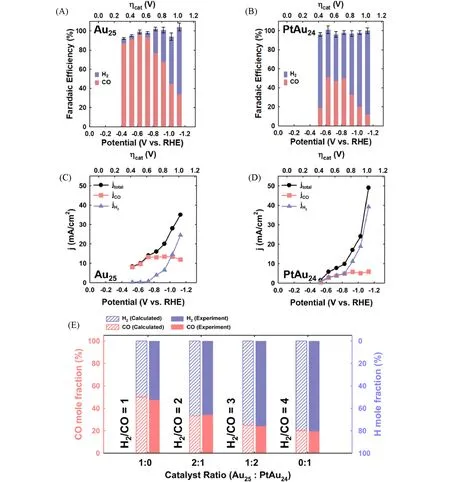
Fig.14 Catalytic performances of different metal nanoclusters in CO2RR[70]
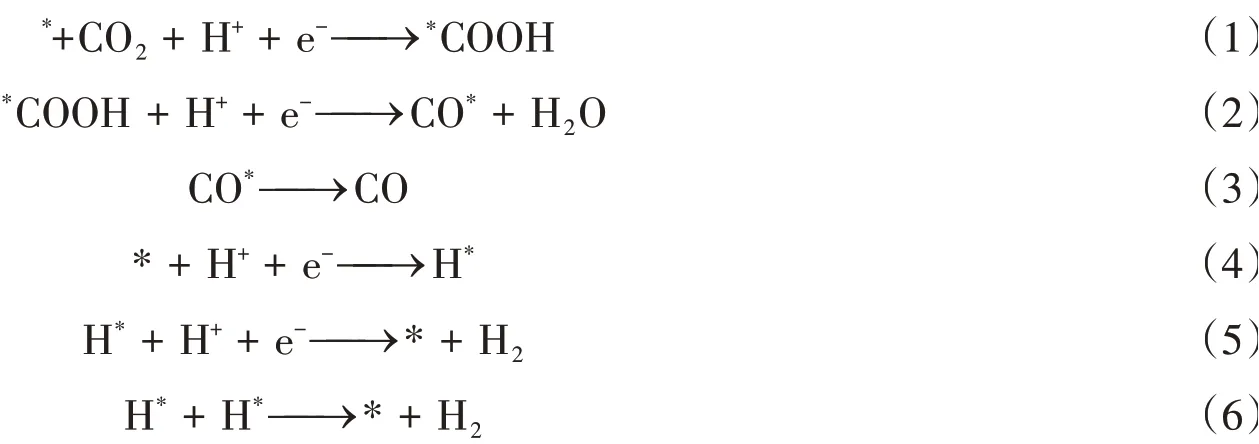
4 总结与展望
金团簇作为一种极具发展前景的纳米催化剂受到广泛关注. 本文综合评述了金团簇在CO2RR中的最新研究进展,详细探讨了金团簇的尺寸、电荷、配体、结构以及异原子掺杂对CO2RR性能的影响. 金团簇催化CO2RR具有几个共同的特点:(1)气相主产物为CO和H2,液相产物含有少量的甲酸;(2)金团簇的催化性能远高于金纳米颗粒和大块金电极的电催化活性;(3)带负电荷的金团簇因较强的吸附作用可以更好地活化底物,因而表现出优异的催化活性;(4)金团簇表面的配体会影响催化活性和稳定性,其中含氮配体可以提升金团簇的稳定性和催化活性,配体中有机碳链通过影响金团簇表面S—C键和M—C键的断裂来影响催化活性和选择性,尽管在反应中有部分配体脱落,但团簇结构未发生显著变化;(5)不同的表面结构对COOH*关键反应中间物种的稳定程度不同,表现出不同的催化活性和产物选择性,尤其是通过配体对表面活性位点进行修饰可抑制HER反应,另外,金氢化纳米团簇表面的H 原子和配位不饱和Au 原子也可以有效地促进CO2RR 反应;(6)Pt 原子掺杂有利于HER 反应,Pd原子和Cd 原子掺杂可以促进CO2RR,提高FECO和电流密度,不同取代位置的Cd 原子掺杂金团簇在CO2RR中表现出不同的催化活性,其中Cd原子取代内核“订书钉”结构上的金团簇的催化性能优于Cd原子取代外壳“订书钉”结构上金团簇;(7)金团簇表面的配体脱除有机碳链暴露的S原子或者整个配体脱除暴露的Au原子被认为是CO2RR中的活性位点,其中大多数研究者认为S原子位点有助于CO2电还原为CO,Au原子位点有助于HER,但也有部分研究者认为Au原子位点是CO2电还原为CO的活性位点. 可见,金团簇在揭示催化剂构效关系和催化机理方面具有独特的优势. 然而,进一步提高金团簇催化CO2RR的性能、拓展金团簇在CO2RR中的应用仍面临着诸多挑战.
目前,传统的表征方法难以原位监测表面配体以及金属团簇结构在反应过程中的演变,准确测量配体的脱落数量更具挑战. 此外,在有机配体存在的情况下,CO2分子在金团簇表面的吸附构型和吸附强度、催化活性位点、中间物种/产物的演化以及金团簇的结构稳定性等也需要通过原位表征技术进一步监测. 因此,探索能够有效识别反应过程中金团簇结构演化的原位表征技术,对于进一步研究金团簇催化CO2RR是非常必要的. 如,探索将电化学原位衰减全反射表面增强红外/拉曼光谱、振动斯塔克位移光谱、小角中子散射和小角度X-射线散射等技术用于金团簇催化CO2RR过程中团簇结构演变和反应中间体的监测等.
另外,金属纳米团簇催化CO2RR仍面临着诸多难点,如催化效率相对较低,产物主要是CO和甲酸等. 希望未来可以通过合成更多的掺杂双金属团簇提高CO2RR的催化效率,调控产物选择性. 尽管金团簇的掺杂研究已经取得较大进展,但仍有许多科学问题有待进一步解决. 如:能否预知在金团簇不同结构位点上异质金属原子掺杂的可能性,为后续金团簇掺杂提供理论指导;能否在原子/分子水平上有效控制异质金属原子取代金团簇的不同结构位点,从而掌握金属原子掺杂位点的规律;如何根据掺杂双金属纳米团簇的结构精准地调控CO2RR的催化反应历程,获得高效的催化活性和选择性,以及深入理解金属纳米团簇结构与催化性能之间的构效关系. 因此,通过DFT计算初步模拟,评价和预测异质原子掺杂可能性及其催化活性,是实现理论指导实验定向合成的有效途径. 总之,具有精确结构的金团簇在催化基础研究中具有广阔的应用前景,未来的研究工作有望进一步推动CO2RR的发展.

