绿原酸对脓毒症致大鼠急性肾损伤的保护作用
冯秀晶 , 辛 秀 , 黄 静 , 赵玉博 , 刘敬轩 , 唐琦超
(1.吉林农业科技学院动物科技学院 , 吉林 吉林 132101 ; 2.预防兽医学吉林省重点实验室 , 吉林 吉林 132101)
目前兽医临床常见的子宫蓄脓、深层脓皮症或严重外科感染等,因感染较严重或者治疗不及时等原因,常常会继发脓毒症,导致动物多器官功能障碍,甚至死亡[1]。脓毒症的发病率和病死率都极高,一项研究表明,伴有器官衰竭的脓毒症的犬的发病率和病死率分别高达70%和47%[2-3]。脂多糖(Lipopolysaccharide,LPS)作为内毒素的主要成分,广泛用于在动物模型中复制试验性脓毒症诱导的多器官损伤[4],其中肾脏是其主要损伤的靶器官。目前兽医临床尚未开发出针对脓毒症致急性肾损伤(Acute kidney injury,AKI)的有效治疗药物和干预措施。绿原酸(Chlorogenic acid,CGA)是杜仲、金银花、绿咖啡豆等众多中草药的活性成分之一,具有良好的抗肿瘤、抗氧化、抗炎等功效[5]。有研究表明,CGA作为金银花提取物的主要抗炎成分,可通过抑制机体炎症反应,改善LPS诱导的小鼠内毒素血症及其导致的肺损伤[6-7],也可提高盲肠结扎和穿孔诱导的脓毒症大鼠的存活率。此外,CGA还可通过激活核因子E2相关因子2(Nuclear factor E2 related factor 2,Nrf2)信号通路,改善机体氧化应激反应,减少炎症因子及自由基生成,减轻脓毒症大鼠炎症反应[8]。但对于CGA是否能够对脓毒症致AKI发挥保护作用仍未可知。因此,本试验建立大鼠脓毒症致AKI模型,应用CGA进行干预,探究CGA对脓毒症致AKI的保护作用及其机制。
1 材料与方法
1.1 实验动物与饲养 40只健康成年雄性SD大鼠,体重220~250 g,购自吉林大学实验动物中心。大鼠饲养在标准实验室中,保持通风良好,温度控制在 22~24 ℃,相对湿度保持在45%~55%,自由采食饮水,所有大鼠在试验前适应环境1周。
1.2 主要试剂 脂多糖(LPS),购自Sigma-Aldrich公司;绿原酸(CGA),购自Sigma-Aldrich公司;肾损伤分子1(Kidney injury molecule 1,KIM-1)、中性粒细胞明胶酶相关脂质运载蛋白(Neutrophil gelatinase-associated lipocalin,NGAL)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素6(Interleukin 6,IL-6)、白细胞介素1β(Interleukin 1β,IL-1β)、白细胞介素18(Interleukin 18,IL-18)、活性氧(Reactive oxygen species,ROS)、丙二醛(Malondialdehyde,MDA)和超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒,均购自南京建成生物工程研究所;甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)、血红素氧合酶1(Heme oxygenase-1,HO-1)、醌氧化还原酶1(Quinone oxidoreductase 1,NQO1)抗体,均购自沈阳万类生物科技有限公司;核因子E2相关因子2(Nrf2)抗体,购自Santa Cruz公司;4%多聚甲醛、BCA试剂盒和RIPA裂解液,均购自上海碧云天生物科技有限公司。
1.3 仪器设备 RM2245半自动轮转式切片机,购自德国Leica公司;SK210生物显微镜,购自麦克奥迪实业集团有限公司;1-14K高速低温离心机,购自Sigma公司;VERSA max酶标仪,购自美国Molecular Devices公司;SCIENTZ-48L组织研磨仪,购自宁波新芝生物科技股份有限公司;Tocan恒温摇床,购自上海领成生物科技有限公司;PHS-3C型自动pH计,购自上海仪电科学仪器股份有限公司;YXQ-50S11高压蒸汽灭菌器,购自上海博讯实业有限公司医疗设备厂;通用型电泳仪、转膜仪,均购自美国Bio-Rad公司;Chemi XT4化学发光分析系统,购自基因有限公司。
1.4 试验分组及处理 将40只健康成年雄性SD大鼠随机分为5个组,分别为对照组(CON组)、绿原酸组(CGA组)、模型组(LPS组)、绿原酸干预组(CGA+LPS组)和Nrf2抑制剂组(ML385+CGA+LPS组),每组8只。CON组不做任何处理;CGA组腹腔注射CGA[20 mg/(kg·bw),溶于无菌生理盐水];LPS组腹腔注射LPS[10 mg/(kg·bw),溶于无菌生理盐水];CGA+LPS组腹腔注射CGA[20 mg/(kg·bw)],1 h后腹腔注射LPS[10 mg/(kg·bw)];ML385+CGA+LPS组腹腔注射ML385[Nrf2抑制剂,30 mg/(kg·bw)],30 min后其余处理同CGA+LPS组。
1.5 样品收集与处理 大鼠腹腔注射LPS 4 h后,使用异氟醚麻醉,通过膀胱采集尿液样本、心脏采集血液样本,将尿液和血液样本放在室温静置30 min后,4 ℃条件下3 000 r/min离心10 min,吸取上清液,用于肾脏功能和血清炎症因子检测;取左侧肾脏组织,放入4%多聚甲醛溶液中固定,用于苏木精-伊红(H.E.)染色和免疫组化试验;取右侧肾脏组织,放入-80 ℃保存,用于氧化应激指标检测和Western blot试验。
1.6 大鼠肾脏功能检测 使用全自动生化分析仪测定血清尿素氮(Urea nitrogen,BUN)和肌酐(Creatinine,Cre)的水平。按照ELISA试剂盒说明书操作,测定尿液中KIM-1和NGAL的水平。
1.7 大鼠血清炎症因子检测 按照ELISA试剂盒说明书操作,测定大鼠血清TNF-α、IL-6、IL-1β和IL-18水平。
1.8 大鼠肾脏H.E.染色 肾脏在4%多聚甲醛溶液中至少固定24 h后,在梯度乙醇中进行脱水,二甲苯透明后,进行石蜡包埋、切片、染色,光学显微镜对肾脏切片进行观察。参照参考文献[9]方法,使用0~4分制对肾皮质肾小管损伤程度进行分级:0=正常;1=轻度损伤(<25%);2=中度损伤(25%~50%);3=严重损伤(50%~75%);4=更严重损伤(>75%)。
1.9 大鼠肾脏氧化应激指标检测 根据试剂盒说明书操作,检测肾脏组织ROS、MDA含量和SOD活性。
1.10 Western blot法检测蛋白表达量 称取100 mg大鼠肾脏组织,加入RIPA裂解液后,匀浆取上清液备用,进行蛋白浓度测定(BCA法),向蛋白样本中按比例加入蛋白上样缓冲液和稀释液,充分混匀,在金属浴中煮沸10 min,室温冷却后存储于-80 ℃冰箱中保存备用。通过制备分离胶和浓缩胶、电泳、转膜、封闭、一抗孵育(Nrf2、HO-1和NQO1)、二抗孵育、洗膜、滴加ECL发光液后,进行化学发光检测。
1.11 免疫组化法检测Nrf2细胞核易位情况 肾脏组织蜡块用二甲苯脱蜡,不同浓度乙醇水化,3% H2O2孵育封闭。在室温下与山羊血清孵育后,将Nrf2抗体加入封闭液中,4 ℃过夜孵育后,与相应二抗结合,在37 ℃孵育30 min,用DAB洗涤和显色。切片用苏木精复染,使用光学显微镜观察染色切片。
2 结果
2.1 CGA对LPS致AKI大鼠肾脏功能的影响 大鼠肾脏功能检测结果见图1,与CON组相比,LPS组血清BUN和Cre水平、尿液KIM-1和NGAL水平极显著升高(P<0.01);与LPS组相比,CGA+LPS组血清BUN和Cre水平、尿液KIM-1和NGAL水平极显著降低(P<0.01);与CGA+LPS组相比,ML385+CGA+LPS组上述4个指标水平极显著升高(P<0.01);CON组与CGA组相比,上述4个指标无统计学差异(P>0.05)。
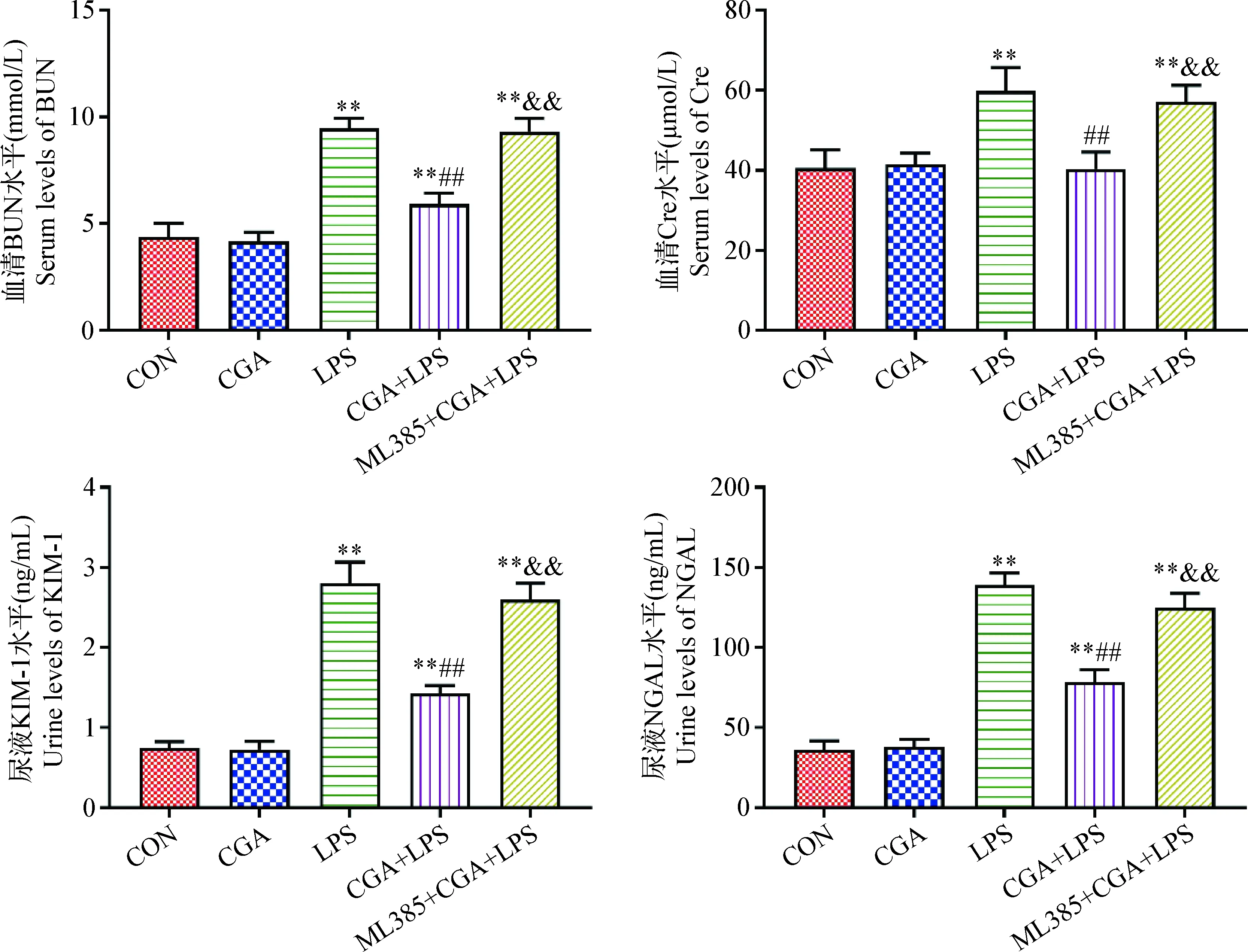
图1 各组大鼠肾脏功能检测Fig.1 Kidney function of rats in each group与CON组相比,* :差异显著(P < 0.05),** :差异极显著(P<0.01);与LPS组相比,##:差异极显著(P<0.01);与CGA+LPS组相比,&&:差异极显著(P<0.01);下同Compared with the CON group, * : significant difference(P < 0.05), ** : extremely significant difference(P<0.01); Compared with the LPS group, ##: extremely significant difference(P<0.01); Compared with the CGA+LPS group, &&: extremely significant difference(P<0.01). The same as below
2.2 CGA对LPS致AKI大鼠血清炎症因子的影响 大鼠血清炎症因子检测结果见图2,与CON组相比,LPS组血清TNF-α、IL-6、IL-18和IL-1β水平极显著升高(P<0.01);与LPS组相比,CGA+LPS组血清TNF-α、IL-6、IL-18和IL-1β水平极显著降低(P<0.01);与CGA+LPS组相比,ML385+CGA+LPS组上述4个指标的水平被明显逆转,极显著升高(P<0.01);CON组与CGA组相比,上述4个指标无统计学差异(P>0.05)。

图2 各组大鼠血清炎症因子检测Fig.2 Serum inflammatory factors of rats in each group
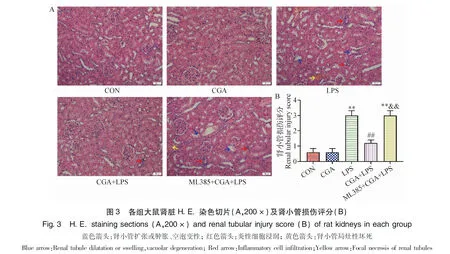
2.3 CGA对LPS致AKI大鼠肾脏组织显微结构的影响 对肾脏组织进行病理组织学观察,结果见封二图3A,CON组和CGA组肾小管和肾小球结构均正常;LPS组肾小管出现严重的扩张或肿胀、空泡变性、炎性细胞浸润、肾小管局灶性坏死等明显的病理变化;CGA+LPS组可见肾小管损伤减轻,表现为肾小管轻度扩张,少量炎症细胞浸润;ML385+CGA+LPS组明显逆转了CGA的保护作用,病理变化同LPS组。大鼠肾组织病理学损伤评分结果见封二图3B,与CON组相比,LPS组肾小管损伤评分极显著升高(P<0.01);与LPS组相比,CGA+LPS组肾小管损伤评分极显著降低(P<0.01);与CGA+LPS组相比,ML385+CGA+LPS组肾小管损伤评分极显著升高(P<0.01)。
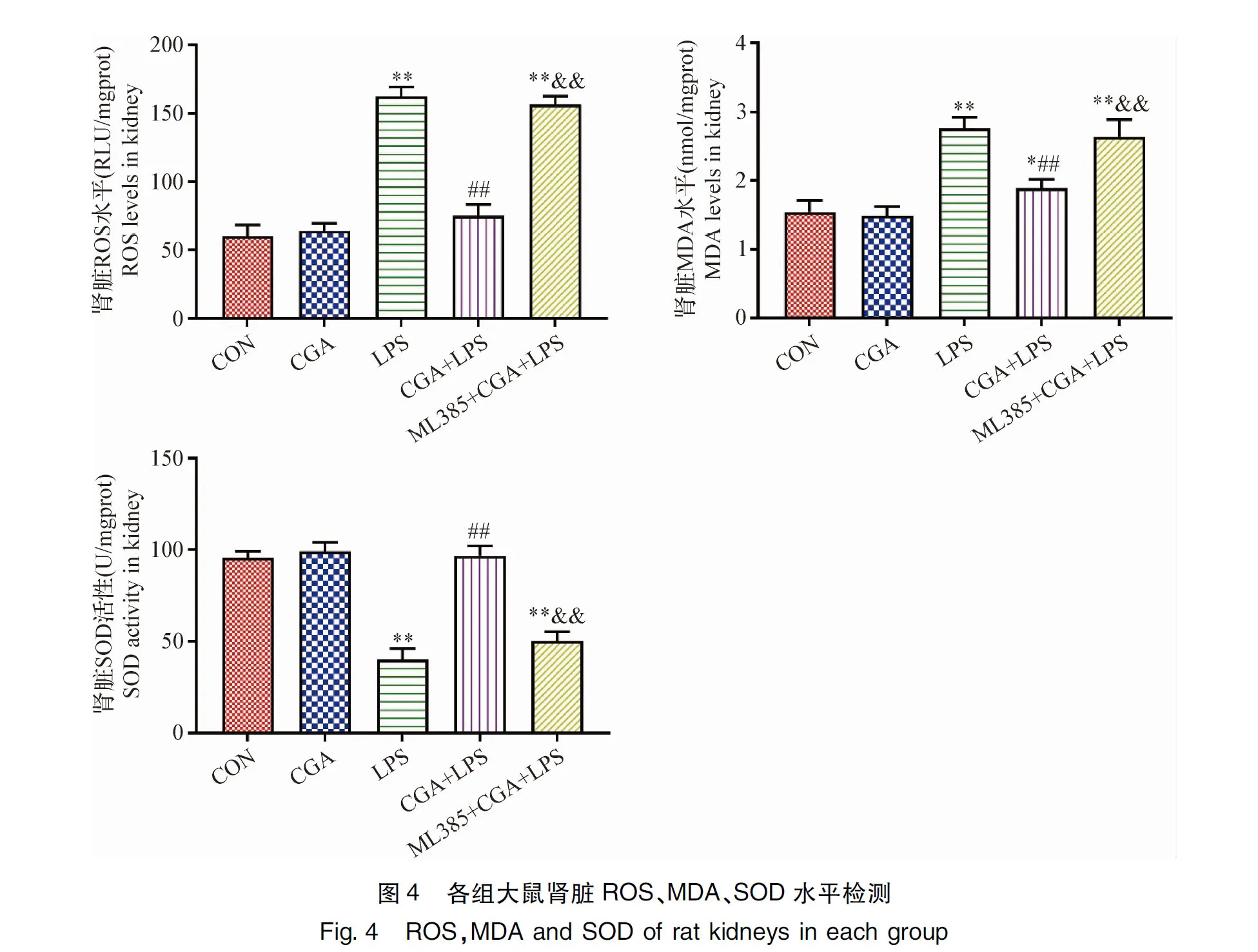
2.4 CGA对LPS致AKI大鼠肾脏氧化应激指标的影响 大鼠肾脏氧化应激指标检测结果见封二图4,与CON组相比,LPS组ROS、MDA水平极显著升高(P<0.01),SOD活性极显著降低(P<0.01),CGA+LPS组MDA水平显著升高(P<0.05);与LPS组相比,CGA+LPS组ROS、MDA水平极显著降低(P<0.01),SOD活性极显著升高(P<0.01);与CGA+LPS组相比,ML385+CGA+LPS组ROS、MDA水平极显著升高(P<0.01),SOD活性极显著降低(P<0.01)。
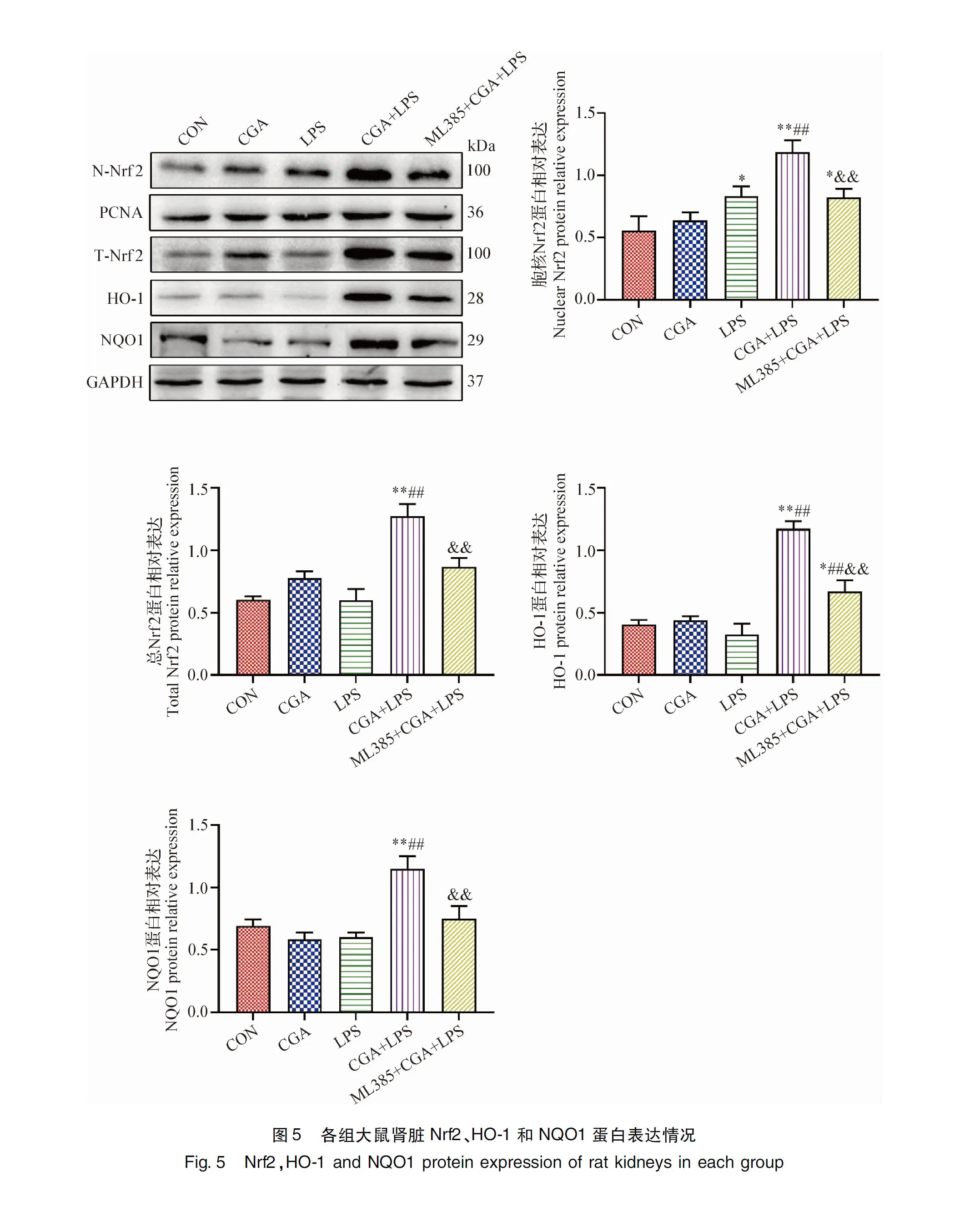
2.5 CGA对LPS致AKI大鼠Nrf2/HO-1通路蛋白表达的影响 Western blot结果见封三图5,与CON组相比,LPS组N-Nrf2蛋白表达量显著升高(P<0.05),其余蛋白表达量差异不显著(P>0.05),CGA+LPS组N-Nrf2、T-Nrf2、HO-1、NQO1蛋白表达量极显著升高(P<0.01);与LPS组相比,CGA+LPS组N-Nrf2、T-Nrf2、HO-1、NQO1蛋白表达量极显著升高(P<0.01);与CGA+LPS组相比,ML385+CGA+LPS组N-Nrf2、T-Nrf2、HO-1、NQO1蛋白表达量极显著降低(P<0.01)。
2.6 CGA对LPS致AKI大鼠Nrf2表达的影响 免疫组化检测结果见图6,与CON组相比,LPS组Nrf2细胞核易位差异不显著(P>0.05),CGA+LPS组Nrf2细胞核易位情况极显著升高(P<0.01);与LPS组相比,CGA+LPS组Nrf2细胞核易位情况极显著升高(P<0.01);与CGA+LPS组相比,ML385+CGA+LPS组Nrf2细胞核易位情况极显著降低(P<0.01)。

图6 各组大鼠肾脏Nrf2免疫组化染色Fig.6 Nrf2 immunohistochemical staining of rat kidneys in each group
3 讨论
内毒素是导致脓毒症的常见原因[10]。LPS作为内毒素的主要成分,已被报道参与脓毒症的病理过程[11]。因此,根据先前的研究结果[12],本试验通过腹腔注射LPS[10 mg/(kg·bw)]4 h,建立大鼠脓毒症模型。此外,大量动物模型的相关研究已经证明CGA 对肾功能存在有益影响[13-14]。BUN和Cre是肾损伤的常规和关键标志物,而KIM-1和NGAL被确定为AKI的生物标志物。本试验发现,CGA显著减弱了LPS诱导的上述4种标志物的产生,表明CGA对LPS诱导的肾损伤具有显著的改善作用。此外,CGA干预显著减轻了LPS诱导的肾脏显微结构损伤。因此,本试验结果证实,CGA对 LPS诱导的大鼠AKI具有显著的保护作用。
以往研究表明,炎症反应在脓毒症致AKI的起始和延伸阶段都发挥着重要的作用,炎症因子如TNF-α、IL-6、IL-1等分泌增加均可促进AKI的发生发展[15-16]。这与本试验结果相一致,LPS组血清TNF-α、IL-6、IL-1β和IL-18水平显著升高,表明炎症反应是脓毒症致AKI的主要致病机制。CGA预处理后显著降低了TNF-α、IL-6、IL-18和IL-1β水平,这与之前的结果一致[17],表明CGA介导的炎症抑制在缓解LPS诱导的AKI中发挥重要作用。以上结果表明,炎症反应在LPS致AKI的过程中发挥着重要的作用,因此,抑制机体炎症反应可能是多种药物防治脓毒症致AKI的关键作用靶点。
ROS诱导的氧化损伤可促进AKI的发生发展。CGA预处理可以减轻大鼠肾脏损伤和氧化炎症[18]。本试验分析了肾脏氧化应激标志物ROS和MDA的含量以及抗氧化剂SOD的活性。与对炎症标志物的影响一致,CGA治疗逆转了LPS诱导的ROS和MDA水平的增加以及SOD活性的降低,表明CGA在减少LPS诱导的氧化损伤方面发挥着重要作用。因此推测CGA可通过调节氧化和抗氧化状态之间的平衡,从而保护肾脏组织免受氧化应激引起的损伤。
绿原酸(CGA)广泛存在于多种植物中,是许多中药材和中成药的主要有效成分之一,具有抗炎、抗氧化、抗菌、抗病毒等多种药用功效。有研究表明,CGA对盲肠结扎穿刺法(CLP)诱导的小鼠脓毒症死亡率和多器官损伤具有显著的保护作用[19]。本试验发现,CGA显著改善了脓毒症大鼠肾脏功能,恢复肾脏器质性损伤。此外,有研究表明CGA可通过抑制TLR4/NF-κB信号通路,降低TNF-α、IL-1β和IL-6水平,从而减轻LPS诱导的AKI[20]。本试验结果表明,CGA显著抑制LPS诱导的TNF-α、IL-6、IL-1β和IL-18的产生,表明抑制这些炎症因子的释放是CGA对LPS诱导的AKI的保护机制之一。
为进一步探究CGA对机体炎症反应和氧化应激抑制作用的具体机制,本试验检测了CGA对Nrf2信号通路及其下游HO-1和NQO1蛋白表达的影响。研究表明,CGA可以通过调节Nrf2/HO-1信号通路和NF-κB途径来抑制氧化应激和炎症反应,从而预防糖尿病性肾病[21]。此外,CGA可能通过增强Nrf2介导的抗氧化途径和抑制NLRP3炎性小体激活来预防四氯化碳诱导的急性肝损伤[22]。CGA通过Nrf2/HO-1通路对血管衰老发挥保护作用[23]。本试验结果显示,CGA显著提高了Nrf2的表达,诱导Nrf2的核易位增多,并增加了下游HO-1和NQO1蛋白的表达。本试验表明,CGA对LPS导致的炎症反应和氧化应激的抑制作用可能是通过调节Nrf2/HO-1途径发挥的。为进一步验证该猜想,本试验应用了Nrf2抑制剂ML385,结果表明,CGA对机体炎症反应和氧化应激的抑制作用完全被ML385逆转,表明CGA对LPS导致的炎症反应和氧化应激的抑制作用是通过激活Nrf2信号通路实现的。
综上所述,CGA通过激活Nrf2信号通路,促进Nrf2核易位及下游靶蛋白HO-1和NQO1表达,抑制机体炎症反应和氧化应激,阻断下游炎症级联瀑布反应和氧化损伤,从而对LPS诱导的AKI发挥保护作用。本试验为CGA在临床上预防和/或治疗脓毒症致AKI提供理论依据及试验基础,并完善了CGA的药理作用分子机制。

