人羊膜间充质干细胞原代培养及向心肌样细胞分化
杨 曲,张卫芳,陈 祺,胡 锋,李 娟,罗 军
目前,心肌疾病仍然是一类影响人们正常工作生活的难治性疾病,严重者甚至危及生命。虽然心脏康复治疗在延缓其疾病进程中取得了一定的进展,但是对于受损心肌的再生修复仍是亟待解决的难题[1-2]。据报道干细胞可以通过在原位或体外分化为特定的细胞类型,从而替补或修复受损组织,为修复受损心肌患者带来了新的希望[3-6]。人羊膜间充质干细胞(human amniotic mesenchymal stem cells, hAMSCs)来源于胚胎的纤维母细胞层,具有取材方便、无创、不受伦理限制、免疫排斥作用小且无成瘤性等众多优点[7-8],且比其他来源的干细胞具有更好的增殖能力、分化潜能和组织修复能力,是用于再生修复的理想干细胞来源[9-11]。hAMSCs可被诱导向韧带细胞[12]、肌腱细胞[13]、骨细胞[14]、肌细胞[15]和神经元样细胞[16]等定向分化,但关于其向心肌样细胞分化的研究鲜有报道。因此,本文着重探讨hAMSCs的原代培养及向心肌样细胞分化的能力和机制,对hAMSCs治疗心肌相关疾病具有非常重要的意义。
1 材料与方法
1.1 材料收集2021年3 ~ 5月南昌大学第二附属医院产科10例健康、无传染病的正常足月顺产或剖宫产产妇的胎盘组织,血液样本采自10名健康志愿者。人肝癌HepG2细胞,购自武汉普诺赛公司。免疫缺陷(NOD-SCID)小鼠,购自常州卡文斯公司。本实验获我院伦理委员会批准,患者均知情同意。
1.2 原代hAMSCs的分离培养与鉴定从胎盘上剥离羊膜,用D-Hank缓冲液充分冲洗。将羊膜滤除缓冲液后剪碎加入至0.05%胰酶中消化,37 ℃恒温水浴1 h,每隔10 min使用振荡器振荡10 s。胰酶消化后收集羊膜,冲洗后转移至1 g/L Ⅳ型胶原酶(Sigma公司)溶液中继续消化,37 ℃恒温水浴40 min,每隔10 min振荡10 s,直至羊膜消化成胶状物。消化完成后收集滤液至离心管,1 000 r/min离心5 min得到沉淀物;去上清液,沉淀物用含10% FBS和1%双抗的DMEM/F12(Gibico公司)培养液重悬后接种于25 cm2培养瓶中,置于5% CO2、37 ℃培养箱中培养,3天换1次液,待细胞密度至80%~90%,用0.25%胰酶消化传代。整个提取过程保持无菌,第3代生长状态良好的hAMSCs用于后续实验。用流式细胞术检测细胞表面抗原CD44、CD90、CD45、HLA-DR的表达。
1.3 hAMSCs的多向分化潜能测定(1)成骨分化:当细胞密度达50%~60%时,按间充质干细胞成骨诱导试剂盒对hAMSCs进行成骨诱导,培养21天使用茜素红染色评估成骨潜能。(2)成脂分化:当细胞密度达100%或过度融合时,按间充质干细胞成脂诱导试剂盒进行成脂诱导,培养28天使用油红O染色观察细胞内脂滴生成情况,以评估成脂潜能。
1.4 hAMSCs致瘤性检测体内实验采用免疫缺陷小鼠体内接种法:消化收集第3代的hAMSCs并进行计数,PBS重悬备用,调整细胞浓度为每毫升1×107个细胞,取100 μL细胞悬液与基质胶按1 ∶1混匀,分别注入6周NOD-SCID小鼠的背部皮下及大腿内侧肌肉,记为hAMSCs组。相同方法植入人肝癌HepG2细胞,记为HepG2组。饲养1个月后,观察两组小鼠植入部位有无肿瘤形成。体外实验采用软琼脂克隆法:取1×103个hAMSCs和HepG2细胞分别接种于6孔板软琼脂内,培养10天后观察细胞集落形成情况。
1.5 诱导hAMSCs向心肌样细胞分化及形态学变化取第3代hAMSCs以每毫升2×104个细胞浓度接种于6孔培养板中,分为对照组及实验组。对照组用普通DMEM/F12完全培养液培养,实验组在接种24 h后更换为心肌诱导分化培养液(含10 μmol/L 5-aza、5 μmol/L TGF-β1及5 μmol/L Ang-Ⅱ的DMEM/F12完全培养液)诱导24 h,再换液以普通DMEM/F12完全培养液继续培养。在不同时间点观察实验组和对照组细胞形态学的变化。
1.6 qRT-PCR检测通过RNA提取试剂盒(Servicebio公司)提取实验组和对照组细胞总RNA;取10 μL RNA进行反转录反应,反应完毕后取2.0 μL cDNA,采用Bio-rad荧光定量探测仪进行基因表达定量分析,引物序列见表1,以GAPDH为内参。进行3次独立实验,结果数据以2-ΔΔCT法分析。
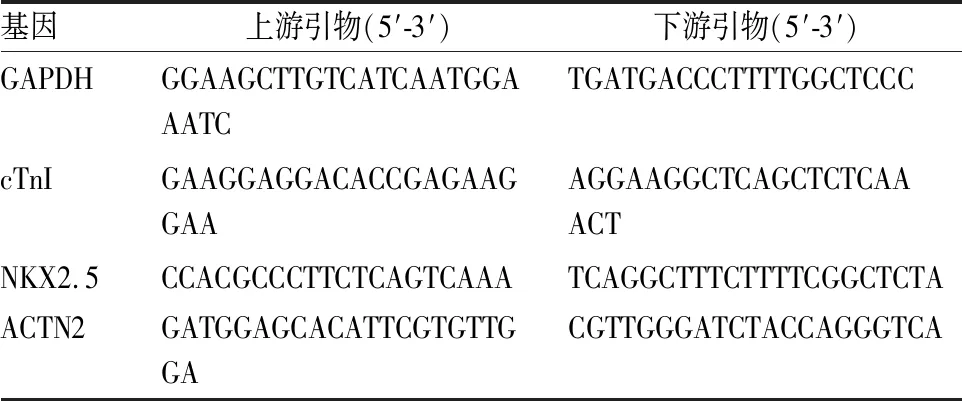
表1 qRT-PCR实验中各基因的引物序列
1.7 Western blot检测收集实验组和对照组培养4周后的细胞,加入含蛋白酶抑制剂的RIPA裂解液提取总蛋白,通过BCA法进行蛋白定量,上样,进行SDS-PAGE法电泳,产物转至PVDF膜上,5%脱脂牛奶室温封闭2 h,一抗抗人NKX2.5兔多克隆抗体(1 ∶1 000,Proteintech公司)在4 ℃孵育过夜,PBST冲洗。二抗山羊抗兔(1 ∶5 000,Proteintech公司)室温孵育2 h,通过ECL法进行曝光、显影。条带结果通过Image J软件进行半定量分析。
1.8 细胞免疫荧光检测采用细胞免疫荧光染色法检测hAMSCs中cTnI和ACTN2的蛋白表达:取实验组和对照组培养4周后的hAMSCs,PBS冲洗,经4%多聚甲醛固定15 min;0.5% Triton X-100室温通透20 min;滴加10%山羊血清室温封闭30 min;滴加兔单克隆cTnI抗体(1 ∶200,Abcam公司)或鼠单克隆ACTN2抗体(1 ∶200,Abcam公司)放入湿盒,4 ℃孵育过夜;TBST冲洗,分别滴加相应的荧光二抗,在湿盒中室温避光孵育1 h;滴加DAPI避光复染核5 min;荧光显微镜下观察并采集图像。
1.9 CCK-8法检测细胞活性将实验组和对照组hAMSCs以5×103个细胞/孔接种于96孔板中,置于37 ℃、5%CO2培养箱中培养12、24及48 h。加入CCK-8试剂(Solarbio公司),孵育2 h,用酶标仪在450波长处检测吸光度值(OD值)。实验重复3次,每次设置3个以上复孔。
1.10 淋巴细胞增殖实验取健康人外周血,用Percoll淋巴细胞分离液分离出淋巴细胞,用RPMI 1640培养基(Solarbio公司)重悬备用。取第3代实验组和对照组hAMSCs,消化收集后用RPMI 1640培养基重悬,用丝裂霉素C(25 g/L)预处理3 h,加入外周血淋巴细胞悬液于96孔板中共培养,调整hAMSCs细胞终浓度为每毫升5×104个细胞,淋巴细胞终浓度为每毫升5×105个细胞,分别作为淋巴细胞+hAMSCs(对照组)共培养组和淋巴细胞+hAMSCs(实验组)共培养组。将单独淋巴细胞培养作为阴性对照组。用5 g/L植物血凝素(PHA)处理的淋巴细胞作为阳性对照。培养48 h后加入CCK-8试剂,孵育4 h用酶标仪检测吸光度值。实验重复3次,每次设置3个以上复孔。

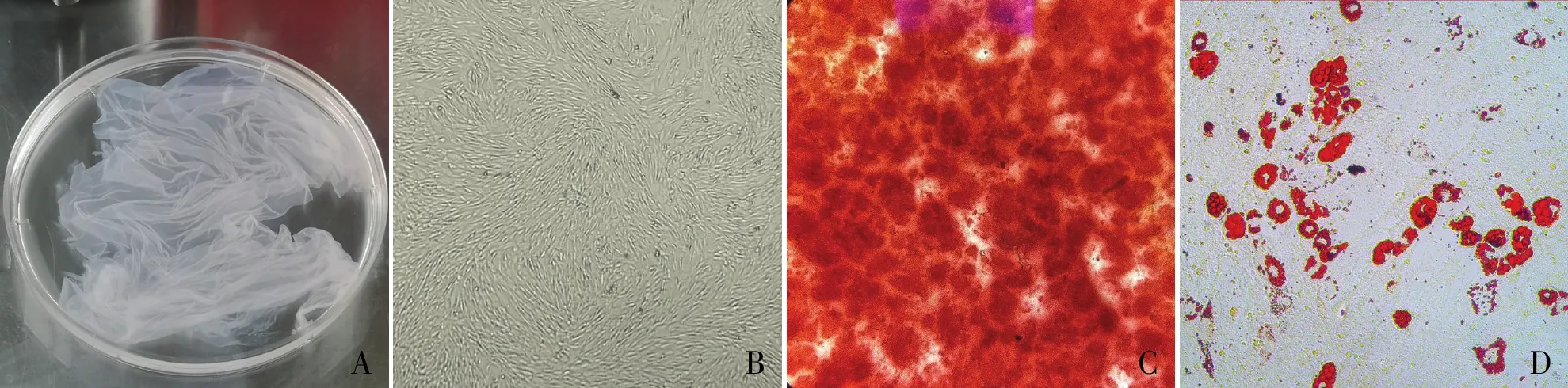
图1 A.分离后的羊膜;B.第3代hAMSCs形态;C.茜素红染色;D.油红O染色
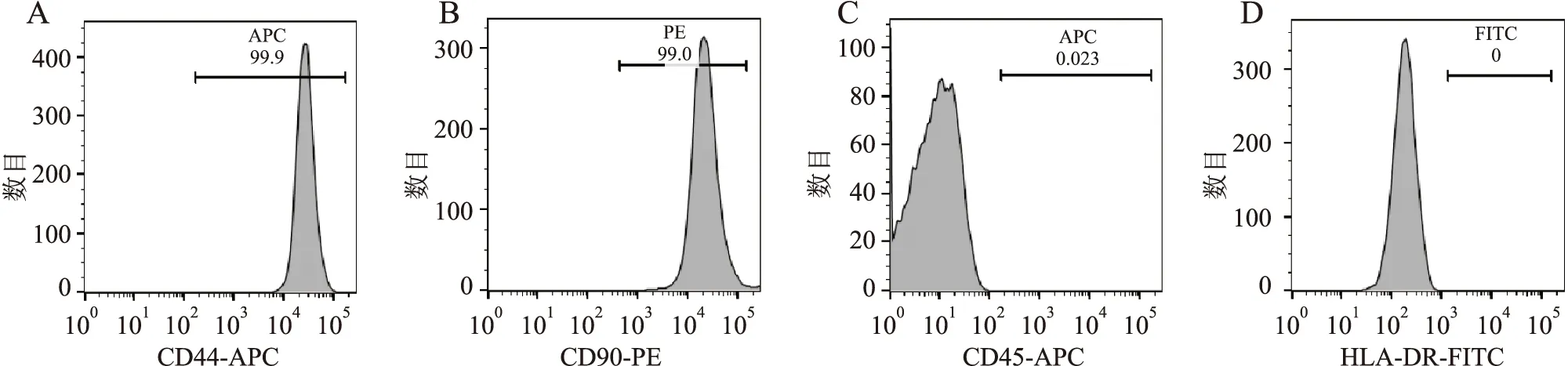
图2 流式细胞术检测hAMSCs特异性表面抗原:A.CD44-APC;B.CD90-PE;C.CD45-APC;D.HLA-DR-FITC
2 结果
2.1 原代hAMSCs的分离培养及鉴定用D-Hank液反复清洗去除人羊膜组织上的血液及绒毛膜后,可见羊膜呈透明状薄膜(图1A)。原代hAMSCs细胞形态多样,呈梭形、三角形、菱形及不规则形,可能是由于原代细胞中同时含有羊膜间充质细胞和羊膜上皮细胞。培养至第3代,细胞体积拉伸变大,形态趋于一致的长梭形,随着细胞的增殖,呈现出干细胞典型的漩涡状排列(图1B)。经成骨、成脂诱导培养后,通过茜素红染色可见大量钙结节形成(图1C),油红O染色可见大量脂滴形成(图1D)。流式细胞术检测结果显示:hAMSCs高表达间充质干细胞标志基因CD44、CD90,低表达造血干细胞标志基因CD45,不表达主要组织相容性Ⅱ类抗原HLA-DR(图2)。
2.2 hAMSCs的致瘤性检测为了检测hAMSCs的植入安全性,体内实验用NOD-SCID小鼠细胞种植法,结果显示:分别植入hAMSCs和HepG2细胞,饲养小鼠1个月,HepG2组小鼠在植入区可见明显肿瘤形成,而hAMSCs组未见。体外实验采用软琼脂克隆法,结果显示:细胞培养10天后,HepG2组6孔板软琼脂内可见明显集落形成;而hAMSCs组内未见细胞集落形成,与体内实验结果一致(图3)。
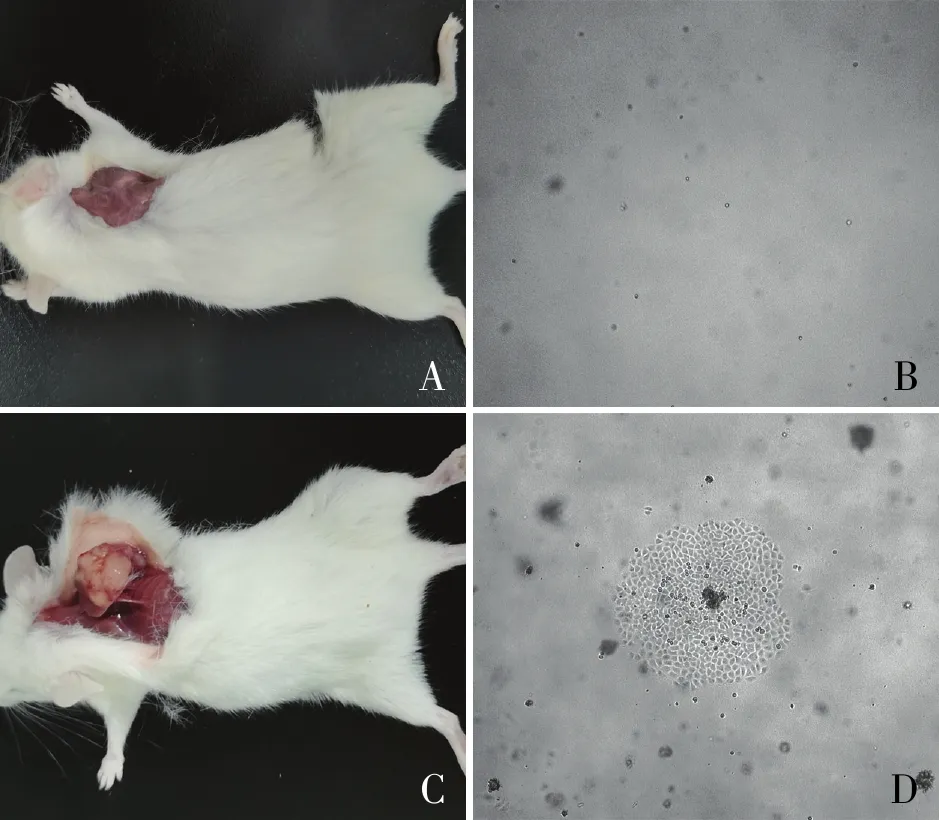
图3 hAMSCs体内外致瘤性检测:A.植入hAMSCs的NOD-SCID小鼠;B.种植hAMSCs的软琼脂;C.植入HepG2细胞的NOD-SCID小鼠;D.种植HepG2细胞的软琼脂
2.3 诱导hAMSCs向心肌样细胞分化的形态hAMSCs诱导前为短梭形,胞体较小,呈漩涡样生长;诱导培养4周后细胞呈紧密平行排列生长,成纤维样细胞比例下降,多数细胞增大,呈棒状、长梭形,细胞间见细丝样连接结构。
2.4 hAMSCs诱导后心肌标志基因和蛋白的表达本实验进一步检测hAMSCs经向心肌样细胞诱导分化后心肌标志基因(cTnI、ACTN2及NKX2.5)的表达。qRT-PCR结果显示:与对照组相比,实验组cTnI、ACTN2及NKX2.5的mRNA表达水平均显著上调,尤其NKX2.5表达上调达6倍以上(图4A)。Western blot结果表明:与对照组相比,NKX2.5蛋白在实验组的表达量明显升高(图4B、C)。细胞免疫荧光结果发现:与对照组相比,实验组在荧光显微镜下可见明显的呈红色荧光的cTnI及绿色荧光ACTN2蛋白表达,而对照组未见明显表达(图5、6)。
2.5 hAMSCs诱导后的细胞活性及免疫原性本组采用CCK-8实验检测对照组和实验组中hAMSCs培养12、24及48 h的细胞活性,结果显示:实验组和对照组差异无统计学意义,表明诱导心肌分化后的hAMSCs仍保持良好的细胞活性(图7A)。淋巴细胞增殖实验显示:与单纯人外周血淋巴细胞组(阴性对照)相比,PHA可显著刺激淋巴细胞增殖,未诱导(对照组)和诱导向心肌分化(实验组)的hAMSCs分别与淋巴细胞共培养后,对淋巴细胞均无明显促进增殖作用,表明有、无诱导的hAMSCs均具有低免疫原性(图7B)。
3 讨论
间充质干细胞又称多能间充质基质细胞,是一种自我更新的细胞,广泛存在于人体的器官和组织中,可以从脂肪组织、脐带血、致密骨和其他组织中分离,被运用于各种实验研究[17-18]。由于受多种原因的限制,间充质干细胞的治疗应用一直受到阻碍。首先,成人来源的间充质干细胞通常需要有创的侵入性操作来获取,不仅导致患者痛苦,而且有可能使供体部位受到感染[19];其次,间充质干细胞的自我更新和分化潜能受到供体年龄、遗传和微环境的严重影响[20-21];再次,成体间充质干细胞的增殖能力和分化能力有限,在体外传代培养后,其能力也进一步降低[22]。因此,有必要寻找一种新的干细胞来源用于再生医学的研究。有文献报道,hAMSCs比其他来源的干细胞具有更活跃的增殖能力、细胞状态更为原始、分化潜能更高[9];具有令人满意的低免疫原性、抗炎功能和组织修复能力[10]。其来源于废弃胎盘上的羊膜,具有来源广泛、对供者无不利影响、无伦理道德的限制等多种优点[11]。所以,hAMSCs是更为理想的干细胞来源,被认为是再生医学领域中最有前途的干细胞[9]。
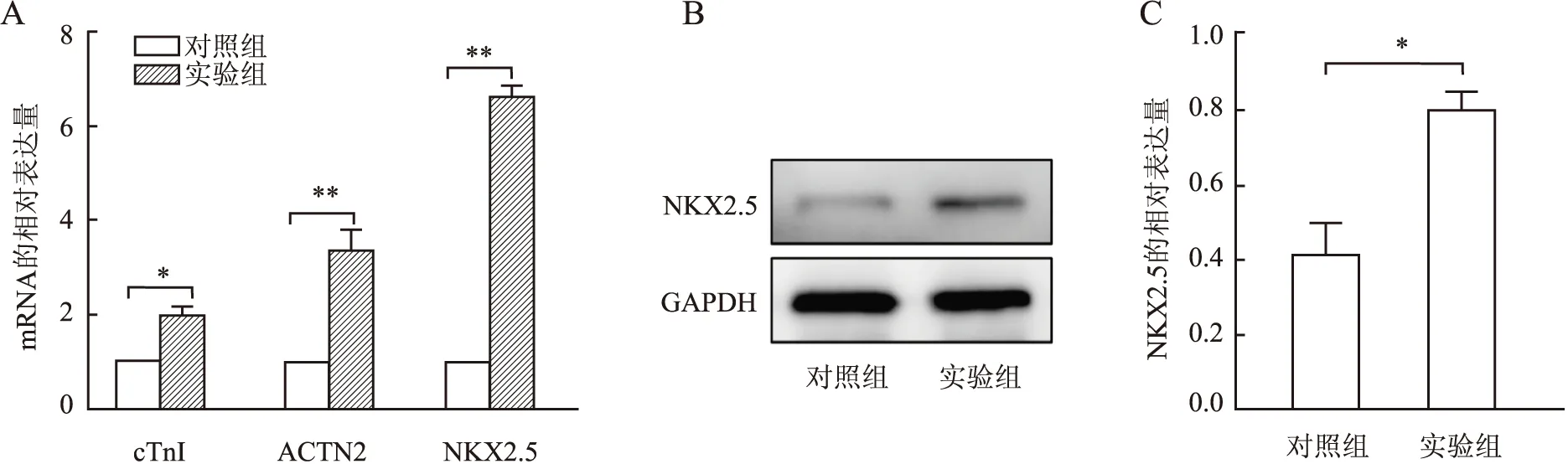
图4 A.qRT-PCR检测cTnI、ACTN2及NKX2.5的mRNA表达:*P<0.001、**P<0.000 1 ;B.Western blot检测NKX2.5蛋白的表达;C.定量分析NKX2.5的表达:*P<0.001

图5 实验组与对照组hAMSCs免疫荧光染色,红色为cTnI蛋白,蓝色为DAPI核

图6 实验组与对照组hAMSCs免疫荧光染色,绿色为ACTN2蛋白,蓝色为DAPI核
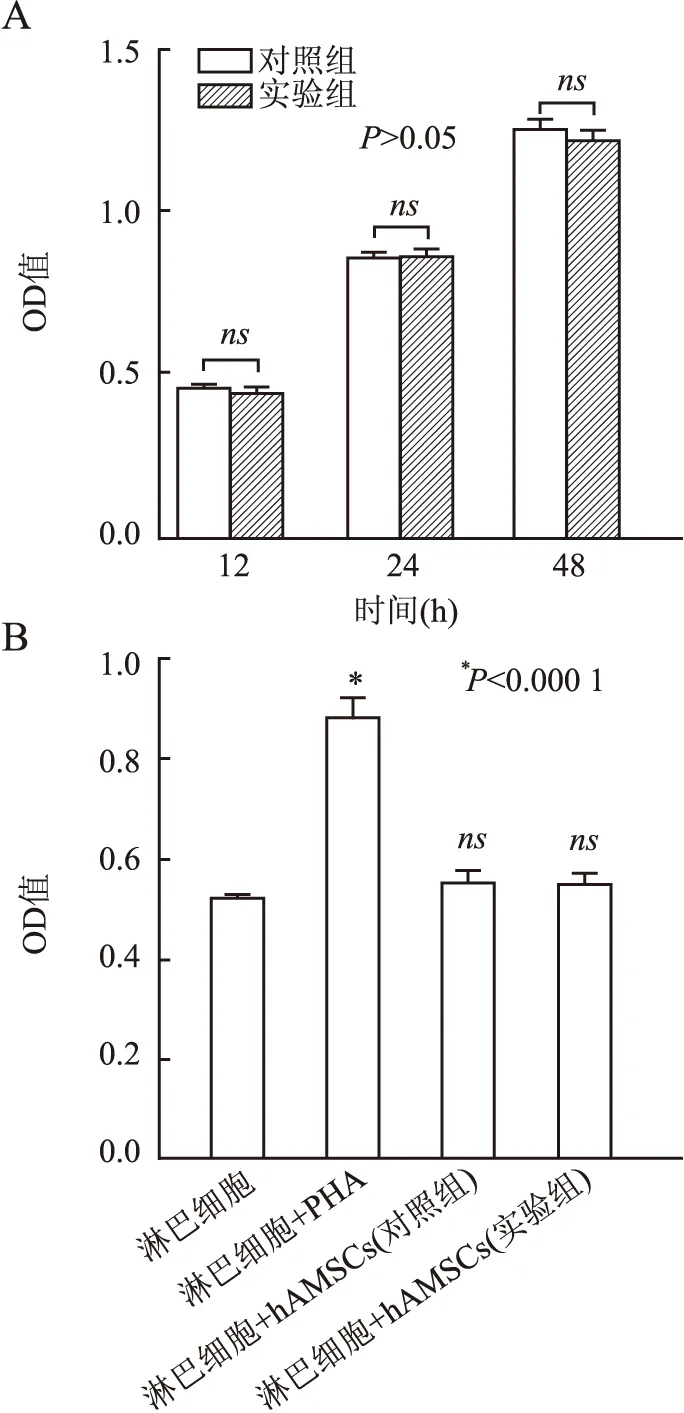
图7 A.CCK-8实验检测对照组和实验组hAMSCs的细胞活性;B.淋巴细胞增殖实验检测单纯淋巴细胞组(阴性对照组)、淋巴细胞+PHA(阳性对照组)、淋巴细胞+hAMSCs(对照组)共培养组及淋巴细胞+hAMSCs(实验组)共培养组的免疫原性:ns表示无相关性
心肌疾病是一类心肌器质性疾病,包括缺血性心肌病、糖尿病心肌病或病毒性心肌炎等,均可导致心肌细胞死亡,进而损害正常的心肌功能,导致患者最终因心力衰竭而死亡[23-24]。尽管目前可以通过外源性的治疗手段干预,但仅仅延缓了疾病进展而无法修复和再生受损的心肌。利用干细胞的增殖、分化潜能,通过细胞移植手段再生和修复受损心肌组织、恢复心脏功能,是针对心肌病变本身治疗心肌疾病最有希望的方法[25-26]。目前,由于各种技术手段及体内复杂微环境的限制,干细胞移植治疗并未达到预期的效果。其中主要的原因是移植入体内的干细胞向心肌细胞分化的同时存在基因突变的可能,无法保证足够的安全性和有效性。因此,通过在体外诱导干细胞向心肌样细胞定向分化,形成心肌样前体细胞,再移植入体内是更为安全有效的策略[27-29]。
本课题组通过机械-酶消化法成功提取了hAMSCs。由于原代hAMSCs中可能混有羊膜上皮细胞,细胞呈多形性,生长不一。经过多次传代纯化后,第3代细胞形态均一,呈长梭形,漩涡式生长,增殖能力强。通过流式细胞术对第3代hAMSCs进行干细胞表面特异性标记的鉴定,还进一步通过体外成骨、成脂分化实验证明提取的hAMSCs具有高度的多向分化潜能。此外,通过体内外致瘤性检测实验及淋巴细胞增殖实验表明hAMSCs兼具无致瘤性与低免疫原性的特点,可作为临床应用的细胞移植来源。
为了达到再生修复心肌组织的目的,本组进一步研究了hAMSCs向心肌样细胞分化的潜能。结果显示,在体外通过心肌诱导分化培养液诱导培养hAMSCs,4周后可见细胞排列紧密有序,大多数细胞逐渐增大并形成棒状,其胞间可见细丝样的肌丝连接结构。qRT-PCR结果显示心肌特异性基因cTnI、ACTN2、NKX2.5的表达在诱导后明显升高,细胞免疫荧光与Western blot实验验证了这些基因的转录后蛋白的表达水平也升高,表明诱导hAMSCs向心肌样细胞分化成功,这为定向再生修复受损心肌提供了理论支持。其中,NKX2.5基因及其蛋白产物在对照组和实验组中的表达差异更具有显著性,与其他干细胞诱导向心肌分化的报道相似[30-31],提示hAMSCs通过高表达NKX2.5基因是其向心肌样细胞分化的可能机制,但需进一步验证。此外,通过CCK-8实验和淋巴细胞增殖实验表明诱导向心肌分化的hAMSCs具有良好的细胞活性及低免疫原性,这为hAMSCs应用于临床提供了安全性和有效性的保障。
本组成功从人羊膜中提取出hAMSCs,并创新性的诱导其向心肌样细胞定向分化,提高细胞移植治疗心肌损伤的安全性和有效性,为临床治疗心肌疾病提供了新的再生修复策略。

