术前纤维蛋白原和全身炎症反应指数与可切除肝细胞癌的临床病理特征及预后的关系
胡潘宜,钱叶本
肝细胞癌是临床常见恶性肿瘤,约占肝脏原发肿瘤的80%[1]。2018年GLOBOCAN 数据[2]显示肝癌是癌症相关死亡的第三大原因,中国每年新发肝癌病例约占全球的一半。肝切除术是肝细胞癌患者的最主要治疗手段,但术后5年复发率高达70%、总生存率低于50%[3]。目前,仍缺乏可靠的预后指标指导临床治疗。文献报道,肿瘤相关性炎症与癌症之间有密切联系[4-9]。近年,一种根据术前纤维蛋白原(fibrinogen, FIB)和全身炎症反应指数(systemic inflammatoryresponse index, SIRI)(简称F-SIRI)的术前评分被发现,其与胃癌患者术后的不良预后相关[10]。本文旨在探讨术前F-SIRI评分对肝细胞癌患者肝切除术后预后的预测潜力,为临床治疗提供参考。
1 材料与方法
1.1 材料收集2015年1月~2018年12月我院临床病理中心确诊的298例原发性肝细胞癌标本,其中男性231例,女性67例,患者年龄28~81岁。本实验获得我院伦理委员会批准,患者均知情同意。
1.2 方法标本均经10%中性福尔马林固定,第二天取材,常规脱水,包埋,切片,HE染色,镜下观察。所有切片均经两位高年资病理医师采用双盲法阅片。
1.3 术前F-SIRI评分标准SIRI=中性粒细胞计数×单核细胞计数/淋巴细胞计数。血浆FIB正常范围为2.0~4.0 g/L,高于4.0 g/L为高FIB血症,术前FIB临界值为4.0 g/L。采用最大确定秩统计量法确定SIRI的临界值为0.9,>0.9为SIRI高表达。评分标准:FIB≤4.0 g/L为0分,>4.0 g/L为1分;SIRI≤0.9为0分,>0.9为1分;FIB、SIRI评分之和为术前F-SIRI评分。
1.4 随访采用门诊、电话等对患者进行随访,术后2年内每3个月随访1次,之后每6个月随访1次,截止时间为2020年12月或患者死亡,中位随访时间为35个月。
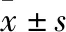
2 结果
2.1 临床特征本组298例肝细胞癌中伴HBsAg阳性256例,不伴HBsAg阳性42例。169例AFP≤400 μg/L,129例AFP>400 μg/L。术前F-SIRI 评分0、1、2分患者SIRI分别为0.72±0.25、1.32±0.34、1.69±0.58(F=12.871,P<0.001); FIB分别为3.11±0.42、4.08±0.86、4.59±0.92(F=14.121,P<0.001,表1)。
2.2 病理特征眼观:298例肝细胞癌患者均接受肝切除术,单个瘤体者278例,2个及以上瘤体者20例。肿瘤直径1.8~18 cm,多个瘤体者取直径总和,>5 cm者173例,≤5 cm者125例。镜检:肝细胞癌分化程度差异大,分化较高者癌细胞类似于肝细胞,癌细胞呈不规则梁索状或巢状排列(图1),以粗梁型及腺泡型为主,部分细胞胞质透亮(图2),血管多,间质少。分化较低者异型性明显。癌细胞大小不一,形态各异,可见巨核瘤细胞和多核瘤细胞(图3)。肝细胞癌组织学类型丰富,可见小梁型、巨细胞型、假腺样型、透明细胞型(图4)、富含脂质型(图5)等。镜下于内皮细胞衬覆的血管腔内见癌细胞巢团符合微血管浸润者80例,不伴微血管浸润者218例(图6)。
2.3 术前F-SIRI评分与肝细胞癌临床病理特征的关系298例患者中151例术前F-SIRI评分为0分,84例为1分,63例为2分。结果显示,术前F-SIRI评分与患者肿瘤直径、SIRI及FIB具有相关性(P<0.05,表1)。
2.4 术前F-SIRI评分与预后的关系术前F-SIRI不同评分患者的无瘤生存期(disease free survival, DFS)、总生存期(overall survival, OS)差异有统计学意义(χ2=30.722、34.034,P均<0.001)。术前F-SIRI评分 0、1、2分患者的1年DFS率分别为80.8%、66.3%、38.5%;3年DFS率分别为57.9%、49.6%、21.2%;1年OS率分别为92.8%、84.8%、56.4%;3年OS率分别为76.2%、64.4%、29.8%。术前F-SIRI评分较高患者1、3年DFS率和OS率较低(图7)。此外,肿瘤直径、微血管浸润、白蛋白水平、AFP、分化程度、肿瘤位置、肿瘤数目、BCLC分期是DFS的单变量分析的预后因素(P<0.05);肿瘤直径、微血管浸润、白蛋白水平、AFP、分化程度、肿瘤位置、肿瘤数目、BCLC分期是OS的单变量分析的预后因素(P<0.05)。Cox回归分析显示,术前F-SIRI评分(P=0.008)、白蛋白水平(P=0.025)、BCLC分期(P<0.001)和微血管浸润(P<0.001)是影响肝细胞癌患者DFS的独立预测因素(表2)。术前F-SIRI评分(P=0.001)、肿瘤位置(P=0.024)、微血管浸润(P=0.043)和BCLC分期(P=0.001)是影响OS的独立预测因素(表3)。
2.5 术前F-SIRI评分体系对不同亚组肝细胞癌患者的预后价值本组结果显示:术前F-SIRI评分是肝细胞癌患者的独立危险因素,与DFS、OS显著相关。本组进一步分析术前F-SIRI评分在不同亚组肝细胞癌患者中的预后能力,在AFP ≤400 ng/mL、微血管浸润阴性或BCLC(0~A)期等不同亚组的患者中,术前F-SIRI评分较高的患者,其DFS和OS较差,提示术前F-SIRI评分具有重要的预后价值(图8)。
2.6 术前F-SIRI评分和BCLC分期的ROC曲线BCLC分期在ROC曲线下面积为0.669(95%CI=0.604~0.733,P<0.001);术前F-SIRI评分在ROC曲线下的面积为0.616(95%CI=0.546~0.685,P=0.001);ROC曲线下FIB水平的大小为0.611(95%CI=0.540~0.682,P=0.002,图9)。
3 讨论
原发性肝癌包括肝细胞癌(75%~85%)、肝内胆管癌(10%~15%)以及其他罕见类型,由于肝细胞癌起病隐匿,发现时多为晚期,预后差。因此,寻找新的生物学标志物来识别和分层复发风险高的患者,可改善临床治疗。
炎症被认为是癌症的第七个标志,越来越多的证据表明[4,11-13],局部及全身炎症反应与恶性肿瘤的发生、发展相关。炎症反应通过中性粒细胞、淋巴细胞、单核巨噬细胞等免疫细胞释放生长因子、趋化因子和细胞因子等各种炎症介质,其在免疫编辑、加工和逃避等肿瘤免疫监视的各阶段参与抗肿瘤或促肿瘤活性的作用,影响肿瘤进展及其对治疗的反应。SIRI是近年提出的新型炎症指标,由外周血中性粒细胞、单核细胞和淋巴细胞计数而来。Sun等[14]认为SIRI是胆囊癌患者预后的独立预测因子,结合SIRI和其他临床病理因素,可获得比TNM分期系统更好的预测能力。Xu等[15]认为术前SIRI是肝细胞癌患者术后生存期的可靠预测因子。
图1 中分化肝细胞癌:癌细胞呈巢状、梁索状分布 图2 中分化肝细胞癌:粗梁型及腺泡型为主,部分细胞胞质透亮 图3 低分化肝细胞癌:癌细胞异型性明显,可见巨核瘤细胞和多核瘤细胞 图4 肝细胞癌透明细胞亚型:瘤细胞胞质内含大量糖原或脂质,呈透明状

表1 肝细胞癌临床病理特征与术前F-SIRI评分的关系[n(%)]
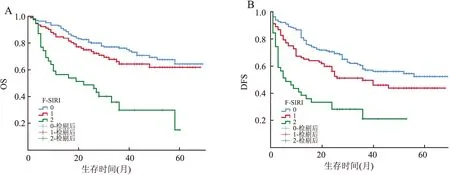
图7 A.不同术前F-SIRI评分与肝细胞癌患者OS的关系;B.不同术前F-SIRI评分与肝细胞癌患者DFS的关系
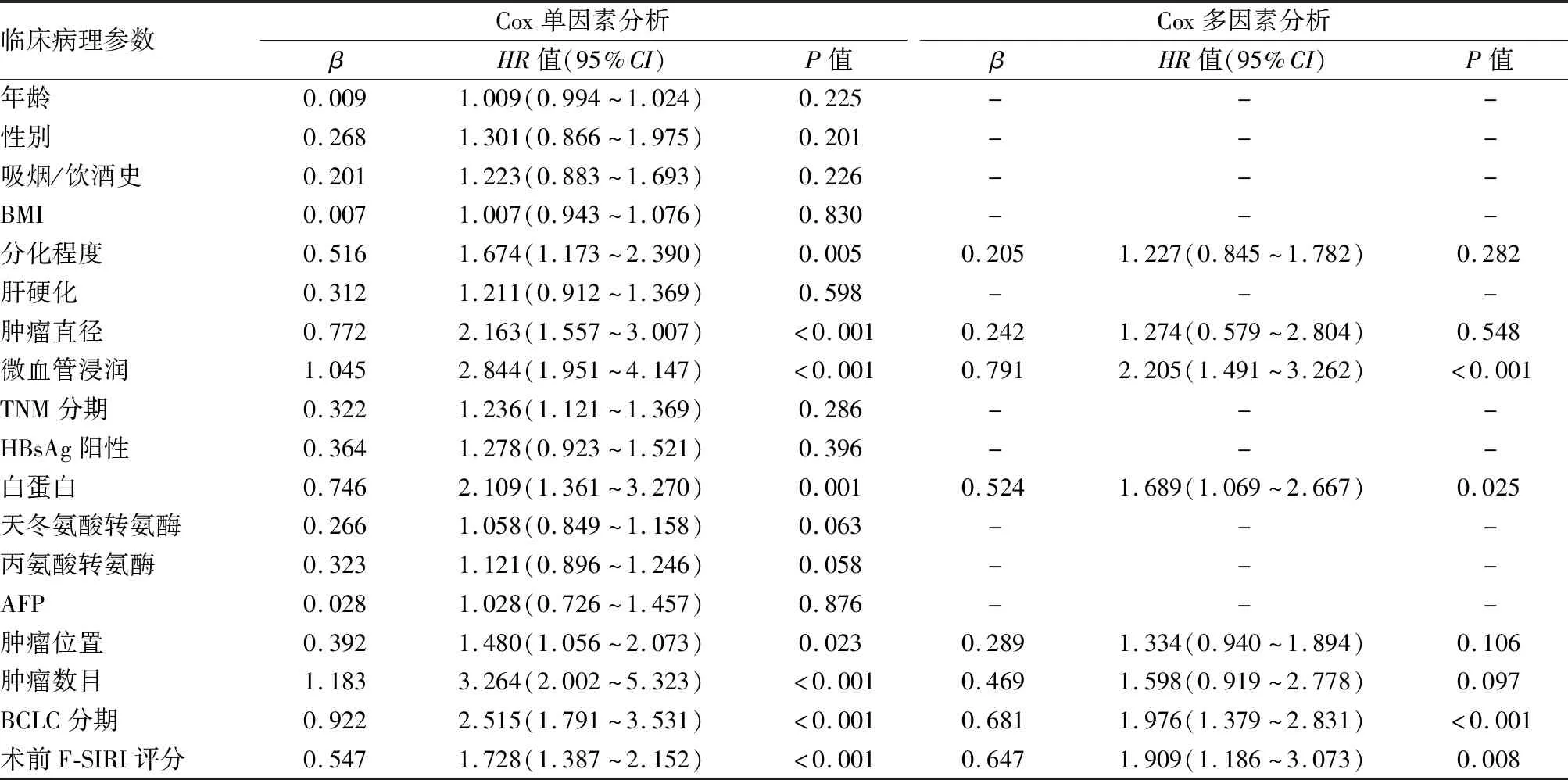
表2 肝细胞肝癌患者与DFS的关系
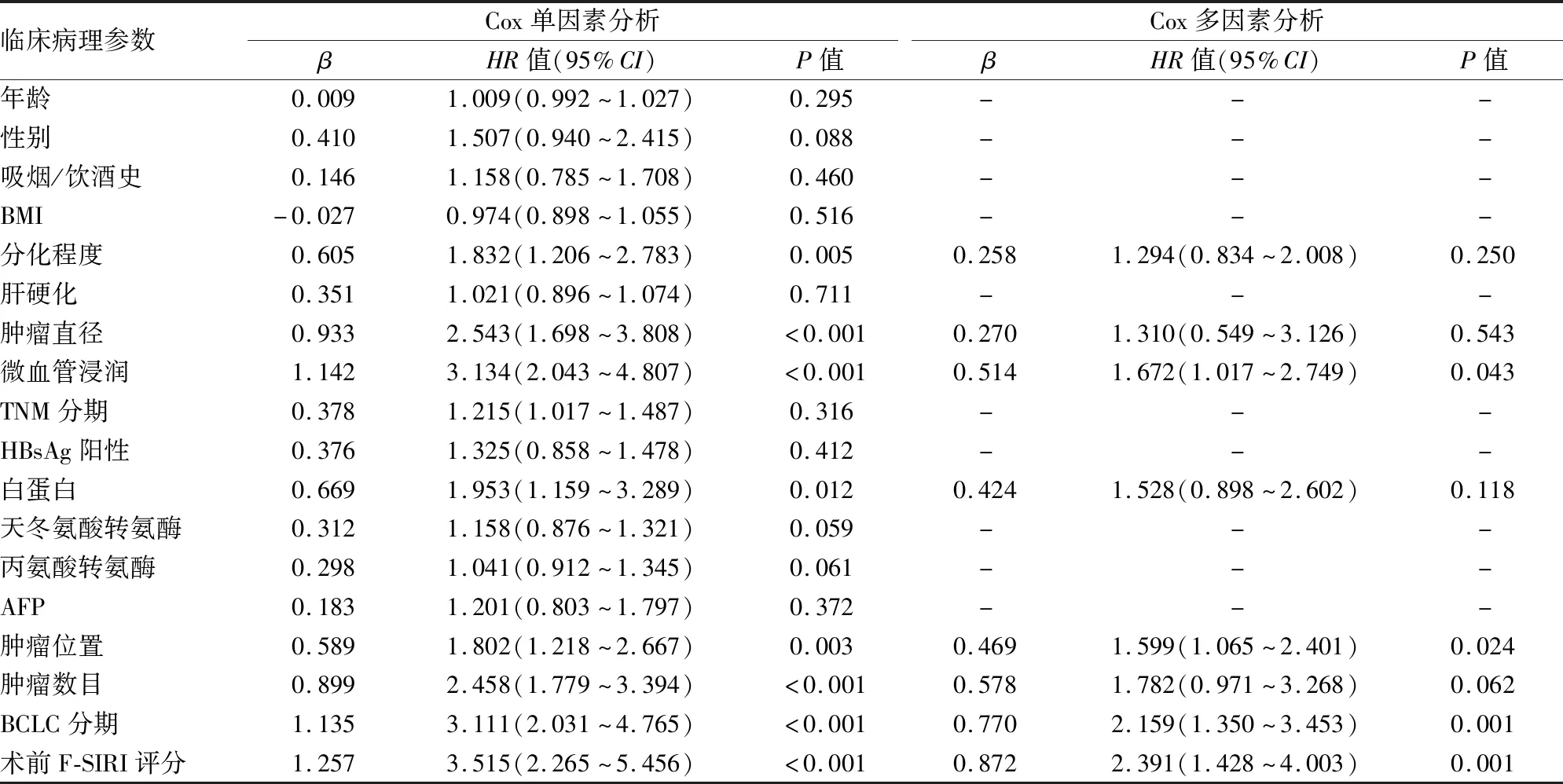
表3 肝细胞肝癌患者与OS的关系
另外,肿瘤细胞可促进凝血系统的局部激活,进而促进肿瘤进展、血管生成和血行转移[16]。FIB作为凝血系统的关键因子,在凝血过程中起重要作用。首先,除肝细胞外,它还可以由癌细胞内源性合成[17]。FIB可直接与某些生长因子结合,如TGF-β、FGF、VEGF和PDGF家族,以调节癌细胞的生长[6,17]。其次,白细胞可将FIB转化为纤维蛋白基质,将肿瘤细胞包裹起来,促进肿瘤血管生成[8-9]。增加的FIB可以通过调节vimentin和Cadherin的表达以及上皮-间质转化[7]增强细胞迁移和侵袭。另外,纤维蛋白有助于协助血小板黏附肿瘤细胞,而血小板促进更多纤维蛋白聚集在肿瘤细胞周围。其相互促进以保护肿瘤细胞免受自然杀伤细胞的毒性,甚至肿瘤细胞更喜欢黏附FIB而不是血小板[18]。研究发现[19],FIB增高与胃癌患者不良预后相关。Yu等[20]研究显示,高FIB血症与肿瘤进展密切关联,是癌症患者预后不良的独立危险因素。这些结果提示,FIB有望成为肿瘤预后的预测指标。
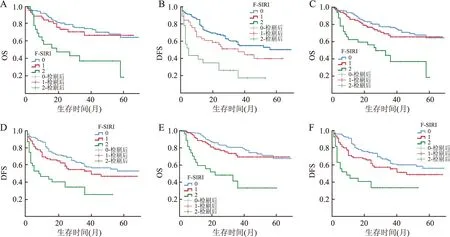
图8 各亚组术前F-SIRI不同评分与肝细胞癌患者预后的关系:A.AFP阴性患者的OS;B.AFP阴性患者的DFS;C.BCLC分期患者的OS;D.BCLC分期患者的DFS;E.微血管浸润阴性患者的OS;F.微血管浸润阴性患者的DFS
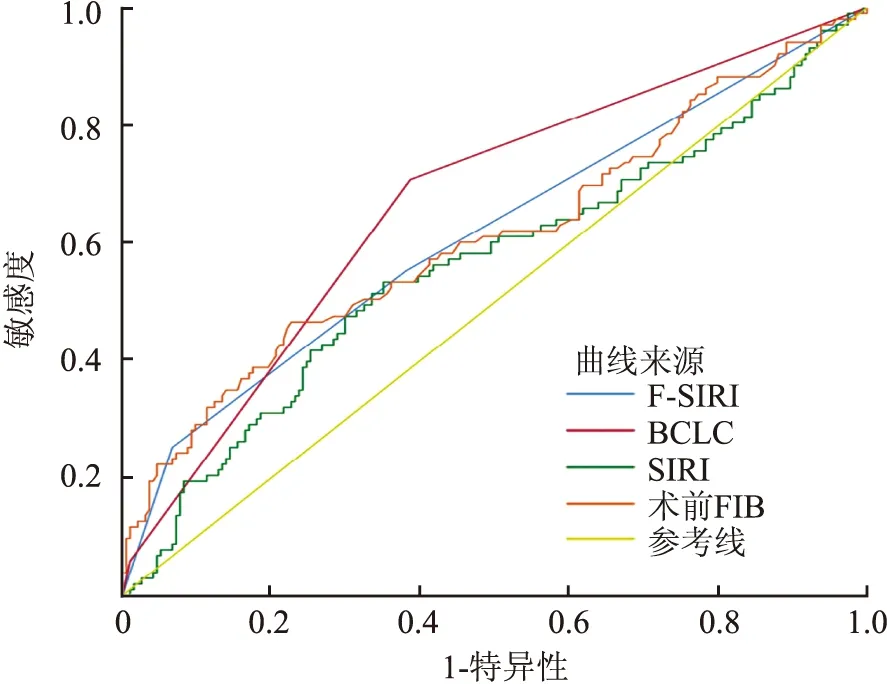
图9 术前F-SIRI评分对肝细胞癌患者术后的预测能力
本组生存分析显示,术前F-SIRI评分与肝细胞癌患者DFS及OS均具有相关性,术前F-SIRI评分较高的患者DFS、OS较差;Cox回归分析显示,术前F-SIRI评分是肝细胞癌患者DFS和OS的独立危险因素。因此,术前F-SIRI评分可用于预测肝细胞癌患者肝切除术后的预后。本组还发现术前F-SIRI评分对微血管浸润阴性患者的DFS和OS具有明显的预后价值。此外,在AFP ≤400 ng/mL和BCLC分期(0~A)期的亚组患者中,术前F-SIRI评分与肝细胞癌患者预后显著相关。这表明术前F-SIRI评分有普遍适用的预后特征。由于FIB及SIRI易从血液样本数据中获得,因此适用于在随访期间经常评估患者F-SIRI评分。F-SIRI评分有可能作为评估辅助放、化疗疗效的指标,并监测复发,但还需要进一步分析。
本实验存在局限性:(1)随访时间较短,中位随访时间35个月,尚不足以充分累积死亡例数,结果的稳定性受到影响;(2)Cox回归模型未能将所有混杂因素进行收集、控制;(3)患者接受的不同术后治疗未纳入预后因素评估。
综上所述,术前F-SIRI评分是肝细胞癌患者肝切除术后预后的独立影响因素,有望成为患者预后的预测指标。

