乳腺癌筛选差异表达的miRNAs-mRNA及其与靶基因的关系
刘海英,陈 峰,王 梅,姚 嘉
乳腺癌是威胁全球女性健康的主要恶性肿瘤,发生于乳腺上皮或导管上皮[1-2]。其病因复杂,可能与遗传和环境有关[3],约90%的患者由于肿瘤复发及体内扩散导致死亡[4]。因此,亟需寻找新的生物学标志物。微小RNAs(miRNAs)能够通过抑制信使RNA (mRNA) 翻译或促进mRNA降解,在转录后水平调节基因表达[5-6]。miRNAs参与调控细胞凋亡、增殖、迁移和侵袭等多种生物代谢过程[7]。研究证明,miRNA能够调节肿瘤的侵袭和转移[8-9],包括miR-122[10-11]、miR-767[12-13]、miR-449a[14-15]和miR-133b[16-17]等。上述miRNAs能够靶向不同的基因,调节乳腺癌的发生、转移和耐药[18]。目前,肿瘤组织中miRNAs与靶基因的作用机制是研究的热点。因此,本文着重探讨乳腺癌组织与癌旁组织中miRNA的表达,筛选显著差异表达的miRNAs-mRNA,并在细胞水平验证miRNAs与靶基因的作用关系。
1 材料与方法
1.1 材料Trizol(15596026)购自Ambion公司;DNase/RNase-Free Water(R1600)购自Solarbio公司;重组人胰岛素溶液(PB180432)购自普诺赛公司;Lipofectamine 2000(VB459270)购自上海一基公司;双荧光素酶报告基因检测试剂盒(RG027)购自上海碧云天公司。
1.2 方法
1.2.1细胞培养 乳腺癌细胞CCD-1095Sk、MCF-7、MDA-MB-231、MDA-MB-468、T-47D和ZR-75-1,购自中科院细胞库。将细胞取出置于37 ℃水浴中,待完全融化,加入4 mL完全培养基,400g离心3 min,弃上清,悬浮于1 mL培养基中,转移至培养瓶中,加入4 mL 完全培养基,置于37 ℃、5%CO2的培养箱内培养。
1.2.2差异表达miRNAs的筛选及靶基因确定 利用肿瘤基因组图谱(TCGA)获取1 034例导管和小叶肿瘤/原发性肿瘤的miRNA表达和102例正常组织的转录组,对数据进行整理分析。综合文献报道[10-17]筛选4种表达差异显著的miRNAs。通过对miRNA进行靶基因预测,结合GO和KEGG分析确定4种miRNAs所涉及的靶基因。
1.2.3qRT-PCR检测 取1×106个细胞加入1 mL Trizol中,提取总RNA。将RNA逆转录为cDNA。用cDNA进行PCR扩增,反应程序:预变性95 ℃ 3 min;95 ℃ 5 s,56 ℃ 10 s,72 ℃ 25 s,合计40个循环。采用2-ΔΔCt计算mRNA的相对含量。PCR引物由武汉天一华煜公司合成,引物序列见表1。

表1 qRT-PCR实验中各基因的引物序列
1.2.4细胞转染 根据miRNAs序列设计合成mimics、mimics-NC、inhibitor、inhibitor-NC。通过脂质转染法转染至MCF-7细胞,细胞分为对照组、mimics hsa-miR-122组、mimics hsa-miR-767组、mimics hsa-miR-449a组、mimics hsa-miR-133b组、inhibitor hsa-miR-122组、inhibitor hsa-miR-767组、inhibitor hsa-miR-449a组、inhibitor hsa-miR-133b组、mimics-NC组和inhibitor-NC组。在转染前24 h,将5×105个细胞接种于2 mL完全培养基中,种于6孔板中进行细胞转染。通过荧光拍照检测转染前、后4种miRNAs的表达,验证转染效率。
1.2.5双荧光素酶质粒构建 设计X3′-UTR荧光素酶报告基因载体,分别设计野生型及突变型。进行WT-ESR1 3′-UTR、MT-ESR1 3′-UTR、WT-EGFR 3′-UTR、MT-EGFR 3′-UTR、WT-HMGB1 3′-UTR、MT-HMGB1 3′-UTR、WT-IGF-1 3′-UTR、MT-IGF-1 3′-UTR基因的合成,进行载体与目的基因的酶切,37 ℃孵育1~2 h,酶切产物电泳检测以及回收,具体操作步骤按试剂盒说明书进行。随后,进行载体与目的基因的连接,16 ℃孵育过夜,进行转化。待平板上长出菌落,随机挑取若干个单克隆摇菌,送测序公司测序验证,选取阳性克隆。
1.2.6转染实验分组 miR-122-5p mimics/inhibitor(空载体组、ESR1 3′-UTR野生型、ESR1 3′-UTR突变型),miR-133b-5p mimics/inhibitor(空载体组、EGFR 3′-UTR野生型、EGFR 3′-UTR突变型),miR-449a-5p mimics/inhibitor(空载体组、HMGB1 3′-UTR野生型、HMGB1 3′-UTR突变型),miR-767-5p mimics/inhibitor(空载体组、IGF-1 3′-UTR野生型、IGF-1 3′-UTR突变型)。转染前24 h,在100 μL完全培养基中接种5×103个细胞,置于96孔板中,细胞融合度达90%时进行转染。培养24 h后进行后续测序。
1.2.7双荧光素酶检测 每孔细胞转移至EP管,按1 ∶100比例稀释,向海肾荧光素酶检测缓冲液加入海肾荧光素酶检测底物(100×),每个细胞样品加入100 μL萤火虫荧光素酶检测试剂。放入全功能微孔板检测仪,计算萤火虫荧光素酶活性F值。加入100 μL海肾荧光素酶检测工作液,计算海肾荧光素酶活性R值。根据检测的F值和R值,计算相对荧光素酶活性。

2 结果
2.1 差异表达miRNAs的筛选TCGA分析结果显示:172个miRNAs显著上调(log2FC≥1),差异倍数最大的前十个miRNAs分别为hsa-miR-122、hsa-miR-1269b、hsa-miR-1269a、hsa-miR-105-2、hsa-miR-767、hsa-miR-105-1、hsa-miR-449a、hsa-miR-3156-1、hsa-miR-3156-3和hsa-miR-592;76个miRNAs显著下调(log2FC≤-1),差异倍数最大的前五个分别为hsa-miR-133b、hsa-miR-133a-1、hsa-miR-133a-2、hsa-miR-1-2和hsa-miR-1-1(表2)。经查阅文献,筛选4种显著差异表达的miRNAs进行后续实验:hsa-miR-122、hsa-miR-767、hsa-miR-449a和hsa-miR-133b。
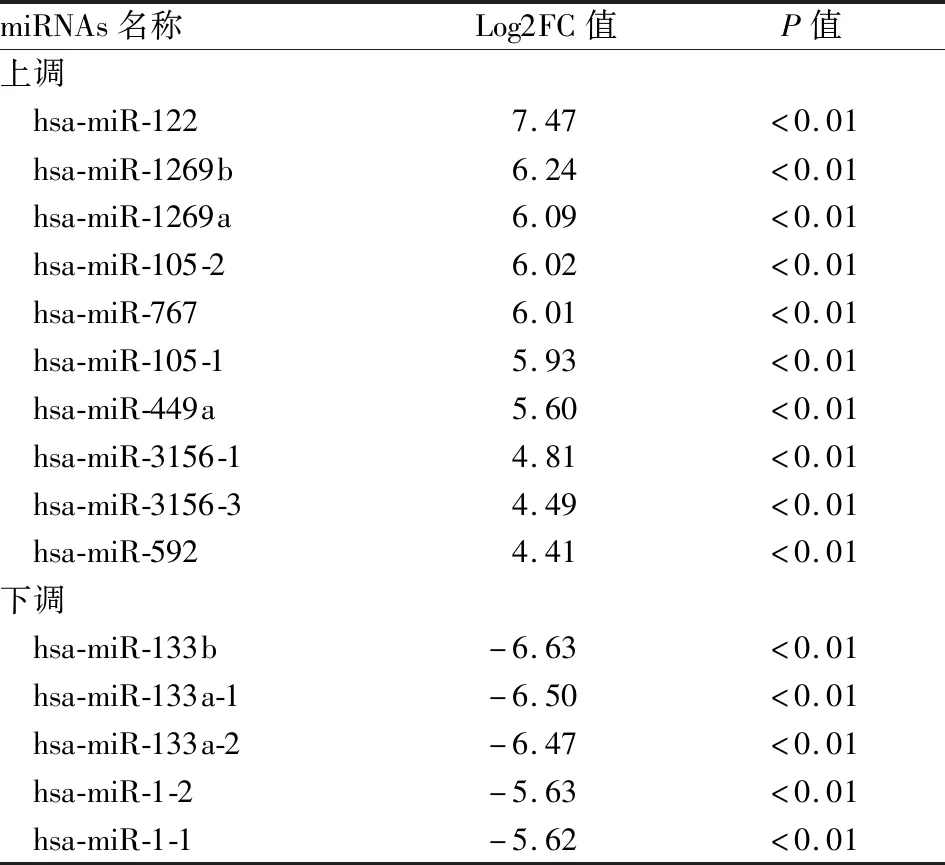
表2 差异表达的miRNAs
2.2 多细胞系验证差异miRNAs的表达hsa-miR-122在CCD-1095Sk、MCF-7、MDA-MB-231、MDA-MB-468、T-47D和ZR-75-1细胞中的表达分别为0.97±0.06、7.18±0.29、5.69±0.33、3.62±0.35、5.87±0.22、4.77±0.09(图1A)。hsa-miR-767在CCD-1095Sk、MCF-7、MDA-MB-231、MDA-MB-468、T-47D和ZR-75-1细胞中的表达分别为0.93±0.06、5.99±0.39、3.65±0.23、2.84±0.24、4.90±0.58、3.09±0.20(图1B)。hsa-miR-449a在CCD-1095Sk、MCF-7、MDA-MB-231、MDA-MB-468、T-47D和ZR-75-1细胞中的表达分别为0.96±0.04、3.88±0.28、5.37±0.21、5.53±0.26、3.52±0.09、4.16±0.40(图1C)。hsa-miR-133b在CCD-1095Sk、MCF-7、MDA-MB-231、MDA-MB-468、T-47D和ZR-75-1细胞中的表达分别为0.99±0.01、0.19±0.01、0.23±0.01、0.21±0.01、0.39±0.03、0.28±0.01(图1D)。
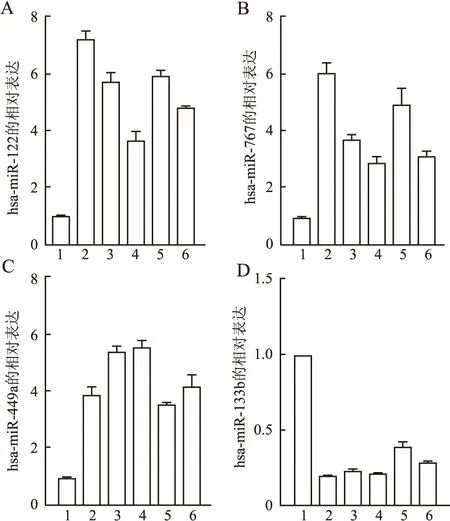
图1 多细胞系验证4种差异miRNAs的表达:A.hsa-miR-122在不同细胞中的表达;B.hsa-miR-767在不同细胞中的表达;C.hsa-miR-449a在不同细胞中的表达;D.hsa-miR-133b在不同细胞中的表达;1.CCD-1095Sk;2.MCF-7;3.MDA-MB-231;4.MDA-MB-468;5.T-47D;6.ZR-75-1
2.3 差异miRNAs的靶基因分析通过对miRNA进行靶基因预测,结合GO和KEGG分析,最终检测hsa-miR-122-5p、hsa-miR-133b-5p、hsa-miR-449a-5p和hsa-miR-767-5p的靶基因分别为ESR1、EGFR、HMGB1和IGF-1。
2.4 乳腺癌中IGF-1表达与临床病理特征的关系IGF-1的表达水平在445例<55岁患者中有199例高表达,在589例>55岁患者中有318例高表达,差异有显著性(P<0.01)。在267例T1期中有107例高表达,在764例T2~T4期中有407例高表达,差异有显著性(P<0.01,表3)。
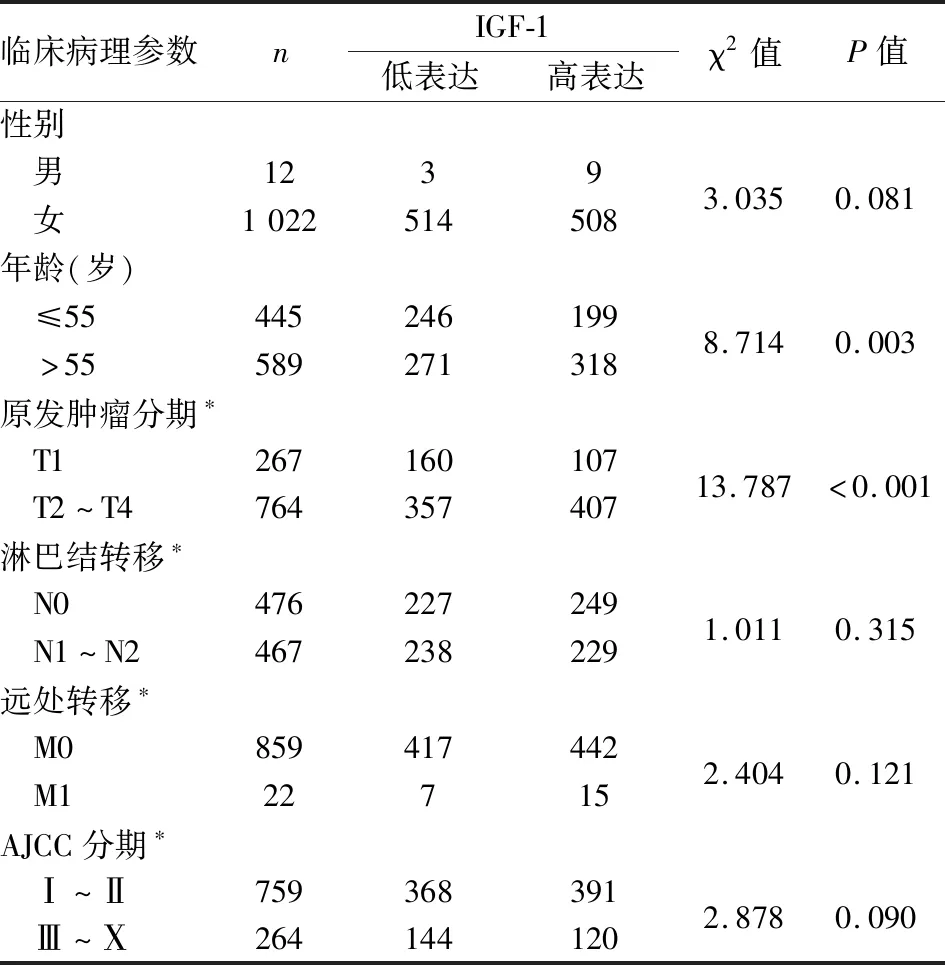
表3 乳腺癌中IGF-1表达与临床病理特征的关系
2.5 转染效率根据4种差异miRNAs的序列设计合成mimics、mimics-NC和inhibitor、inhibitor-NC。通过脂质转染法转染至MCF-7细胞,可观察到hsa-miR-122、hsa-miR-133b、hsa-miR-449a和hsa-miR-767的转染效率分别为81.77±1.32、80.58±1.59、80.69±2.15和80.91±2.32(图2),提示转染成功,标记基因表达正常。
2.6 转染差异miRNAs对细胞活力的影响与mimics-NC组(1.52±0.01)比较,mimics hsa-miR-122组(1.75±0.01)、mimics hsa-miR-767(1.87±0)组和mimics hsa-miR-449a(1.71±0.01)组的吸光度显著升高(P<0.01),mimics hsa-miR-133b组(1.21±0.01)的吸光度显著降低(P<0.01);与inhibitor-NC组(1.53±0.01)比较,inhibitor hsa-miR-122组(1.24±0.02)、inhibitor hsa-miR-767组(1.11±0.02)和inhibitor hsa-miR-449a组(1.27±0.02)的吸光度显著降低(P<0.01),inhibitor hsa-miR-133b组(1.82±0.01)的吸光度显著升高(P<0.01,图3)。

图2 转染效率:A. hsa-miR-122转染至MCF-7细胞的绿色荧光表达;B.hsa-miR-133b转染至MCF-7细胞的绿色荧光表达;C.hsa-miR-449a转染至MCF-7细胞的绿色荧光表达;D.hsa-miR-767转染至MCF-7细胞的绿色荧光表达
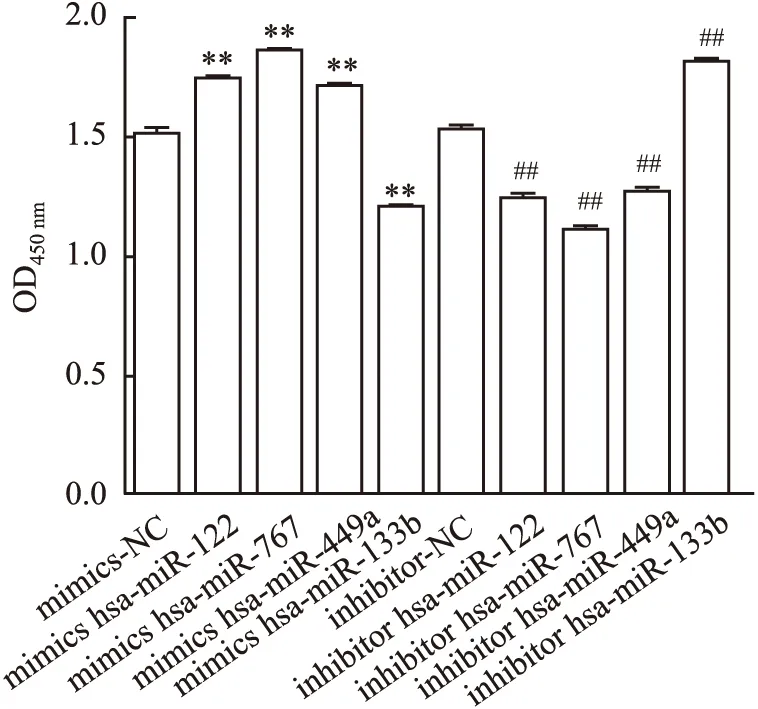
图3 转染差异miRNAs对细胞活力的影响:与mimics-NC组比较,**P<0.01;与inhibitor-NC组比较,##P<0.01
2.7 荧光素酶检测验证靶基因与mimics-NC组(1.23±0.04)相比,转染miR-122-5p(0.80±0.03)组ESR1 3′-UTR野生型MCF-7细胞的相对荧光活性比值显著降低(P<0.000 1)。与mimics-NC组(1.73±0.03)相比,转染miR-133b-5p组(0.96±0.03)EGFR 3′-UTR野生型MCF-7细胞的相对荧光活性比值显著降低(P<0.000 1)。与mimics-NC组(1.35±0.07)相比,转染miR-499a-5p组(0.77±0.03)HMGB1 3′-UTR野生型MCF-7细胞的相对荧光活性比值显著降低(P<0.000 1)。与mimics-NC组(1.66±0.06)相比,转染miR-767-5p组(0.62±0.03)IGF-1 3′-UTR野生型MCF-7细胞的相对荧光活性比值显著降低(P<0.000 1,图4)。上述结果显示miR-122-5p、miR-133b-5p、miR-499a-5p和miR-767-5p分别与ESR1 3′-UTR、EGFR 3′-UTR、HMGB1 3′-UTR和IGF-1 3′-UTR序列靶向结合,并抑制基因的表达,其靶向结合位点与预测位点一致。
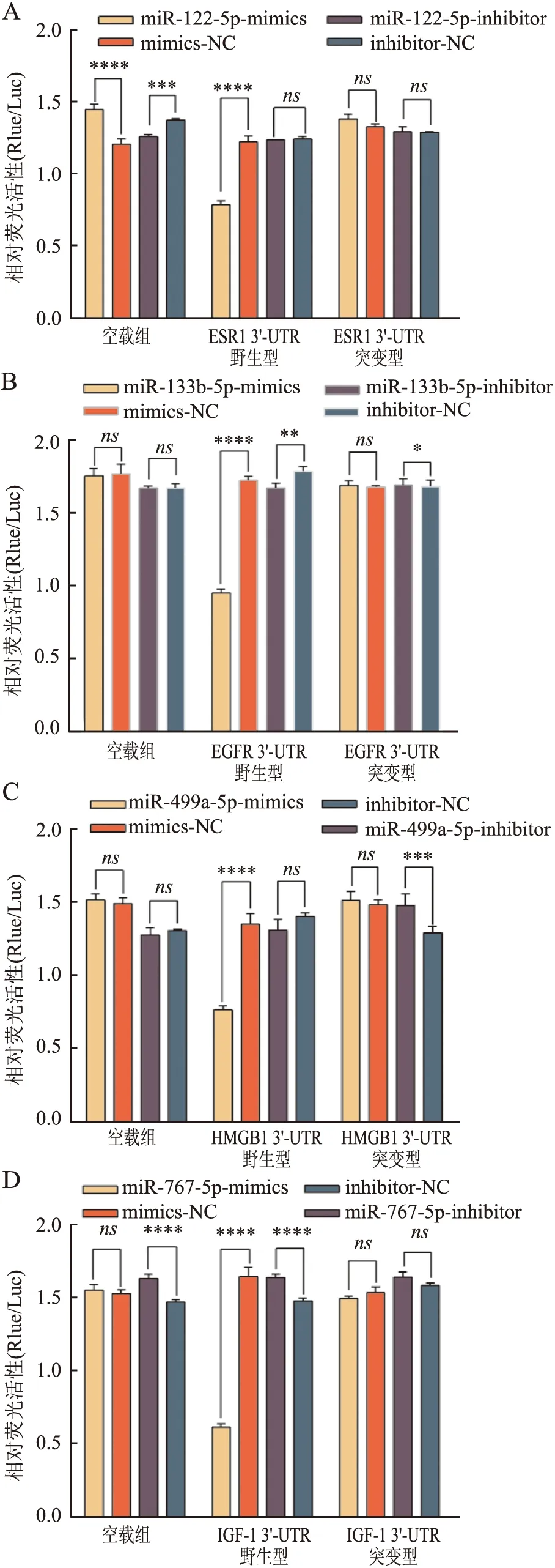
图4 双荧光素酶活性分析野生型和突变型:A. miR-122-5p 与ESR1的靶向关系;B.miR-133b-5p 与EGFR的靶向关系;C.miR-499a-5p与HMGB1的靶向关系;D.miR-767-5p与IGF-1的靶向关系;*P<0.05,**P<0.01,***P<0.001,****P<0.000 1,ns.无相关性
3 讨论
乳腺肿瘤的发生、发展与相关基因突变和翻译后的变化有关[19]。目前,乳腺癌的分子、细胞机制、诊断、预防和治疗等虽然已取得重大进展,但患者的生存率无显著改善[20]。
本组通过TCGA分析172个上调(log2FC≥1)的miRNAs,查阅文献[10-17]筛选4种显著差异的miRNAs,且在乳腺癌细胞CCD-1095Sk、MCF-7、MDA-MB-231、MDA-MB-468、T-47D和ZR-75-1中均有不同程度的表达,通过GO和KEGG分析hsa-miR-122-5p、hsa-miR-133b-5p、hsa-miR-449a-5p和hsa-miR-767-5p的靶基因分别为ESR1、EGFR、HMGB1和IGF-1。已有研究证明,ESR1可能在乳腺癌的治疗和转移性发展中发挥重要作用,患者治疗后可显著改善ESR1突变[21]。EGFR有助于癌细胞的生长、迁移和转移的形成[22]。HMGB1在乳腺癌组织中具有较高的表达[23],在病情进展和转移过程中发挥重要作用[24]。有研究证明,槲皮素通过抑制HMGB1的表达促进人乳腺癌细胞凋亡[25]。IGF-1能够调节乳腺发育,在乳腺癌中诱导细胞增殖和迁移,其高表达可增加乳腺癌的风险[26]。
根据4种差异miRNAs的序列设计合成mimics、mimics-NC、inhibitor、inhibitor-NC,通过双荧光素酶报告实验发现,在转染MCF-7乳腺癌细胞后,miR-122-5p与ESR1 3′-UTR序列靶向结合,miR-133b-5p与EGFR 3′-UTR序列靶向结合,miR-499a-5p与HMGB1 3′-UTR序列靶向结合,miR-767-5p与IGF-1 3′-UTR序列靶向结合。4种差异miRNAs均能抑制基因的表达,其靶向结合位点与预测位点一致。
本实验通过生物信息学筛选4种差异表达的miRNAs:hsa-miR-122、hsa-miR-767、hsa-miR-449a和hsa-miR-133b。miR-122-5p、miR-133b-5p、miR-499a-5p和miR-767-5p分别与ESR1、EGFR、HMGB1和IGF-1靶向结合,并抑制基因的表达,其中IGF-1的表达水平与患者年龄、原发肿瘤分期差异有显著性,为乳腺癌的靶点治疗和基因治疗提供参考。

