乳腺原发癌和淋巴结转移癌中TGF-β1和p53的间质表达及临床意义
张会芳,宋婷婷,安 杰,杨 月,韩玉贞
肿瘤微环境(tumor microenvironment, TME)由肿瘤细胞和间质细胞及基质等构成,在肿瘤的浸润和转移中发挥重要作用。肿瘤细胞激活形成的癌相关成纤维细胞(cancer-associated fibroblasts, CAF)是乳腺癌组织中的主要间质细胞,可分泌多种细胞因子促进乳腺癌的浸润和转移。许多研究表明,乳腺癌细胞中TGF-β1和p53的表达与乳腺癌预后有相关性[1-2]。目前,两者在乳腺癌间质中的表达研究较少,且有关TGF-β1和p53在乳腺原发癌和淋巴结转移癌间质中的相关性国内外尚未见报道。因此,本文着重探讨乳腺原发癌和淋巴结转移癌间质中TGF-β1和p53的表达及预后价值,以提高临床与病理医师的认识水平。
1 材料与方法
1.1 材料收集2011年1月~2016年12月滨州医学院附属医院病理科有淋巴结转移的非特殊型浸润性乳腺癌160例,其有完整的随访资料,包括患者年龄、肿块直径、组织学分级、转移淋巴结个数、ER、PR、HER-2、Ki-67的表达。患者均为女性,术前均未接受新辅助治疗。随访截至2020年6月或患者死亡,中位随访时间为58个月。
1.2 方法采用免疫组化EnVision法染色。TGF-β1抗体购于博奥森公司,p53抗体和二抗购于北京中杉金桥公司。标本均经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,将切片置于64 ℃烤箱中烘烤1 h,脱蜡至水,高温高压法修复抗原后晾凉,3%H2O2去除内源性过氧化物酶,加入一抗TGF-β1(稀释比1 ∶200)及p53(稀释比1 ∶200)抗体4 ℃过夜,放置37 ℃恒温箱中复温30 min,PBS水洗后加二抗37 ℃孵育30 min,DAB显色,苏木精复染,1%盐酸乙醇分化,脱水透明,中性树胶封固。以PBS缓冲液代替一抗作为阴性对照,以已知阳性切片作为阳性对照。
1.3 结果判断肿瘤间质的评判范围参考文献报道[3-4]等的标准,原发癌中评判为浸润性癌区域的肿瘤间质,淋巴结转移癌中选取被肿瘤细胞和肿瘤间质侵占区域的肿瘤间质,且选取视野四周均有肿瘤细胞浸润的区域。随机观察10个高倍视野,计数间质阳性细胞的平均值。根据阳性细胞着色强度和阳性细胞百分比进行判断:(1)根据阳性细胞着色强度评分:未着色为0分,淡黄色为1分,黄色为2分,棕褐色为3分;(2)阳性细胞百分比评分:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。两项得分结果相加:0~3分为阴性,4~7分为阳性。
1.4 统计学分析采用SPSS 25.0软件对数据进行统计学分析,组间比较采用χ2检验。采用列联系数法计算相关性;应用Kaplan-Meier法绘制生存曲线并结合Log-rank检验进行生存过程的比较。采用Cox比例风险回归模型进行单因素和多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺原发癌和淋巴结转移癌间质中TGF-β1和p53的表达TGF-β1在间质CAF中的表达定位于细胞质(图1A、B),p53在间质CAF中的表达定位于细胞核(图1C、D)。TGF-β1和p53在乳腺原发癌和淋巴结转移癌间质中,表达的一致率均为87.5%。在乳腺原发癌和淋巴结转移癌之间,间质中TGF-β1的表达呈正相关(r=0.603,P<0.001,表1),间质中p53的表达也呈正相关(r=0.604,P<0.001,表2)。
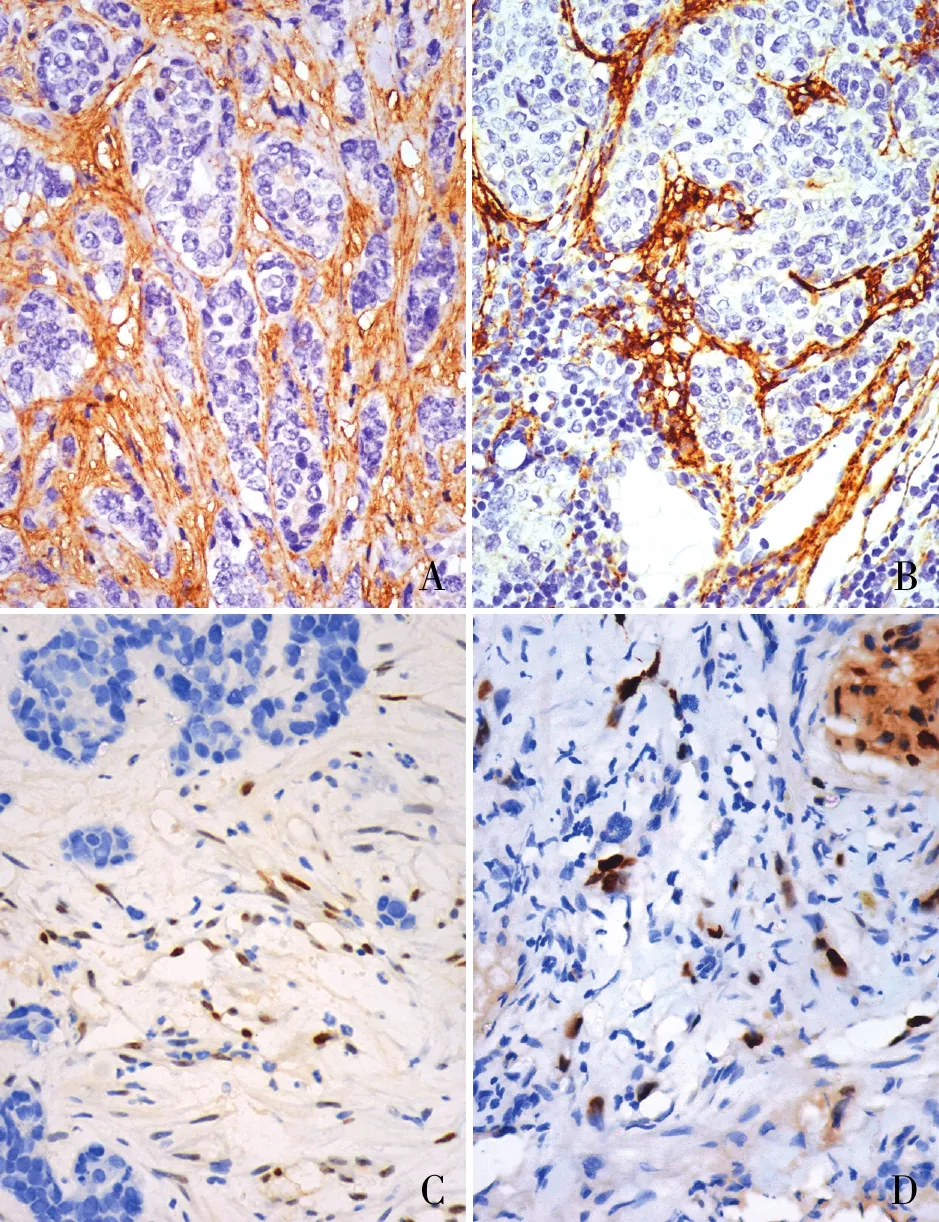
图1 A.TGF-β1在原发癌间质中呈阳性,EnVision法;B.TGF-β1在淋巴结转移癌间质中呈阳性,EnVision法;C.p53在原发癌间质中呈阳性,EnVision法;D.p53在淋巴结转移癌间质中呈阳性,EnVision法
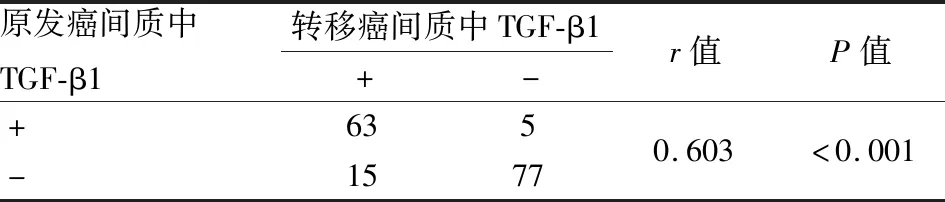
表1 乳腺原发癌和淋巴结转移癌间质中TGF-β1的表达

表2 乳腺原发癌和淋巴结转移癌间质中p53的表达
2.2 乳腺癌患者预后的Cox单因素与多因素分析Cox单因素分析结果显示:肿块直径(P=0.002)、转移淋巴结个数(P<0.001)、ER、PR、HER-2的表达(P均<0.05)、原发癌和转移癌间质中p53的表达(P均<0.05),均是患者预后的危险因素。Cox多因素分析结果显示:转移淋巴结个数(HR=3.267,95%CI:1.870~5.707)、HER-2的表达(HR=1.938,95%CI:1.161~3.233)、原发癌间质中p53的表达(HR=4.118,95%CI:1.504~11.273),均是患者预后的独立危险因素(P均<0.05,表3)。
2.3 TGF-β1和p53的间质表达及预后分析Kaplan-Meier生存曲线结合Log-rank检验显示:在乳腺原发癌和相应淋巴结转移癌间质中,TGF-β1的表达与预后无关(P均>0.05,图2A、B);p53阳性患者的生存率低于阴性患者,差异有统计学意义(P均<0.05,图2C、D)。在乳腺原发癌和相应淋巴结转移癌间质中,TGF-β1阳性和p53阴性组患者的预后好于TGF-β1和p53均阳性组,差异有统计学意义(P均<0.05,表4,图2E、F)。
3 讨论
乳腺癌是女性最常见的恶性肿瘤,TME在乳腺癌的侵袭和转移中发挥重要作用。TME是指肿瘤存在的微环境,包括周围的免疫细胞、血管、细胞外基质、成纤维细胞、淋巴细胞、骨髓衍生的炎症细胞和信号分子等,具有营养支持、免疫逃避、促进转移等作用。CAF是TME的重要组成部分,具有多种功能,包括基质沉积和重塑以及与癌细胞的广泛相互信号作用。
TGF-β1在肿瘤发生、发展过程中,由最初的抑癌作用逐渐发展为促癌作用。在多数乳腺癌和其转移灶中,TGF-β1从抑癌作用到促癌作用的转化均与磷酸化的Smad2呈正相关,Smad通路是TGF-β1信号通路中的重要途径。癌细胞分泌的TGF-β1有助于CAF的激活和增殖[5],其在间质中的表达与CAF呈正相关[6]。在乳腺癌中CAF也可分泌TGF-β1,并激活乳腺癌细胞中的TGF-β1/Smad信号通路,诱导上皮-间质转化(epithelial-mesenchymal transition, EMT)促进乳腺癌细胞的侵袭性表型[7],而抑制TGF-β1信号传导可以减少CAF诱导的肿瘤生长和转移[8],TGF-β1可以维持CAF活性状态,也是CAF促进乳腺癌恶化所必需的[9]。此外,对前列腺癌[10-11]、结直肠癌[12]、胃癌[13]等相关性研究中发现CAF中TGF-β1信号的激活与肿瘤细胞的侵袭和转移也密切相关。也有研究表明,肿瘤细胞中高表达TGF-β1和TGF-βⅡ型受体的乳腺癌患者有更长的无瘤生存期和总生存期[14],也有研究发现血液中TGF-β1含量升高的乳腺癌患者有更好的预后和更少的远处转移[15]。另有研究发现,CAF中TGF-β1的表达在乳腺原发癌和淋巴结转移癌中具有较好的相关性[16]。本实验结果显示:TGF-β1在乳腺原发癌及相应淋巴结转移癌间质中的表达呈正相关,但无论是乳腺原发癌还是淋巴结转移癌,均未显示间质中TGF-β1的表达与不良预后相关。因此,有关TGF-β1的表达,尤其间质中TGF-β1的表达与乳腺癌预后的关系有待进一步分析。
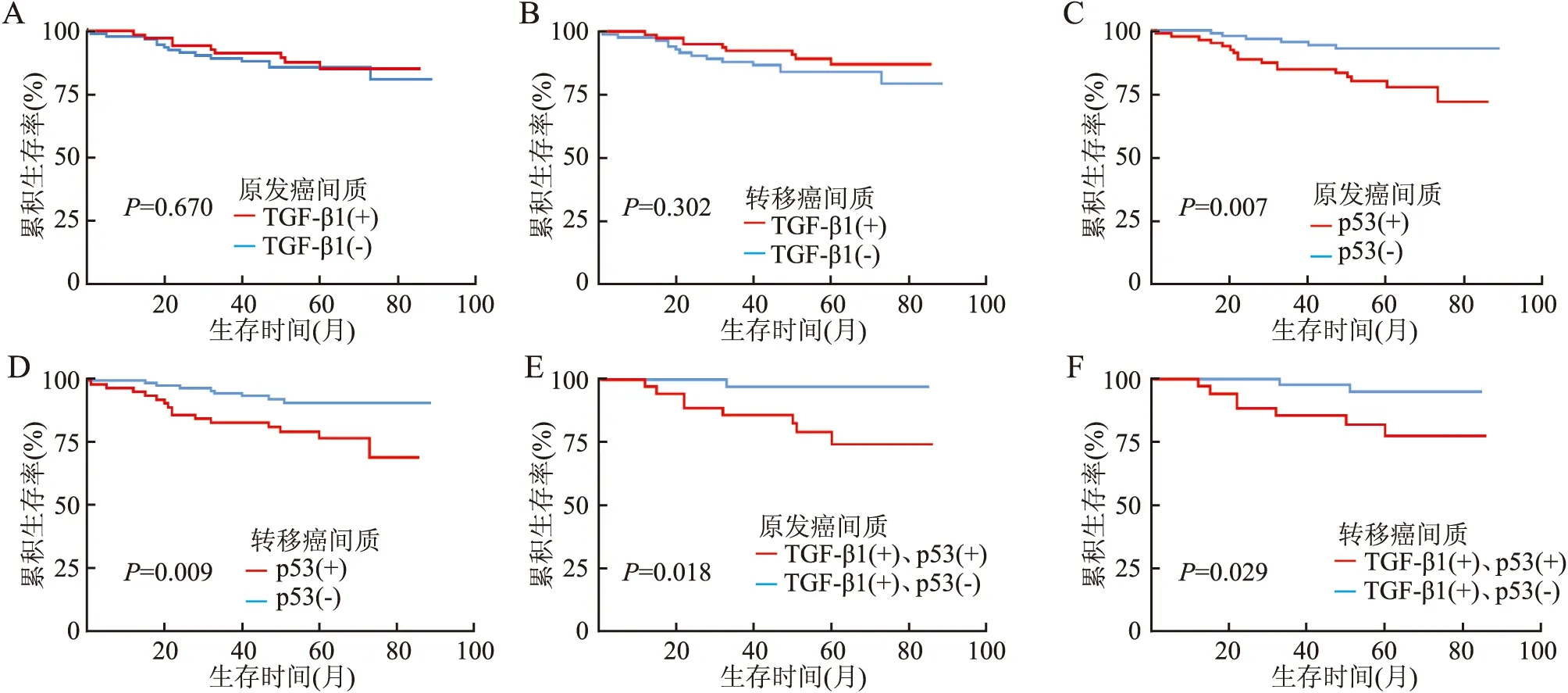
图2 Kaplan-Meier生存曲线分析乳腺癌患者的预后:乳腺原发癌(A)和淋巴结转移癌(B)间质中TGF-β1的表达与生存期的关系;乳腺原发癌(C)和淋巴结转移癌(D)间质中p53的表达与生存期的关系;乳腺原发癌(E)和淋巴结转移癌(F)间质中TGF-β1和p53的不同表达与生存期的关系
人类肿瘤50%以上有p53基因的突变,有研究表明p53的高表达与食管鳞状细胞癌[17]和肝细胞癌[18]的预后不良相关。文献报道p53的高表达是乳腺癌预后差的重要因素[19]。乳腺癌间质中也存在p53的表达,且与乳腺癌淋巴结转移及预后有关[20-21]。本实验结果显示:在乳腺原发癌和淋巴结转移癌之间,间质p53的表达呈正相关,且无论原发癌还是淋巴结转移癌,p53的间质表达均与预后不良相关,原发癌间质p53的表达是判断预后的独立危险因素。
许多研究表明,乳腺癌发生转移后,转移癌细胞仍保留原发癌细胞产生某些基因、蛋白的特性,如ER、HER-2等表现为高度的一致性[22]。一般认为,原发癌中的CAF是正常纤维母细胞增生活化而来,与癌细胞不同,转移癌间质中的CAF不是转移而来,而是由转移癌细胞周围的纤维母细胞转化而来。本课题组前期对乳腺癌肿瘤间质比(tumor-stroma ratio, TSR)的研究表明,原发癌与淋巴结转移癌中的TSR存在高度一致性[4]。目前,有关转移癌间质中CAF的TGF-β1和p53表达尚不清楚。本实验结果显示,在乳腺原发癌和淋巴结转移癌中,TGF-β1和p53的间质表达呈正相关,两者在乳腺原发癌和淋巴结转移癌间质中的表达呈高度的一致性。这可能是由于原发癌和淋巴结转移癌细胞有相似的特性,而导致间质TGF-β1和p53表达一致,具体机制有待进一步分析。
TGF-β1调节信号通路中某些促癌基因的转录激活需要突变型p53基因的参与,突变型p53基因对TGF-β1信号通路有激活和加强作用,两者在肿瘤的浸润和转移过程中有密切联系[23-24]。在乳腺癌中TGF-β1的高表达促进肿瘤的进展,如发生p53的突变,其促进作用会进一步增强[25]。其在间质中是否具有同样的作用,尚不清楚。本实验结果显示:在乳腺原发癌和相应淋巴结转移癌间质中,TGF-β1和p53均阳性组与TGF-β1阳性、p53阴性组相比,前者预后较差;提示在乳腺原发癌和相应淋巴结转移癌间质中,TGF-β1和p53的作用与乳腺癌细胞相似,间质CAF中p53基因突变可以促进TGF-β1信号通路的转录,从而促进乳腺癌的进展。

表3 乳腺癌预后Cox危险因素分析
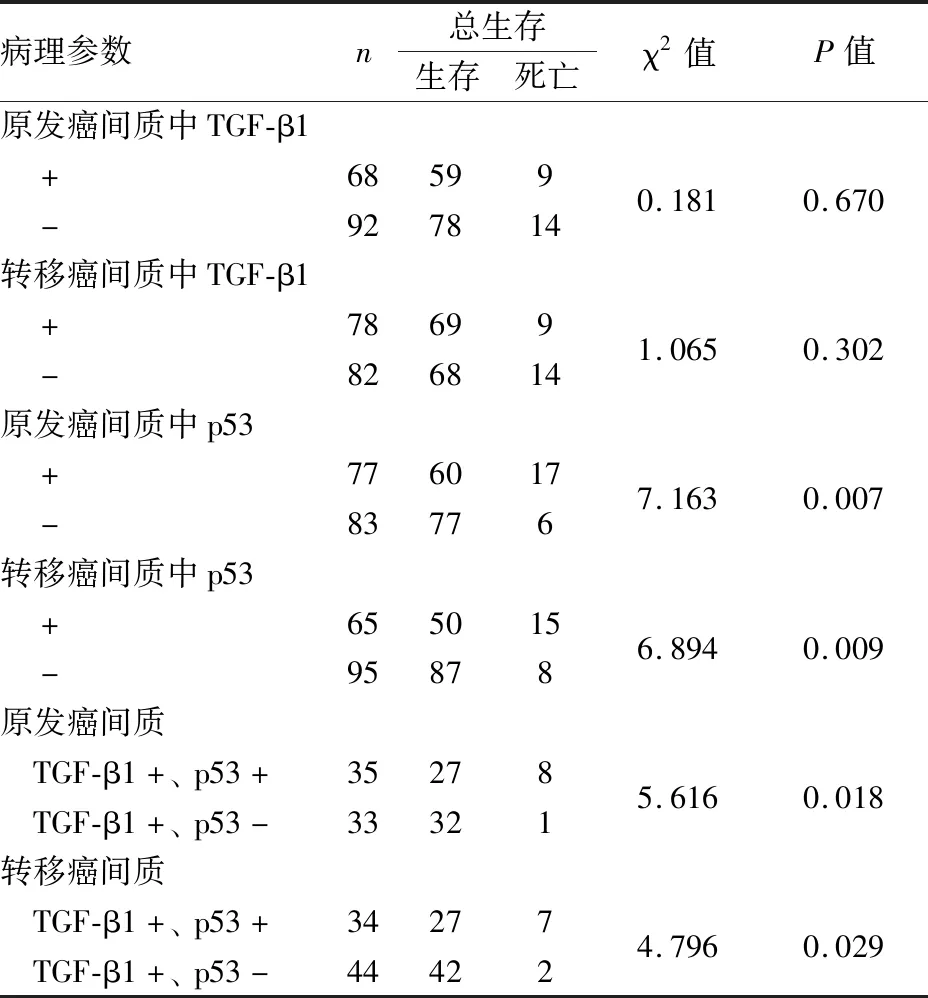
表4 TGF-β1和p53的间质表达与乳腺癌患者预后的关系

