红肉火龙果HpCYP76AD1基因克隆与表达分析
郑乾明,王小柯,马玉华
(贵州省农业科学院果树科学研究所,贵阳 550006)
【研究意义】红肉火龙果果实色泽鲜艳,其含有的甜菜色素既能作为天然食用色素[1-2],又具有淬灭自由基的活性,在抗氧化、抑制癌细胞及肿瘤细胞生长等具有应用价值[3-6]。红肉火龙果果实中的甜菜色素主要为甜菜红素和甜菜黄素,甜菜红素是决定红肉火龙果果实成熟时色泽的主要色素[7-9]。研究红肉火龙果果实甜菜红素的积累,分离代谢途径关键基因,有利于阐明红肉火龙果果实甜菜红素积累的分子机制,对调控果实甜菜红素含量,改良果实商品价值具有重要意义。【前人研究进展】甜菜红素的生物合成以酪氨酸为前体,经过羟基化和氧化等形成重要的中间产物L-3,4-二羟基苯丙氨酸(L-DOPA)和甜菜醛氨酸[4,10-11]。最早在甜菜(Betavulgaris)中克隆获得细胞色素P450家族成员BvCYP76AD1基因,其蛋白定位于细胞质和细胞核[12],通过基因干涉表达和酵母异源表达研究均证明BvCYP76AD1介导L-DOPA生成cyclo-DOPA[13]。紫茉莉(Mirabilisjalapa)MjCYP76AD3是BvCYP76AD1的直系同源基因,其基因表达量与甜菜红素含量显著相关[14]。通过化学诱变剂处理,从藜麦(ChenopodiumquinoaWilld)分离CqCYP76AD1-1基因,其表达与下胚轴甜菜红素积累有关,突变后丧失酶活性,甜菜红素不积累[15]。近年来还发现,BvCYP76AD1介导酪氨酸羟基化形成L-DOPA,是甜菜红素合成途径中的第一个关键反应[16]。红肉火龙果果实甜菜色素积累主要在授粉的24~28 d[17-20]。近年来发布火龙果基因组序列[21-22],利用Illumina平台的第二代高通量测序对果实进行转录组分析表明,CYP76AD1相关基因部分序列受转录因子HpWRKY44的转录激活调控[17, 23-24]。【本研究切入点】当前未有报道火龙果CYP76AD1基因的序列全长,不能开展基因功能等分析。因此,通过果实成熟期间转录组测序数据结合RT-PCR和测序,分离红肉火龙果CYP76AD1相关基因。【拟解决的关键问题】获得火龙果HpCYP76AD1基因全长,分析其序列特征和基因表达模式,为明确其在果实甜菜红素合成途径中的生理功能奠定基础。
1 材料与方法
1.1 材料
红肉火龙果品种为“紫红龙”,采集于贵州省安顺市镇宁县的火龙果种植园。
1.2 方法
1.2.1 检测样品制备 将火龙果“紫红龙”人工授粉当天记为0 d,于授粉的20,23,25,27和30 d采集火龙果果实样品,每个时期采集9个果实,每3个果实为1次重复,共3次重复。取果肉切成厚度约0.5 cm的薄片,液氮速冻。所有样品均在-80 ℃超低温冰箱保存。
1.2.2 甜菜色素含量检测 火龙果果肉甜菜红素提取和含量检测参考Hua等[17]的方法,果肉甜菜红素相对含量利用分光光度计检测。
1.2.3 RNA提取和转录组测序 利用Trizol试剂盒(Invitrogen,USA)提取火龙果果肉总RNA,使用琼脂糖凝胶电泳和Nanodrop 2000分别检测其质量和浓度。共计15份果肉样品进行转录组高通量测序(数据未发表),文库构建、序列注释和数据分析参见此前描述[25]。
1.2.4 RT-PCR扩增和测序 取1.0 μg合格样品,利用RevertAid First Strand cDNA合成试剂盒(Fermentas,USA)合成cDNA第一链。使用Primer Premier 6软件设计引物HpCYP76AD1-ORF-F和HpCYP76AD1-ORF-R(表1)用于RT-PCR扩增。以授粉30 d的果肉总RNA反转录合成的cDNA为PCR模板。扩增产物经电泳分离后回收,产物连接到克隆载体并转化到大肠杆菌,挑取阳性克隆测序。
1.2.5 生物信息学分析 ORF预测使用ORF Finder程序(https://www.ncbi.nlm.nih.gov/orffinder/),理论等电点和相对分子量预测使用ExPASy程序(https://web.expasy.org/compute_pi/)。蛋白质二级结构预测使用PredictProtein(https://www.predictprotein.org)。利用Clustal W软件进行序列比对,利用MEGA 6.0软件构建基于邻接法的系统进化树,Bootstrap值进行1000次重复检验。
1.2.6 qRT-PCR检测 根据HpCYP76AD1基因序列,使用Primer Premier 6软件设计引物HpCYP76AD1-qRT-F和HpCYP76AD1-qRT-R(表1)。利用CFX ConnectTMReal-Time PCR检测系统(Bio-Rad,USA)进行qRT-PCR检测。反应体系总体积为20.0 μL,包括cDNA模板 1.0 μL,引物1.6 μL,SYBR Green PCR 混合体系(Applied Biosystems,USA)10.0 μL和ddH2O 7.4 μL。扩增程序如下:95 ℃变性3 min;5 ℃变性10 s,55 ℃退火20 s,72 ℃延伸 20 s,共40次循环。使用HpPTBP-F和HpPTBP-R作为内参基因(序列未发表)。基因相对表达量使用公式2-ΔΔCt计算,以授粉20 d的基因表达量设为“1”。
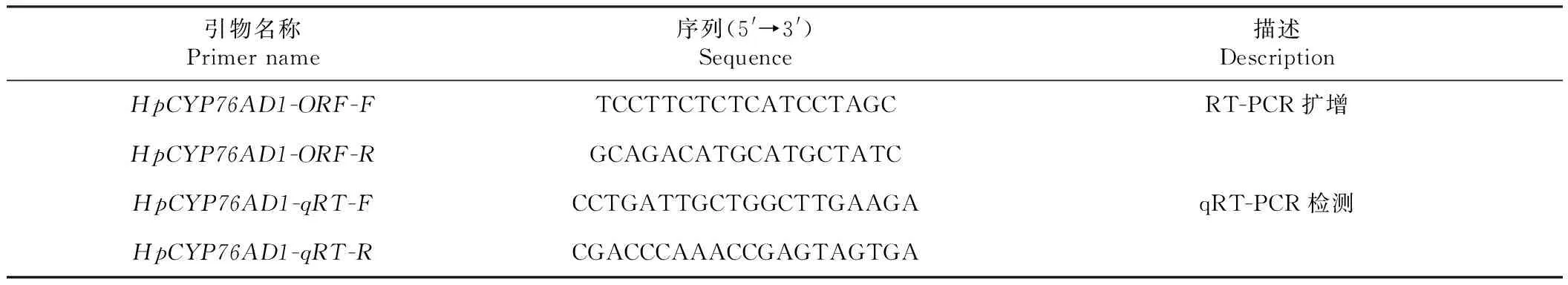
表1 HpCYP76AD1基因扩增和表达检测的相关引物序列Table 1 Relative primer sequences for amplification and expression detection of HpCYP76AD1 gene
2 结果与分析
2.1 果实甜菜红素含量
从图1看出,授粉20~25 d火龙果果肉的甜菜红素含量略有增加。授粉27 d后,甜菜红素显著积累;授粉30 d时甜菜红素含量大幅度增加,含量约为20 d的150倍。
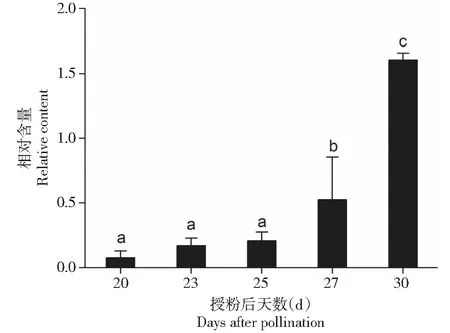
不同小写字母表示差异显著(P<0.05),下同Different lowercase letters indicate significant different at P<0.05 level. The same as below图1 红肉火龙果果实发育和成熟期间甜菜红素的相对含量Fig.1 The relative content of betacyanin at development and ripening stages of H. polyrhizus fruits
2.2 HpCYP76AD1基因克隆
对红肉火龙果果实发育至成熟的5个时期转录组测序分析,获得1条长度为2577 bp的Unigene,与甜菜CYP76AD1基因编码的氨基酸序列相似性为81%。该Unigene与前期报道的1个CYP76AD1相关Unigene(编号为c31181_g1)核苷酸序列[25]一致性为100%,说明两者为同一基因。c31181_g1在果实中特异性表达,其表达量约是茎中的2000倍。该Unigene序列含有一条长度为1521 bp的ORF序列,编码长度为506个氨基酸的蛋白质序列。设计RT-PCR引物扩增,然后克隆和测序获得其ORF序列。
2.3 HpCYP76AD1蛋白序列
对HpCYP76AD1基因编码的氨基酸序列进行预测,其理论等电点为8.86,相对分子量为57.5 kDa。将该序列在NCBI中再次进行blastx检索发现,其与梨果仙人掌OfCYP76AD8的序列相似度最高,达89.96%(表2)。

表2 HpCYP76AD1与其他同源基因序列的相似性Table 2 Sequence similarity of HpCYP76AD1 and other homologous genes
将HpCYP76AD1与甜菜、紫茉莉和梨果仙人掌等相关基因,使用氨基酸序列构建基于邻接法的系统进化树(图2)。上述基因明显分为两类,根据Sunnadeniya等[16]和Brockington等[26]对CYP76AD1家族成员的分类,HpCYP76AD1与梨果仙人掌OfCYP76AD8、紫茉莉MjCYP76AD3、甜菜BvCYP76AD1和紫色苋菜花AcCYP76AD2为α类,紫茉莉MjCYP76AD15、甜菜BvCYP76AD5和BvCYP76AD6为β类,HpCYP76AD1与来自仙人掌科梨果仙人掌的OfCYP76AD8亲缘关系最近。
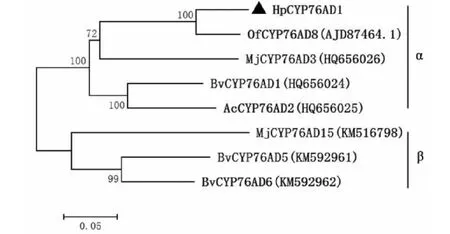
图2 HpCYP76AD1与其他相关基因的系统进化树Fig.2 Phylogenetic tree of HpCYP76AD1 and other related genes
2.4 HpCYP76AD1基因表达
从图3看出,授粉20~25 d期间HpCYP76AD1基因表达量增加。授粉27 d的基因表达量约为授粉20 d的1500倍,此后到果实完全成熟(授粉30 d)的表达量约为授粉20 d的1650倍。利用qRT-PCR检测的基因表达结果与RNA-seq结果基本一致。
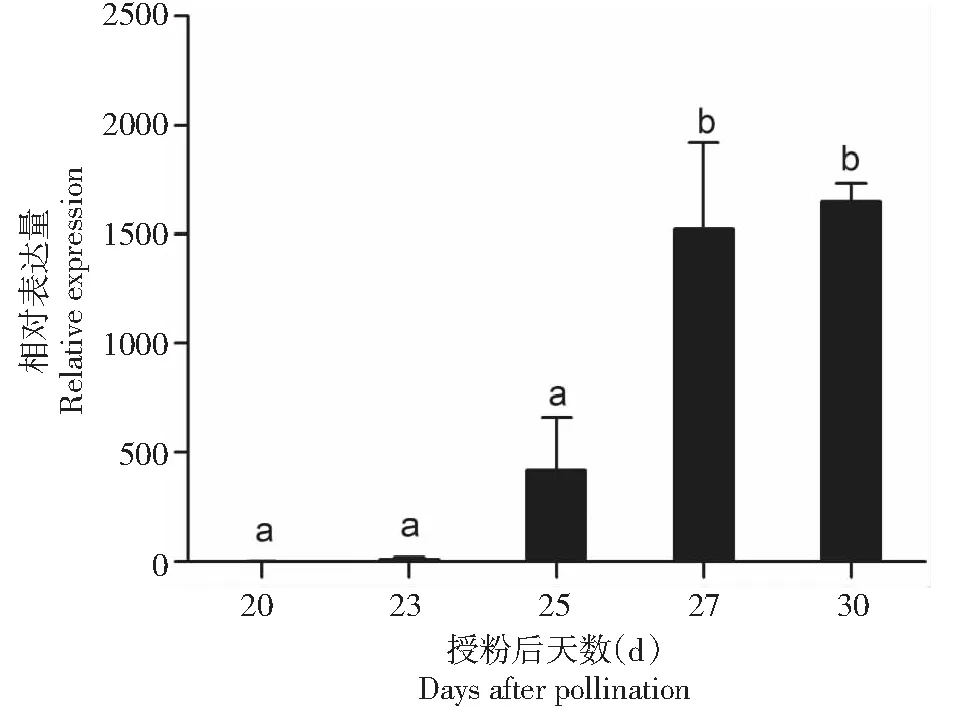
图3 红肉火龙果HpCYP76AD1基因在果实成熟期间的相对表达量Fig.3 Expression pattern of HpCYP76AD1 gene of H. polyrhizus during fruit ripening
3 讨 论
L-酪氨酸羟基化产生L-DOPA,以及L-DOPA羟基化产生cyclo-DOPA是甜菜色素合成途经中的两个关键上游步骤。甜菜BvCYP76AD1基因于2012年首次克隆,在甜菜中干涉或超量表达该基因均影响甜菜红素含量,通过酵母工程菌株表达验证其介导L-DOPA羟基化产生cyclo-DOPA[13]。此后,进一步发现BvCYP76AD1、BvCYP76AD5和BvCYP76AD6均具有催化L-酪氨酸羟基化产生L-DOPA的活性,但BvCYP76AD5和BvCYP76AD6不能催化L-DOPA羟基化产生cyclo-DOPA[16]。系统进化分析表明,BvCYP76AD1、MjCYP76AD3和AcCYP76AD2属于α类,BvCYP76AD5和BvCYP76AD6属于β类。α和β类都具有催化L-酪氨酸羟基化产生L-DOPA的能力,存在功能冗余。同时α类在进化中又产生催化L-DOPA羟基化形成cyclo-DOPA的能力。本研究获得的红肉火龙果HpCYP76AD1属于α类,因此具有上述2个羟基化反应的能力。
CYP76AD1基因的表达与甜菜红素含量呈现明显的正相关关系。紫茉莉不同发育时期的花被中,甜菜红素含量随CYP76AD3基因上调表达明显增加[14]。藜麦下胚轴中经光照刺激产生甜菜红素,CYP76AD1-1基因大量表达,说明CYP76AD1-1基因与甜菜红素积累密切相关[15]。红肉火龙果果实在成熟过程中甜菜红素大量积累,HpCYP76AD1基因在果实特异表达,且随果实成熟显著上调,说明甜菜HpCYP76AD1基因参与果实甜菜红素积累。下一步需要验证其催化活性及调控机制,为明确火龙果果实甜菜红素积累分子机制和改善果实品质奠定基础。
4 结 论
克隆红肉火龙果细胞色素P450家族成员HpCYP76AD1基因全长序列与甜菜BvCYP76AD1同属于α类,推测其在甜菜色素合成的两个上游羟基化反应中发挥重要功能。HpCYP76AD1基因在果实成熟期间大幅上调表达,参与果实成熟期间的甜菜红素积累。

