血清胃泌素含量与胃癌患者临床病理特征、病灶内ERK通路及相关增殖基因表达的相关性
王 瑞 香
(河南省太康县中医院内科 周口 461400)
胃癌是我国最常见的消化道恶性肿瘤,具有治疗后复发率高、5年生存率低的流行病学特点[1-2]。胃癌病灶内癌细胞的异常增殖是胃癌复发和转移的生物学基础,研究胃癌细胞增殖的关键调控分子不仅有助于发现诊断疾病及评估病情的新分子标志物,还有助于深入认识疾病的发生机制、发现新的治疗靶点。胃泌素是主要来源于胃窦G细胞的一种胃肠道激素,在胃黏膜上皮细胞发生恶变的过程中胃泌素的合成明显增加,释放进入血液循环的胃泌素能够作为血清标志物用于胃癌的诊断及评估。消化道恶性肿瘤相关的基础研究证实胃泌素对癌细胞的增殖具有促进作用且这一作用与激活ERK通路有关[5]。但目前关于胃癌病理进展、预后转归中胃泌素的生物学作用及机制尚缺乏充足的临床证据。基于此,本研究将以胃癌患者为对象,分析血清胃泌素含量与胃癌患者临床病理特征、病灶内ERK通路及相关增殖基因表达的相关性,现报道如下。
1 对象与方法
1.1 研究对象
选取2018年1月-2020年3月期间于我院行手术切除治疗的124例胃癌患者作为胃癌组。纳入标准:(1)经手术后病理诊断为胃癌;(2)术前留取血清样本;(3)术后留取胃癌组织及癌旁组织;(4)临床病理资料完整。排除标准:(1)术前接受过放化疗或其他抗癌治疗;(2)既往有其他恶性肿瘤病史。选择2018年1月-2020年3月期间于我院进行体检的148例健康志愿者作为对照组,体检时留取血清样本,经体检排除消化道疾患及心肝肾等脏器功能不全者。胃癌组中男71例,女53例;年龄(59.38±9.39)岁;合并高血压34例、糖尿病14例。对照组中男83例,女65例;年龄(57.61±10.39)岁;合并高血压43例、糖尿病16例。两组间一般资料的比较无统计学差异(P>0.05)。
1.2 血清中胃泌素含量的检测
胃癌组患者手术前采集空腹外周静脉血3~5mL,对照组志愿者体检时采集空腹外周静脉血3~5mL,3 000r/min离心10min分离血清,采用酶联免疫吸附法检测胃泌素含量。
1.3 预后的随访
手术后进行2年随访,随访方式包括门诊或住院复查、电话回访等。随访内容包括无进展生存(DFS)和总生存(OS)情况。
1.4 组织中p-ERK表达的western blot检测
取胃癌组患者手术切除的胃癌组织及距离病灶边缘5cm以上的癌旁组织,加入组织裂解液后在冰上研磨得到组织匀浆液,12 000r/min离心10min分离上清,根据上清蛋白浓度的检测结果将含有30μg蛋白的上清用于western blot检测。上清先在聚丙烯酰胺凝胶中电泳,而后电转移至硝酸纤维素膜,封闭后孵育ERK、p-ERK一抗(美国CST公司)过夜,然后孵育二抗1h,将硝酸纤维素膜放入凝胶成像系统(上海勤翔仪器公司),采用ECL法显影得到ERK、p-ERK的条带,用ImageJ软件扫描条带灰度值,而后计算p-ERK灰度值/ERK灰度值作为p-ERK的蛋白表达水平。
1.5 组织中增殖基因表达的PCR检测
取胃癌组患者手术切除的胃癌组织及距离病灶边缘5cm以上的癌旁组织,采用RNA提取试剂盒(北京康为世纪公司)分离组织样本中的总RNA,然后使用一步法反转录试剂盒(北京康为世纪公司)将组织总RNA反转录为cDNA,最后采用荧光定量检测试剂盒(北京康为世纪公司)对cDNA中的 CyclinB1、CyclinD1、CyclinE、Bax、Caspase-3进行检测。按照试剂盒说明书配制PCR反应体系:cDNA2μL、2×Taq Plus MasterMix 10μL、上游引物0.6μL、下游引物0.6μL,去离子水补足至20.0 μL混匀。将体系放入荧光定量PCR仪,设置如下反应程序:95℃ 3min后95℃ 20s、特异性退火温度15s、72℃ 20s,重复40个循环,得到PCR反应曲线及循环阈值(Ct),按照公式表达量=2-ΔΔCt计算CyclinB1、CyclinD1、CyclinE、Bax、Caspase-3的mRNA表达量。引物序列及退火温度见表1。

表1 基因引物序列及PCR反应的特异性退火温度
1.6 统计学处理
采用SPSS23.0软件进行统计学处理,计量资料按照均数±标准差描述,采用独立样本t检验分析两组间差异;DFS和OS采用K-M曲线描述,采用Log-rank检验分析两组间差异;相关性分析采用Pearson检验。P<0.05表示差异有统计学意义。
2 结果
2.1 胃癌组与对照组血清胃泌素含量的比较
胃癌组与对照组的血清胃泌素含量分别为(18.68±3.59)pmol/L和(11.44±2.28)pmol/L,经t检验分析,胃癌组患者的血清胃泌素含量高于对照组,差异有统计学意义(P<0.05)。
2.2 胃癌组中不同临床病理特征患者血清胃泌素含量的比较
胃癌组中不同性别、年龄、肿瘤分化程度的患者比较,血清胃泌素含量的差异无统计学意义(P>0.05);胃癌组中病灶直径≥3cm、TNM分期III期、术后随访中发生进展及死亡患者的血清胃泌素含量高于病灶直径<3cm、TNM分期I~II期、术后随访中未发生进展及死亡患者,差异有统计学意义(P<0.05),见表2。

表2 胃癌组中不同临床病理特征患者血清胃泌素含量的比较
2.3 胃癌组中不同血清胃泌素含量患者DFS和OS的比较
根据胃癌组患者血清胃泌素含量的中位数将其分为胃泌素高含量患者(≥中位数)和胃泌素低含量患者(<中位数)。绘制胃癌组中胃泌素高含量与低含量患者DFS和OS的K-M曲线并进行Log-rank检验,结果显示:胃泌素高含量患者的累积DFS率和累积OS率均低于胃泌素低含量患者(P<0.05),见图1-2。
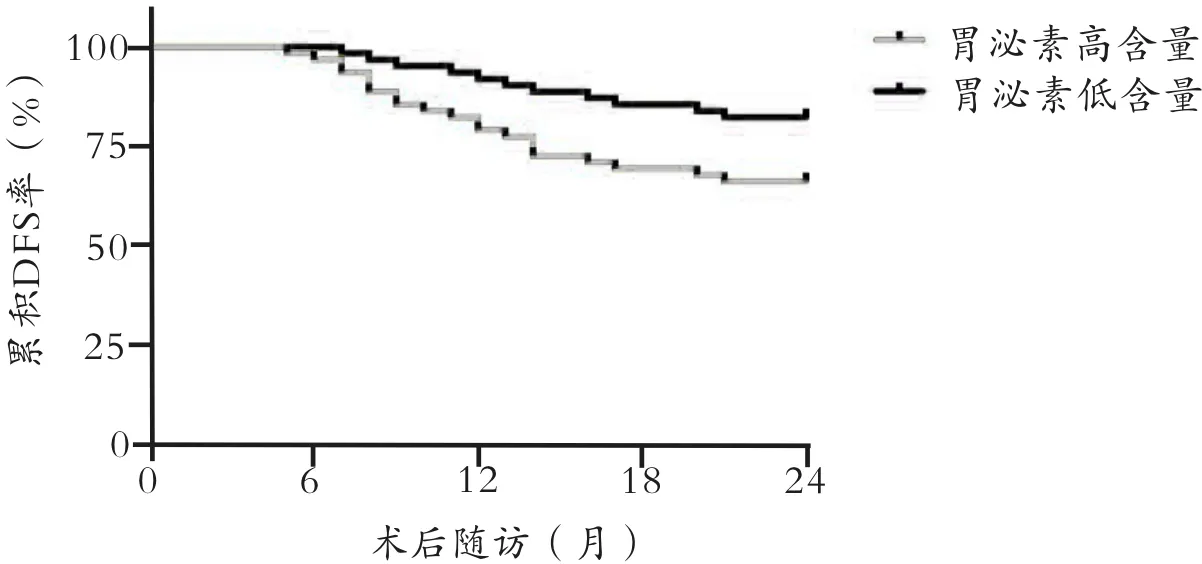
图1 胃癌组中不同血清胃泌素含量患者DFS的K-M曲线
2.4 胃癌组患者胃癌组织与癌旁组织ERK通路及相关增殖基因表达的比较
胃癌组患者胃癌组织中p-ERK的蛋白表达水平及CyclinB1、CyclinD1、CyclinE的mRNA表达水平高于癌旁组织,Bax、Caspase-3的mRNA表达水平低于癌旁组织,差异有统计学意义(P<0.05),见图3和表3。
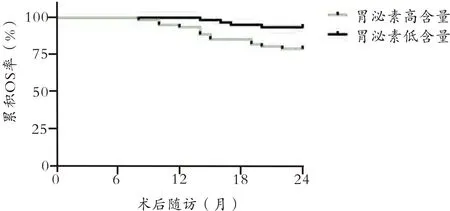
图2 胃癌组中不同血清胃泌素含量患者OS的K-M曲线

图3 胃癌组织与癌旁组织p-ERK的蛋白表达水平的比较
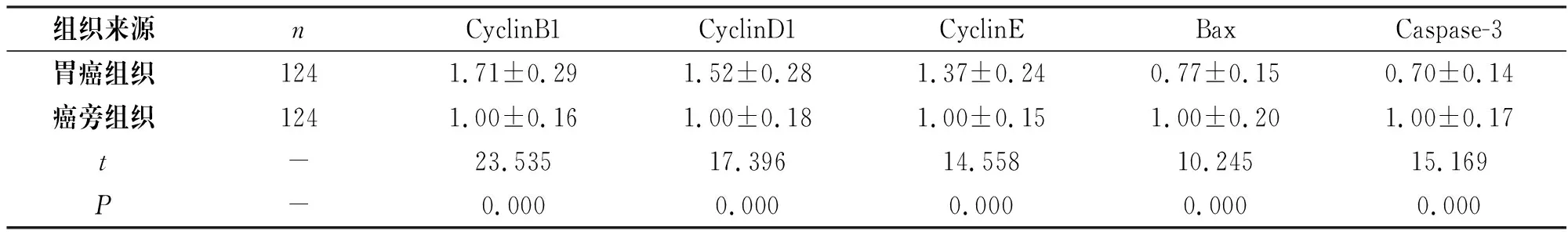
表3 胃癌组织与癌旁组织ERK通路相关增殖基因的mRNA表达水平的比较
2.5 胃癌组患者血清胃泌素含量与胃癌组织中ERK通路及相关增殖基因表达水平的相关性
胃癌组患者血清胃泌素含量与胃癌组织中p-ERK的蛋白表达水平及CyclinB1、CyclinD1、CyclinE的mRNA表达水平呈正相关,与Bax、Caspase-3的mRNA表达水平呈负相关,见表4。

表4 胃癌组患者血清胃泌素含量与ERK通路及相关增殖基因表达水平的相关性
3 讨论
我国胃癌的发病率呈逐年升高的趋势,虽然随着近些年消化内镜检查的推广,早期胃癌的诊断率有所提高,但多数胃癌患者在确诊时已为进展期,尽管通过手术治疗能够切除病灶,术后复发率、转移率及死亡率仍较高,整体预后并不理想[6-7]。目前限制胃癌临床诊疗的主要因素是疾病的发病机制不明,既不利于寻找早期诊断胃癌、评估胃癌预后的分子标志物,也不利于发现胃癌靶向治疗的手段。
胃泌素是近些年发现的胃癌标志物。在生理条件下,胃窦G细胞、十二指肠、空肠上段细胞是血液循环中胃泌素的主要来源,参与胃肠功能的调控;在胃癌发生发展的病理过程中,胃黏膜上皮恶变会造成胃泌素表达增加,高表达的胃泌素一方面释放进入血液循环,成为诊断疾病的标志物, 另一方面在病灶局部调控癌细胞的增殖、迁移、侵袭等[8-9]。已有多项临床研究证实胃癌患者血清中胃泌素含量升高,胃泌素对胃癌具有诊断价值[10-11]。本研究的分析结果与既往其他学者的研究结果[10-11]一致,即胃癌患者血清中胃泌素的含量高于健康志愿者,表明胃泌素释放增加与胃癌的发生有关。
已有相关的细胞实验证实胃泌素对胃癌细胞、结直肠癌细胞等消化道恶性肿瘤细胞的增殖、迁移、侵袭等具有促进作用[5, 12-13]。在胃癌的发展进程中,癌细胞的增殖会造成病灶浸润、转移及体积增大,为了认识胃泌素在胃癌发展中的作用,本研究分析了胃癌的病理特征与血清胃泌素的关系,结果显示随着胃癌TNM分期及病灶直径增加,血清胃泌素的含量也呈相应增加趋势,表明胃癌的病理进展与胃泌素释放增加有关。胃癌手术后复发率和转移率高,生存预后不理想,相关的队列研究认为肿瘤分期增加、淋巴结转移等病理特征是预后不良的影响因素[14-15]。本研究在证实胃泌素含量增加与胃癌病理进展有关后,进一步分析了胃泌素含量与预后的关系,以肿瘤进展及死亡作为评价预后的终点事件,并分析可知,随着血清胃泌素含量增加,患者的累积DFS率和OS率均呈降低趋势,表明胃泌素释放增加不仅与病理进展有关,还与预后不良有关。
两项胃泌素调控结肠癌细胞增殖的细胞实验表明,胃泌素促进癌细胞增殖的相关分子机制是激活ERK通路。ERK通路属于MAPK家族,具有促进细胞增殖的生物学作用。胃癌相关的研究证实多种具有抗癌作用的药物通过抑制ERK通路激活及调控下游增殖相关基因CyclinB1、CyclinD1、CyclinE、Bax、Caspase-3表达的方式抑制胃癌细胞增殖[16-17]。本研究对胃癌组织及癌旁组织的检测结果显示:胃癌组织中p-ERK、CyclinB1、CyclinD1、CyclinE的表达增加,Bax、Caspase-3的表达降低,符合ERK通路激活及下游增殖基因表达变化参与胃癌发生发展的生物学特性。进一步通过相关性分析证实胃癌患者血清胃泌素的含量与p-ERK及下游增殖基因的表达水平具有显著相关性,提示胃泌素释放增加参与胃癌发生及发展的相关机制可能是激活ERK通路并调控下游增殖基因表达。
综上所述,胃癌患者血清胃泌素含量升高与病理进展、生存预后不佳有关,同时也与胃癌病灶内ERK通路激活及相关增殖基因表达变化相关。

