阿昔莫司对高糖诱导心肌细胞损伤保护作用机制研究
解园星 王文锋 田红燕
糖尿病性心肌病(diabetic cardiomyopathy,DCM)是糖尿病的常见并发症之一,多发于老年人,已成为引起老年人死亡的重要原因之一[1]。研究发现,DCM患者脂代谢异常、葡萄糖自身氧化及线粒体氧化等过程均可促进活性氧簇(reactive oxygen species,ROS)聚集及氧化应激反应激活,导致DCM患者心肌细胞氧化应激损伤及过度凋亡,甚至心力衰竭的发生[2]。阿昔莫司为烟酸衍生物,是临床常用的调脂、降脂药[3],可用于冠心病[4]、糖尿病伴血脂异常的治疗[5]。但阿昔莫司是否能应用DCM治疗,其对高糖诱导的心肌细胞损伤是否有保护作用,笔者还未见报道。本研究用高糖条件,体外培养心肌细胞模拟DCM模型,从氧化应激方面探讨其对心肌细胞保护作用机制,以期为阿昔莫司在DCM领域的治疗提供参考。
1 材料与方法
1.1 细胞及主要试剂与仪器 大鼠心肌H9C2细胞(购自上海明舟生物科技有限公司,产品编号:MZ-2622)。DMEM培养基(北京索莱宝科技有限公司,货号:90113);阿昔莫司(上海玉博生物科技有限公司,货号:CP-100750);MTT试剂盒(北京索莱宝科技有限公司,货号:M1020);活性氧簇(ROS)免疫荧光探针试剂盒(美国abcam公司,货号:ab62623);超氧化物歧化酶(SOD)、脂蛋白脂肪酶(LPL)、活性氧簇(ROS)、抗氧化酶超氧化物歧化酶2(SOD2)、脂质过氧化物酶体增殖物激活受体α(PPARα)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、心肌细胞脂质代谢相关指标-细胞膜糖蛋白(CD36)、葡萄糖转运蛋白4(GLUT4)一抗(美国abcam公司,货号:ab83108、ab91606、ab189925、ab68155、ab272718、ab256470、ab32572、ab252922、ab188317);荧光显微镜(型号:BX63,日本奥林巴斯公司)。
1.2 方法
1.2.1 细胞培养及处理:取大鼠心肌H9C2细胞株,常规复苏后,用DMEM/F12培养液(含10%胎牛血清、100 U/ml青霉素、100 mg/L链霉素),进行常规传代培养。取对数期细胞,按1×105个/ml密度接种于6孔板中,并进行如下处理:①对照组、低糖组、等渗组、高糖组,对照组采用正常培养基培养,低糖组及高糖组分别加入终浓度为5.6 mmol/L、30.0 mmol/L葡萄糖培养,等渗组在低糖组基础上加入24.4 mmol/L甘露醇培养,各组均培养24 h后,取细胞,采用MMT法检测细胞存活率,Western blot法检测SOD、LPL蛋白表达。②在高糖(30 mmol/L)条件下,用不同浓度阿昔莫司(0、5、10、25、50 μg/L)干预培养24 h,检测细胞存活率及SOD、LPL蛋白表达。③敲低SOD,并分为空白组、高糖组、阿昔莫司组、Si-SOD组、Si-NC组、阿昔莫司+Si-SOD组;空白组不做处理,正常培养;高糖组加入终浓度为30.0 mmol/L葡萄糖进行培养;阿昔莫司组在高糖组基础上加入终浓度为25 μg/L阿昔莫司溶液干预培养;Si-SOD及Si-NC组在转染SOD低表达序列腺病毒载体及其空载体腺病毒6 h后,在高糖环境下培养;阿昔莫司+Si-SOD组在阿昔莫司组基础上转染Si-SOD;各组均培养24 h后,检测细胞活性,细胞氧化应激及脂质代谢相关指标蛋白表达。
1.2.2 MTT法检测细胞存活率:取处理后的各组细胞,每孔加入20 μl浓度为5 mg/ml的MTT溶液于培养箱中放置4 h后,弃上清,加入二甲基亚砜(DMSO)溶液150 μl摇床振荡15 min后,在490 nm波长下,用酶标仪读取各组OD值,根据公式,细胞存活率=(对照组OD值-给药组OD值)/对照组OD值×100%,计算出各组细胞存活率。
1.2.3 Western blot法检测细胞SOD、LPL、SOD2、PPARα、GPx、CAT、CD36、GLUT4蛋白表达:收集各组细胞,裂解、抽提蛋白,BCA法测蛋白浓度,取50 μg蛋白样品行电泳及转膜反应,加入一抗(SOD、LPL、SOD2、PPARα、GPx、CAT、CD36、GLUT4抗体(1∶800),内参GAPDH(1∶1 000),4℃孵育过夜,加入二抗(1∶1 000)室温孵育1h,ELC显影曝光,化学发光成像分析系统拍照,以Image J分析系统进行半定量分析。
1.2.4 透射电镜观察细胞损伤状况:取上述1.2.1中③处理下的各组细胞,弃去上清液,磷酸缓冲液洗涤后,加入胰蛋白酶(0.125%,2 ml)消化5 min,2 000 r/min离心15 min,取下层细胞沉淀物,用戊二醛4℃固定4 h后,在电镜下观察细胞损伤状况。
1.2.5 油红O染色观察细胞脂质堆积状况:取上述1.2.1中③处理下的各组细胞,弃去上清液,磷酸缓冲液洗涤后,用60%异丙醇固定后,加入油红染液孵育30 min,苏木精复染后,弃去染色液,封片后在倒置显微镜下进行观察,拍照,采用异丙醇萃取法提取油红O,酶标仪检测492 nm除OD值。
1.2.6 免疫荧光检测细胞ROS蓄积状况:取上述1.2.1中③处理下的各组细胞,弃去培养液,4%多聚甲醛固定、曲拉通透化后,加入5 μmol/L离子荧光探针液,37℃孵育30 min,用Bio-Rad Radiance 2100 MP多光子显微镜和ImagePro分析软件对细胞内ROS荧光分布进行分析。每组随机选取5个视野,以单位面积内荧光强度代表ROS蓄积水平。
1.2.7 TUNEL染色法检测细胞凋亡水平:取上述1.2.1中③处理下的各组细胞,弃去培养液,4%多聚甲醛固定后,按TUNEL染色试剂盒说明书方法进行染色、封片后置于显微镜下观察拍照,用Image-pro plus软件系统检测棕黄色染色的凋亡细胞数目,细胞凋亡率=凋亡细胞数/细胞总数×100%。
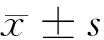
2 结果
2.1 不同浓度葡萄糖对细胞存活率及SOD、LPL表达的影响 MTT显示,糖浓度越高细胞存活率越低(P<0.05)。Western blot显示,糖浓度越高SOD表达越低(P<0.05),LPL表达越高(P<0.05)。见图1,表1。

图1 不同浓度高糖处理下SOD、LPL蛋白表达免疫印迹图;A 对照组;B 低糖组;C 等渗组;D 高糖组
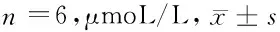
表1 不同浓度葡萄糖处理下细胞SOD、LPL蛋白表达比较
2.2 不同浓度阿昔莫司对细胞存活率及SOD、LPL蛋白表达的影响 高糖条件下,随着阿昔莫司浓度(0、5、10、25、50 μg/L)升高,细胞存活率逐渐升高(P<0.05),并在25~50 μg/L达到最高。SOD蛋白表达逐渐升高(P<0.05),LPL蛋白表达下降(P<0.05),且在25~50 μg/L达到最高及最低。见图2,表2。

图2 不同浓度阿昔莫司处理下细胞存活率(MTT检测)及SOD、LPL蛋白表达免疫印迹图
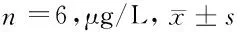
表2 不同浓度阿昔莫司处理条件下细胞SOD、LPL蛋白表达比较
2.3 阿昔莫司处理及敲低SOD对细胞存活率与凋亡率的影响 与空白组比较,高糖组细胞存活率降低(P<0.05),凋亡率升高(P<0.05)。与高糖组比较,阿昔莫司组存活率升高(P<0.05),凋亡率降低(P<0.05);Si-SOD组细胞存活率进一步降低(P<0.05),凋亡率进一步升高(P<0.05)。阿昔莫司+Si-SOD组指标变化与阿昔莫司组相反(P<0.05)。见图3,表3。

图3 阿昔莫司处理及敲低SOD后的细胞(TUNEL染色×400)
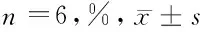
表3 阿昔莫司处理及敲低SOD后细胞凋亡率比较
2.4 阿昔莫司处理及敲低SOD对细胞损伤及脂质堆积的影响 电镜下,空白组心肌细胞结构正常,仅有少量脂滴形成;经油红O染色后可见胞内脂质呈红色。与空白组比较,电镜下高糖组细胞肿胀,胞膜及胞核固缩,细胞内线粒体肿胀及脂滴形成较多,染色后发现胞内脂质红染颜色加深,胞内脂质含量增加,脂质堆积严重(P<0.05)。与高糖组比较,阿昔莫司组细胞损伤、脂滴形成,脂质红染减轻,脂质堆积减缓(P<0.05);Si-SOD组细胞损伤及胞内脂质堆积进一步加重(P<0.05)。阿昔莫司+Si-SOD组上述指标变化与阿昔莫司组相反,差异有统计学意义(P<0.05)。见图4,表4。
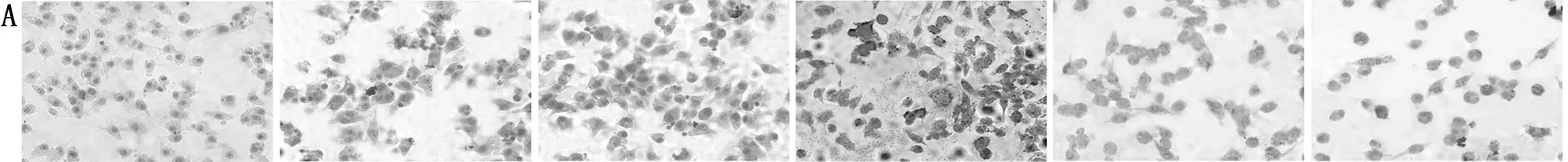
空白组高糖组阿昔莫司组Si-SOD组阿昔莫司+Si-SOD组Si-NC组
表4 阿昔莫司处理或敲低SOD后细胞脂质含量比较
2.5 阿昔莫司处理及敲低SOD对细胞ROS蓄积的影响 免疫荧光染色可见空白组细胞胞质中有少量显绿色荧光的ROS蓄积。与空白组比较,高糖组细胞ROS蓄积增强(P<0.05)。与高糖组比较,阿昔莫司组细胞ROS蓄积减弱(P<0.05);Si-SOD组细胞ROS蓄积进一步增强(P<0.05)。阿昔莫司+Si-SOD组上述指标变化与阿昔莫司组相反(P<0.05)。见表5,图5。
表5 细胞ROS水平比较
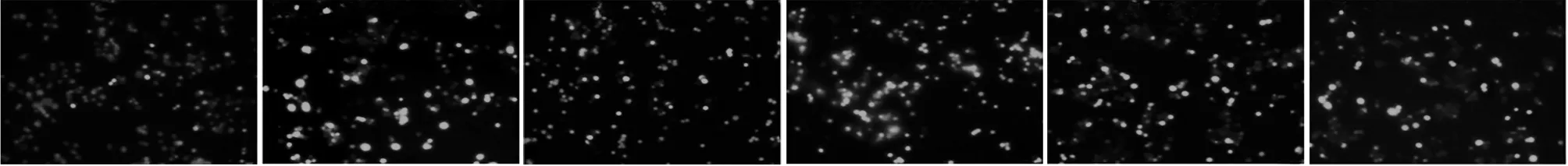
空白组高糖组阿昔莫司组Si-SOD组阿昔莫司+Si-SOD组Si-NC组
2.6 阿昔莫司处理及敲低SOD对细胞LPL、PPARα、CD36、GLUT4蛋白表达的影响 与空白组比较,高糖组细胞LPL、PPARα、CD36蛋白表达升高(P<0.05),GLUT4蛋白表达降低(P<0.05)。与高糖组比较,阿昔莫司组细胞LPL、PPARα、CD36蛋白表达降低(P<0.05),GLUT4蛋白表达升高(P<0.05);Si-SOD组细胞LPL、PPARα、CD36蛋白表达进一步升高(P<0.05),GLUT4蛋白表达进一步降低(P<0.05)。阿昔莫司+Si-SOD组上述指标变化与阿昔莫司组相反(P<0.05)。见表6,图7。
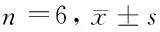
表6 细胞LPL、PPARα、CD36、GLUT4蛋白表达比较

图7 细胞LPL、PPARα、CD36、GLUT4蛋白表达免疫印迹图;A为空白组;B为高糖组;C为阿昔莫司组;D为Si-SOD组;E为阿昔莫司+Si-SOD组;F为Si-NC组
2.7 阿昔莫司处理及敲低SOD对细胞SOD、SOD2、GPx、CAT蛋白表达的影响 与空白组比较,高糖组细胞SOD、SOD2、GPx、CAT蛋白表达降低(P<0.05)。与高糖组比较,阿昔莫司组细胞SOD、SOD2、GPx、CAT蛋白表达升高(P<0.05);Si-SOD组细胞SOD、SOD2、GPx、CAT表达进一步降低(P<0.05)。阿昔莫司+Si-SOD组上述指标变化与阿昔莫司组相反(P<0.05)。见图8,表7。

图8 细胞SOD、SOD2、GPx、CAT蛋白表达免疫印迹图;A为空白组;B为高糖组;C为阿昔莫司组;D为Si-SOD组;E为阿昔莫司+Si-SOD组;F为Si-NC组
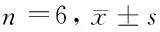
表7 细胞SOD、SOD2、GPx、CAT蛋白表达比较
3 讨论
DCM已成为困扰老年人健康的重要疾病之一,随着社会老龄化的推进、糖尿病发生率的升高,DCM发病率也逐渐升高[6]。目前国内外仍无特殊有效的方法治疗糖尿病并发症,降低人们罹患DCM的风险[7]。
DCM的病理机制也极为复杂,研究证实,糖尿病诱发的心肌细胞脂质代谢紊乱是糖尿病及DCM发生发展的始发因素,且调控心肌细胞脂质代谢,是预防及治疗DCM的关键方法[8]。Chiu等[9]体内外试验研究发现,高糖条件均可引起心肌细胞脂质代谢异常。LPL是脂蛋白降解及脂质代谢过程中的关键限速酶,能够水解细胞外的三酰甘油释放出游离脂肪酸,使胞内游离脂肪酸增加[9]。本研究发现,随着糖浓度增加,细胞LPL蛋白表达也显著升高。阿昔莫司为临床常用的降脂、调脂药。崔静华[10]发现阿昔莫司在降血脂的同时,还可显著降低血糖水平;熊守庆等[4]发现阿昔莫司可用于老年冠心病。本研究随着阿昔莫司干预水平的升高,高糖培养条件下的心肌细胞活性水平升高,而LPL蛋白降低,提示阿昔莫司可有效降低高糖诱导的心肌细胞脂质分泌,缓解心肌细胞损伤。
另外,高糖环境,也可通过脂质代谢、葡萄糖自身氧化、线粒体氧化磷酸化,来释放大量ROS促进氧化应激激活、加速心肌细胞凋亡和DNA损伤[11]。且持续的高血糖刺激心肌细胞氧化应激损伤是DCM重要发病机制之一[12]。SOD是重要的抗氧化指标,其活性降低可升高ROS水平,引起心肌细胞损伤[13]。本研究发现,随着糖浓度及LPL表达的升高,心肌细胞活性下降,细胞脂质含量升高,SOD表达水平也明显降低,而高糖条件下敲低SOD后,心肌细胞肿胀、损伤、氧化应激反应、脂质含量进一步加重,ROS水平蓄积、LPS水平进一步升高,心肌细胞凋亡率进一步增加。本研究结果显示,随着阿昔莫司干预浓度的升高,高糖诱导下心肌细胞氧化应激损伤、脂质含量、凋亡显著降低,ROS水平蓄积减少,SOD表达水平也明显升高,且Si-SOD可逆转阿昔莫司的上述作用,表明阿昔莫司对高糖诱导的心肌细胞氧化应激损伤有明显的缓解作用,预示阿昔莫司也可能为治疗DCM的潜在药物。
PPARα为配体脂肪酸激活的转录因子,其激活后,可与视黄酸X受体结合形成复合体,来作用于脂肪酸代谢相关基因的启动子区,从而调控脂肪酸代谢相关基因如脂肪酸转运蛋白CD36及线粒体脂肪酸氧化相关酶GLUT4表达,来促进心肌细胞对脂肪酸的摄取、抑制葡萄糖的摄取和利用,导致脂质蓄积,心肌细胞能量代谢异常,而诱发DCM产生[14]。Zong等[15,16]在DCM模型心肌组织及高糖诱导的心肌细胞中均检测到PPARα激活。另外,过量的脂肪酸摄取,会超过心肌细胞线粒体的氧化能力,促进ROS的蓄积及释放,此时若体内抗氧化酶水平不足,体内氧化/抗氧化作用失衡,会加速细胞结构和功能受损,最终导致细胞凋亡[17],DCM患者常伴血脂、血糖升高,心肌细胞氧化应激损伤加重。SOD、GPx、CAT为主要的抗氧化酶,当线粒体产生ROS时,线粒体中的抗氧化酶SOD2可将O2-催化产生成过氧化氢(H2O2),而GPx、CAT可将H2O2依次降解成为水(H2O),而发挥抗氧化作用[18,19]。廖荣华等[20]在高糖培养的心肌细胞中,检测到SOD、GPx、CAT水平的异常降低。本研究发现,高糖培养诱导下,心肌细胞脂质异常相关蛋白PPARα、CD36表达异常升高,GLUT4表达降低,ROS升高,而抗氧化SOD、GPx、CAT水平异常降低,提示高糖条件下脂质异常代谢,引起的ROS水平升高,抗氧化能力降低,可能是导致心肌细胞氧化应激损伤及凋亡的原因。阿昔莫司干预组显示出PPARα表达、脂质堆积及ROS蓄积的降低,和抗氧化SOD、GPx、CAT水平的升高,而Si-SOD可逆转阿昔莫司的上述作用,提示阿昔莫司降低高糖条件下心肌细胞凋亡及脂质堆积的可能作用为升高抗氧化酶表达来实现的。
综上所述,阿昔莫司能抑制PPARα活化,升高SOD、GPx、CAT抗氧化相关蛋白表达,缓解脂质堆积及氧化应激损伤,对高糖诱导条件下心肌细胞有保护作用。这可能为阿昔莫司在DCM领域的治疗提供一定参考。

