盐酸氨溴索基于AE-IPF TGF-β1/smads信号通路对大鼠气管黏膜的保护作用
乐文俊 梁新梅
特发性肺纤维化急性加重(acute exacerbation of idiopathic pulmonary fibrosis,AE-IPF)在特发性间质性肺炎中是一种常见的疾病,其发病原因较为复杂,且具有慢性、进行性及不可逆性发展,又被称为致死性肺疾病[1]。而支气管癌、肺栓塞是导致特发性肺间质纤维化患者主要的死亡原因[2]。有研究表明,转化生长因子-β1(transforming growth factor-β1,TGF-β1)是造成肺纤维化主要细胞因子,是纤维化进展及产生的主要原因之一[3]。同时TGF-β1下游果蝇抗生物皮肤生长因子蛋白家族(Smads)信号通路对大鼠肺纤维化进展影响较大[4]。盐酸氨溴索具有刺激肺泡Ⅱ型上皮细胞合成的作用,同时能够分泌肺表面活性物质,可促进上皮纤毛的再生,使纤毛功能的恢复,从而维持气管黏膜的分泌功能[5]。本文旨在研究盐酸氨溴索基于AE-IPF TGF-β1/smads信号通路对大鼠气管黏膜的保护作用。
1 材料与方法
1.1 实验动物 选取50只SPF级健康成年雄性大鼠,鼠龄7~9周,体重260~280 g,均由华南农业大学提供,生产许可:SCXK(粤)2019-0048。所有大鼠饲养在温度:20~24℃,相对湿度:60%,换气次数:10~15次/h,昼夜明暗交替时间:12/12 h,自由活动及饮食。
1.2 方法
1.2.1 AE-IPF模型建立:50只大鼠中随机选取10只为正常组,其余40只参考臧凝子等[6]报道的AE-IPF模型建立方法,具体操作:采用0.3 ml/100 g剂量的10%水合氯醛在大鼠腹腔注射麻醉,将大鼠以仰卧的方式放在鼠板上,固定大鼠的头与四肢且使其颈部暴露完全。使用剪刀剔除大鼠颈部毛发,并且采用碘伏对大鼠进行常规消毒,使用手术剪将大鼠颈部皮肤纵向剪开1 cm,随后采用镊子和止血钳逐层剥离大鼠的皮下组织,将大鼠气管暴露。根据大鼠的体重以0.2 ml/100 g的剂量,对实验大鼠气管内注入10 mg/ml博来霉素注射液,注射完毕后,左手直立持固定大鼠的鼠板且右手轻轻按住大鼠的身体,缓慢倾斜,左右摇晃3 min左右,使博来霉素迅速扩散到实验大鼠肺内,建造AE-IPF模型。
1.2.2 分组:造模成功后,随机分为模型组、盐酸氨溴索低、中、高剂量组,每组10只。次日,分别将盐酸氨溴索(盐酸氨溴索注射液,天津药物研究院药业有限责任公司,批准文号:国药准字H20041473)10、20、40 mg/kg对盐酸氨溴索低、中、高剂量组大鼠进行注射,随后对正常组和模型组大鼠注射等体积的0.9%氯化钠溶液,对各组大鼠均干预14 d。
1.2.3 病理学观察:所有大鼠麻醉后进行脱颈处死,随后剖取大鼠气管组织,采用3%的戊二醛和10%甲醛固定24 h,将其垂直在气道上进行取材,随后采用磷酸缓冲液进行冲洗,剪取气管后1/3腹侧段,经锇酸冲洗、固定、醋酸异戊酯置换及乙醇脱水、石蜡包埋后,制作5 μm气管组织进行HE染色。
1.2.4 支气管黏膜受损面积、平滑肌厚度:采用JSM-6510型扫描电镜(上海百贺仪器科技有限公司)对气管组织进行拍照,观察并记录支气管黏膜超微结构变化,采用Image-pro Plus 6,0图像分析系统计算支气管黏膜受损面积及大鼠支气管平滑肌厚度。
1.2.5 MMP-2、TIMP-1表达水平检测:采集大鼠右肺组织20 mg,加入210 μl 0.9%氯化钠溶液后,低温匀浆1 min进行离心,分离2次后,提取出上层匀浆液备用。采用ELISA法检测基质金属蛋白酶-2(matrix metalloprotease-2,MMP-2)、组织金属蛋白酶抑制因子-1(tissue inhibitorof metallo proteinase-1,TIMP-1)水平:采用碳酸盐包被缓冲液稀释标本,在聚苯乙烯板的反应孔中分别加入0.2 ml标本,5℃处理24 h,甩去孔内液体,浸泡2 min;加入0.2 ml稀释好的抗体,37℃处理24 h,随后加阴性和阳性对照血清;加入0.2 ml稀释的酶标抗体,37℃处理0.5 h;加入0.2 ml临时配制的TMB底物溶液,37℃处理15 min;加入2 mol/L硫酸0.05 ml终止液,放置在白色的背景下,阳性程度越强,颜色就越深,阴性为极浅或无色,颜色深浅以“+”、“-”来表示。
1.2.6 ZO-1、MRP1、TGF-β1、smads蛋白检测:取出大鼠右肺组织,采用细胞裂解液进行裂解,在4℃环境下进行离心处理,提取出上清液。采用Western-blotting法对紧密连接蛋白(Zonula occludens-1,ZO-1)、多药耐药相关蛋白1(multidrug resistance-associated protein 1,MRP1)、TGF-β1、smads蛋白水平进行检测,将缓冲溶液加入到组织裂解提取液中,在95℃下对其进行5 min灭活,对蛋白质采用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法进行分离,在印迹膜上放入电泳分离出的蛋白质,在室温中,将其放置到含量为5%的脱脂奶粉中进行封闭,2 h后,将相应蛋白以1∶500稀释后的一抗抗体和PVDF膜进行孵育;处理24 h,采用PBST洗涤液进行清洗,在室温下将1∶2 000稀释后的二抗抗体进行孵育;避光处理30 min,采用PBST洗涤液进行清洗,将PVDF膜和ELC增强的显色底物共同放置,1 min后,采用X射线对其进行曝光显影处理,应用Bio-Rad image分析系统对显影后图片进行查看,内部基准电压测量采用肌动蛋白抗体作为对照,重复实验4次并且进行系统性的分析,以GAPDH为内参。
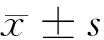
2 结果
2.1 5组大鼠气管组织病理学观察 正常组大鼠气管黏膜及气管平滑肌厚度正常;与正常组相比,模型组大鼠气管黏膜受损面积明显增加,气管平滑肌厚度加大;与模型组相比,盐酸氨溴索低、中、高剂量组大鼠气管黏膜受损面积明显减轻,气管平滑肌厚度减少,其中盐酸氨溴索高剂量组大鼠效果最为明显。见图1。

正常组模型组盐酸氨溴索低剂量组盐酸氨溴索中剂量组盐酸氨溴索高剂量组
2.2 5组大鼠气管黏膜受损面积、支气管平滑肌厚度比较 与正常组比较,模型组、盐酸氨溴索低、中、高剂量组支气管平滑肌厚度增加,差异有统计学意义(P<0.05)。与模型组比较,盐酸氨溴索低、中、高剂量组支气管黏膜受损面积、支气管平滑肌厚度减少,差异有统计学意义(P<0.05)。与盐酸氨溴索低剂量组比较,盐酸氨溴索中、高剂量组支气管黏膜受损面积、支气管平滑肌厚度减少,差异有统计学意义(P<0.05)。与盐酸氨溴索中剂量组比较,盐酸氨溴索高剂量组支气管黏膜受损面积、支气管平滑肌厚度减少,差异有统计学意义(P<0.05)。见表1。
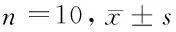
表1 5组大鼠支气管黏膜受损面积、支气管平滑肌厚度比较
2.3 5组大鼠MMP-2、TIMP-1水平比较 与正常组比较,模型组、盐酸氨溴索低、中、高剂量组MMP-2、TIMP-1水平升高,差异有统计学意义(P<0.05)。与模型组比较,盐酸氨溴索低、中、高剂量组MMP-2、TIMP-1蛋白水平降低,差异有统计学意义(P<0.05)。与盐酸氨溴索低剂量组比较,盐酸氨溴索中、高剂量组MMP-2、TIMP-1蛋白水平降低,差异有统计学意义(P<0.05)。与盐酸氨溴索中剂量组比较,盐酸氨溴索高剂量组MMP-2、TIMP-1蛋白水平降低,差异有统计学意义(P<0.05)。见表2。
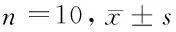
表2 5组大鼠MMP-2、TIMP-1水平比较
2.4 5组大鼠ZO-1、MRP1蛋白水平比较 与正常组比较,模型组、盐酸氨溴索低、中、高剂量组ZO-1、MRP1蛋白水平降低,差异有统计学意义(P<0.05)。与模型组比较,盐酸氨溴索低、中、高剂量组ZO-1、MRP1蛋白水平升高,差异有统计学意义(P<0.05)。与盐酸氨溴索低剂量组比较,盐酸氨溴索中、高剂量组ZO-1、MRP1蛋白水平升高,差异有统计学意义(P<0.05)。与盐酸氨溴索中剂量组比较,盐酸氨溴索高剂量组ZO-1、MRP1蛋白水平升高,差异有统计学意义(P<0.05)。见表3,图2。
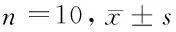
表3 5组大鼠ZO-1、MRPA蛋白比较
2.5 5组大鼠TGF-β1、smads蛋白水平比较 与正常组比较,模型组、盐酸氨溴索低、中、高剂量组TGF-β1、smads蛋白水平升高,差异有统计学意义(P<0.05)。

图2 5组大鼠ZO-1、MRPA蛋白水平比较(WB图);A 模型组;B 盐酸氨溴索低剂量组;C 盐酸氨溴索中剂量组;D 盐酸氨溴索高剂量组;E 正常组
与模型组比较,盐酸氨溴索低、中、高剂量组TGF-β1、smads蛋白水平降低,差异有统计学意义(P<0.05)。与盐酸氨溴索低剂量组比较,盐酸氨溴索中、高剂量组TGF-β1、smads蛋白水平降低,差异有统计学意义(P<0.05)。与盐酸氨溴索中剂量组比较,盐酸氨溴索高剂量组TGF-β1、smads蛋白水平降低,差异有统计学意义(P<0.05)。见表4,图3。
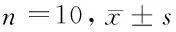
表4 5组大鼠TGF-β1、smads蛋白水平比较
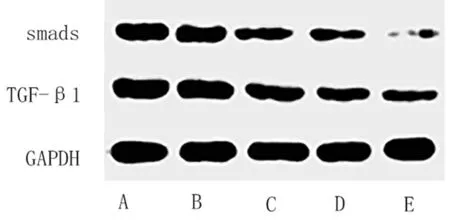
图3 5组大鼠TGF-β1、smads蛋白水平比较(WB图);A 模型组;B 盐酸氨溴索低剂量组;C 盐酸氨溴索中剂量组;D 盐酸氨溴索高剂量组;E 正常组
3 讨论
AE-IPF是一种纤维化性间质性肺炎的疾病,临床表现主要有顽固性干咳、发绀、劳力性呼吸困难,其作用机制不明确,是目前急需解决肺系疑难病症之一[7]。AE-IPF主要由于多因素造成的肺间质性疾病,其病理特征主要为细胞外基质沉积、成纤维细胞增殖、肺间质炎性细胞浸润、肺泡结构紊乱,导致大鼠出现肺功能发生进行性降低或呼吸衰竭[3,8]。
近年来,随着大气污染及环境恶化等,AE-IPF发病率呈现逐年升高,严重威胁人们的生命安全[9]。肺最基本的功能是呼吸,而空气中许多的异物颗粒及微生物会随着气体交换进出机体的呼吸道,呼吸系统与外界接触是最为频繁的,其中气管黏膜纤毛系统是呼吸系统最为重要的一道防御屏障[10]。本文研究显示,盐酸氨溴索能够减少AE-IPF大鼠支气管黏膜受损面积、支气管平滑肌厚度,有效改善大鼠呼吸功能,其中高浓度作用明显。其作用机制可能为:盐酸氨溴索主要是一种黏液溶解剂,其具有促进肺表面活性物质的合成、抗氧化、抗炎的作用,同时还具有与抗生素协同作用,防止肺不张及肺泡萎陷,进而协助无纤毛区痰液的运送,使黏膜纤毛的运动加速,维持上呼吸道自净的功效,阻碍有害因素的损伤,从而改善气管黏膜的正常分泌[11,12]。
目前有大量的研究发现,蛋白酶/抗蛋白酶的失衡以及蛋白酶活性增强是肺纤维化性主要发病因素[13]。MMP-2是一种弹性基质分解活性的酶类,具有降解肺泡壁的纤维黏连蛋白、层黏连蛋白、蛋白多糖、弹性纤维、胶原纤维等细胞外基质成分[14]。TIMPs是一种MMPs的内源性天然抑制因子,其与MMPs结合具有抑制其活性的作用,而TIMP-1在活性中是最强的一种,能够使细胞外基质沉积并抑制其降解,其是一种气道纤维化的标志,从而能够反映出气道修复重塑的过程[15]。本文研究发现,盐酸氨溴索能够降低AE-IPF大鼠MMP-2、TIMP-1水平,从而有效改善大鼠气道损伤,其中高浓度改善作用显著。
MRP1在肺支气管上皮中具有较强的表达,其主要作用于内源性代谢产物,可调节细胞内毒物、药物以及代谢产物浓度的作用,其主要通过作用于内源性代谢物,能够调节肺组织氧化应激,进而减少异物对机体损伤的作用[16]。此外,上皮连接功能丧失或者减弱是气道上皮损伤的主要原因之一,而ZO-1在上皮屏障功能中是一种重要细胞间连接蛋白,其能够构成紧密连接蛋白复合物,其在肺纤维化大鼠中表达下调[17]。本文研究表明,盐酸氨溴索能够升高AE-IPF大鼠ZO-1、MRP1蛋白水平,表明盐酸氨溴索通过调节ZO-1和MRP1表达能够对AE-IPF大鼠的发生发展过程起到保护作用,其中高浓度保护作用最为明显。
TGF-β1是导致机体纤维化关键细胞因子,细胞膜表面受体与TGF-β1进行结合,将其信号转导到细胞内,TGF-β1能够诱导Smad相关蛋白的磷酸化,Smads家族蛋白主要是从细胞膜中将信号转至细胞核中,而相关靶基因与进入细胞核内的信号进行转录调节,促进细胞的增殖与分化[18,19]。正常情况下,TGF-β1在细胞内主要以无活性存在,TGF-β1型信号传递或者表达需要对应信号转导路径实现,其中Smads路径具有重要的影响,Smads3、Smads4及Smads7是TGF-β1/smads信号转导路径内主要信号蛋白,共同调控肺纤维化[20]。本文研究结果显示,盐酸氨溴索能够降低AE-IPF大鼠TGF-β1、smads蛋白水平,从而抑制肺纤维化的发生,其中高浓度抑制效果最为显著。
综上所述,盐酸氨溴索能够减少AE-IPF大鼠支气管平滑肌厚度及支气管黏膜受损面积,通过降低MMP-2、TIMP-1水平,从而改善大鼠气管损伤,通过调控TGF-β1、smads信号通路蛋白水平,从而抑制模型大鼠肺纤维化的发生,进而对气管黏膜起到保护作用,呈现浓度依赖。

