人脂肪源性间充质干细胞修复放化疗所致胸腺损伤机制研究
张伟东 张伟威 党晓健 魏颖 王莉 李静 王娜
胸腺作为免疫系统的主要调控器官,功能状态直接决定机体细胞免疫功能,此外还有维持自身免疫、免疫调节及屏障保护等功能。胸腺本身也极易受到损害,众多引起胸腺衰老因素中,年龄是公认的主要因素,即“胸腺增龄性萎缩(age-related thymic involation)”[1]。但实际临床工作中放化疗药物通常被认为是损害胸腺最大因素,通过胸腺双阳性T细胞巨大杀伤性作用,使胸腺细胞大量死亡与空竭,这也是引起胸腺皮质及髓质结构的破坏,直接引起T细胞生存环境受损的主要因素[2]。最终引起免疫系统自我修复能力显著降低,最终引起此类患者感染及肿瘤复发率高于普通人群,甚至引发严重感染或二次肿瘤。脂肪源性间充质干细胞(adipose-derived stem cells,ADSCs)属干细胞家族,源于发育早期中胚层/外胚层,属多能干细胞,具备多分化潜能。ADSCs在全身脂肪组织均有分布,临床可通过吸脂手术获得,取材简便,创伤小。研究发现ADSCs因其多分化潜能生物特性广泛应用于临床治疗,如自体ADSCs软组织缺损修复,在心肌缺血及神经退行性病变治疗应用等[3]。既往不断有研究证实ADSCs对经放化疗照射小鼠胸腺上皮细胞有再生修复增殖作用[4],但迄今缺乏相关机制报道及体外人体细胞模型相关研究。因此,本研究基于ADSCs生物学特性及既往临床应用研究基础,以人脂肪源ADSCs作为体外细胞研究模型,观察其对化疗损伤后胸腺上皮细胞增殖修复作用并对其进行机制探讨,为临床应用提供科学理论指导。
1 材料与方法
1.1 材料
1.1.1 细胞标本来源:提取细胞脂肪组织由我院普外科手术切除废弃脂肪组织提供,用含硫酸庆大霉素0.9%氯化钠溶液充分冲洗切除组织后放置PBS液中,于 30 min内送至实验室。入选供体均知情同意并签署知情同意书,获得医院伦理委员会批准。小鼠胸腺上皮细胞源于北京大学医学部免疫教研室赠送。
1.1.2 主要仪器与试剂:①仪器:恒温饱和湿度CO2培养箱(赛默飞世尔科技有限公司),酶标仪(美国伯乐公司),Rotor-Gene QPCR仪(德国凯杰公司),荧光倒置显微镜(BX51,日本Olympus公司),流式细胞仪(美国BD公司),旋涡离心机(北京医疗设备厂),MUSE 细胞分析仪(德国 Merk Millipore公司),Megafuge 离心机(美国Thermo Scientific公司)。②实验试剂:OPTI-MEM培养基/胎牛血清/胰蛋白酶/P/S双抗(GIBCO公司),PE anti-human CD34/FITC anti-human CD44(美国eBioscience 公司),细胞凋亡检测试剂盒/细胞周期检测试剂盒(德国Merk Millipore 公司),兔抗人GADPH多克隆抗体(康成生物工程公司),辣根过氧化物酶标记羊抗兔LgG (北京康为世纪生物科技有限公司),Real Master Mix (SYBR Green)(北京TIANGEN 公司)。
1.2 实验方法
1.2.1 人脂肪源间充质干细胞分离、培养、鉴定:将脂肪组织放入无菌培养皿中,取出筋膜及血管。以剪刀将脂肪组织剪碎约1 mm3将其放入100 ml离心管中,25~35 ml/管,并加入Ⅰ型胶原酶并封闭处理。37℃水浴、离心、消化、离心、弃去上清,加入含15%胎牛血清培养基转移至25 ml无菌培养瓶中,于37℃含有5% CO2的培养箱中培养。3 d后首次换液,以后2~3 d 换1次液。细胞贴壁80%~90%瓶底进行细胞传代(1∶2传代)。取生长状态良好第3代细胞进行消化离心,监测细胞密度并计数,调整至1×106个/ml,分装至EP管,并加入CD44、CD34抗体孵育,用PBS缓冲液冲洗3次,弃上清,重悬,流式细胞仪检测细胞表面分子,EXP032.V.1.2软件分析。
1.2.2 siRNA 序列设计:美国国立数据库(NCBI)查询KGF序列。siRNA序列设计遵循序列大小19~21 nt,GC 含量在40%~60%;避免可能形成二级结构的区域;从转录本AUG起始密码子开始,搜寻下游AA序列,记录跟每个AA3’端相邻的 19 个核苷酸作为候选的 si RNA 靶位点等原则,使用BLAST进行序列同源性分析,排除和其他编码序列同源的序列,根据以上原则及Ambion公司siRNA target Designer 设计软件,经BLAST 对比后,提交序列给广东瑞博公司分别合成靶向 KGF 基因的KGF-si RNA NC-si RNA及荧光标记的 NC-si RNA。
1.2.3 siRNA 转染、筛选最佳KGF-siRNA浓度:选取对数生长人脂肪源ADSCs细胞,PBS反复冲洗,胰酶消化将细胞数控制在1×105个/ml,取2ml接种至6孔板放入37℃、5% CO2的培养箱中培养,分别制备AB液并室温下孵育30 min加入对应6孔板中,37℃、5% CO2的培养箱中培养4~6 h后吸出上清液,更换为DMEM培养基2 ml,放回培养箱中以RT-PCR检测细胞mRNA表达。KGF-siRNA浓度分组:20 μmol/L、30 μmol/L、50 μmol/L及100 μmol/L。
1.2.4 成脂诱导并增殖曲线分析:选取第3代人脂肪源ADSCs,以胰蛋白酶消化接种至6孔板中,细胞浓度1×105个/孔,37℃、5% CO2的培养箱中培养过夜。贴壁后将培养基更换为成脂细胞诱导培养基,换液培养2周后将细胞进行油红O染色证实细胞中是否有脂滴形成。
1.2.5 FITC-Brdu测定人脂肪源性间充质干细胞增殖实验:将人脂肪源ADSCs分为脂肪干细胞沉默组、脂肪干细胞未沉默组及单纯胸腺上皮增殖组。将3组细胞种植于Transwell小室下层,12 h后可以看到脂肪干细胞基本完全贴壁,将人的胸腺上皮细胞种植与小室的上层,将小室放于培养箱培内培养,测定胸腺上皮细胞增殖情况(主要测第1、2、3天)。
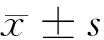
2 结果
2.1 人脂肪源间充质干细胞培养、鉴定 将从脂肪组织分离出来的人脂肪源间充质干细胞种植于培养瓶内,显微镜下观察到大量脂滴,可见少量红细胞或成纤维细胞,接种48 h后细胞贴壁生长可呈棒槌状,部分细胞呈细长形似纤维状,72 h后细胞逐渐分离、融合成单层成簇分布。应用ADSCs表面抗原测定提示表面抗原CD44阳性率93.0%,CD34呈0.405%,确定为ADSCs细胞。见图1、2。
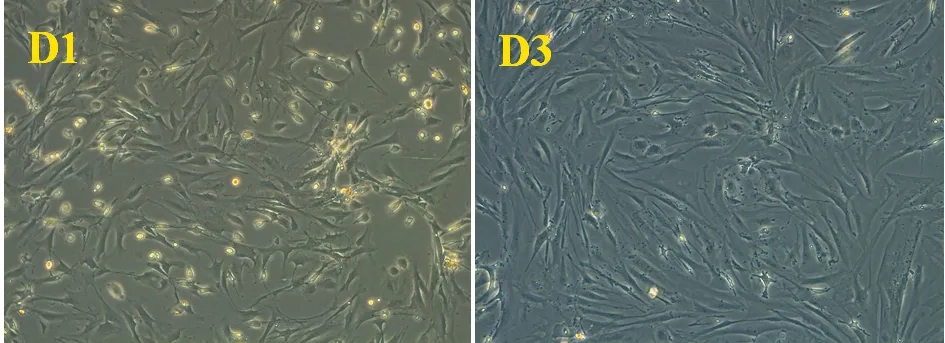
图1 ADSCs种植第1天及第3天
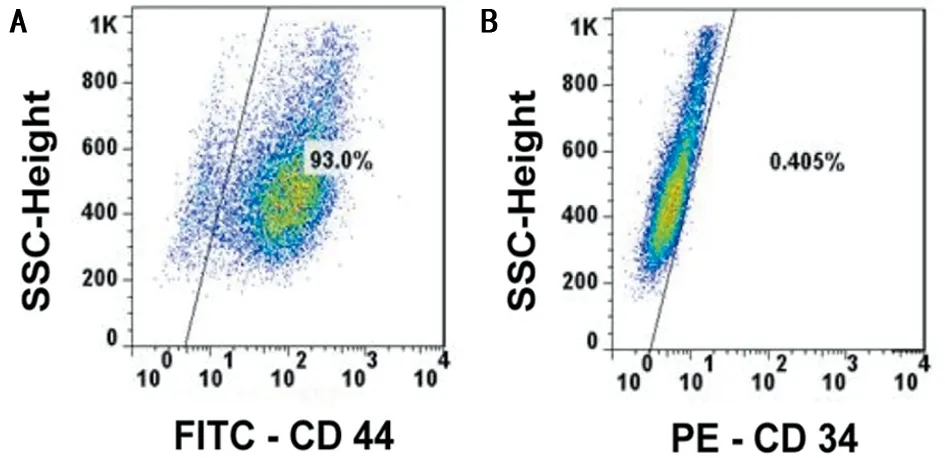
图2 ADSCs 流式细胞图;A CD44;B CD34
2.2 KGF-siRNA 转染、浓度筛选、下游蛋白表达
2.2.1 KGF-si RNA转染、浓度筛选:RT-PCR比较 KGF-siRNA转染ADSCs后KGF表达,证实KGF-siRNA-2转染ADSCs中KGF表达下降了81.88%,干扰效果明显且与KGF-siRNA-1,空质粒组及未转染组比较存在显著差异(P<0.001)。KGF-siRNA-2分0.1 μg,0.3 μg,0.5 μg,1.0 μg浓度进行人脂肪源性间充质干细胞转染筛选最佳浓度,mRNA水平依次下降33.22%,46.60%,81.06%,42.35%,结果提示0.5 μg为KGF-siRNA最佳转染浓度,且差异有统计学意义(P<0.001)。见表1、2。

表1 筛选KGF-siRNA沉默质粒最佳序列浓度 %
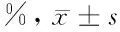
表2 KGF-siRNA-2作用最佳浓度筛选比较
2.2.2 KGF-si RN-2转染对下游蛋白表达影响:KGF-siRNA 0.5 μg转染48 h/72 h,比较沉默组、空白组及空质粒组下游蛋白表达差异。结果提示沉默组下游蛋白表达明显低于空白对照及空质粒组,差异有统计学意义(P<0.05)。见表3,图3。

表3 不同时间、KGF-siRNA转染前后下游蛋白表达比较
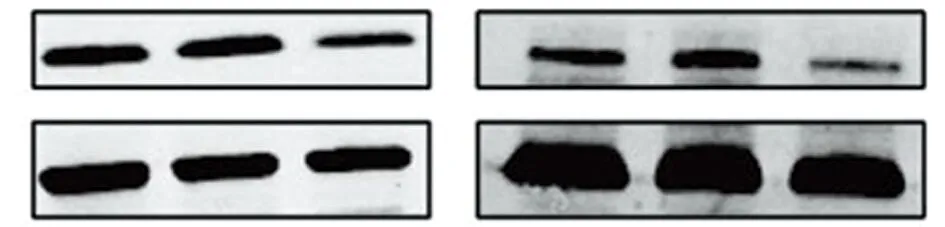
图3 KGF-siRNA 0.5 μg转染48、72 h,沉默组、空白组及空质粒组下游蛋白表达
2.3 人脂肪源性间充质干细胞对胸腺修复增殖影响
2.3.1 人脂肪源性间充质干细胞分化潜能测定:经成脂诱导6 d后,通过倒置显微镜发现少量细胞胞浆且有圆形小颗粒,细胞形态由梭形变为圆形,且脂滴逐渐增多。诱导12 d后细胞体积内充满圆形脂滴,应用油红O染色可见细胞内存在红色脂滴颗粒,对照组细胞形态仍呈梭形且胞质内无脂滴。结果提示人脂肪源性间充质干细胞具备分化潜能,应用Brdu测试KGF-siRNA干扰沉默后脂肪干细胞增殖情况,证实1~3 d内增殖79.3%、93.7%、99.5%。
2.3.2 人胸腺上皮细胞增殖情况:应用Brdu法测定沉默组、对照组及单纯细胞组情况。证实对照组增殖显著高于沉默组及细胞组,差异有统计学意义(P<0.001)。见表4。
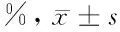
表4 人胸腺上皮细胞增殖情况的测定
2.3.3 小鼠胸腺上皮细胞增殖情况:应用Brdu法测定沉默组、对照组及单纯细胞组情况。证实对照组增殖显著高于沉默组及细胞组增殖,差异有统计学意义(P<0.001)。见表5。
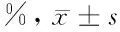
表5 小鼠胸腺上皮细胞增殖情况
2.4 胸腺上皮细胞增殖S期测定分析
2.4.1 人胸腺上皮细胞增殖S期测定分析:PI法测定3 d内人胸腺上皮细胞增殖S期细胞增殖情况。证实对照组增殖显著高于沉默组及细胞组,差异有统计学意义(P<0.05)。见表6。
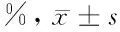
表6 人胸腺上皮细胞增殖S期测定
2.4.2 小鼠胸腺上皮细胞增殖S期测定分析:PI法测定3 d内小鼠胸腺上皮细胞增殖S期细胞增殖情况。证实对照组增殖显著高于沉默组及细胞组增殖,差异有统计学意义(P<0.05)。见表7。
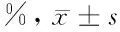
表7 小鼠胸腺上皮细胞增殖S期测定
3 讨论
20世纪初通过体外培养ADSCs首次证实其可分泌一系列生长因子进入培养基,形成ADSCs条件培养基促进组织细胞增殖[5]。目前已报道分泌细胞因子主要有碱性成纤维细胞生长因子、角质生长因子(KGF)、转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)等[5-7]。作为公认多分化潜能干细胞,可定向分化为中胚层各种细胞,已报道的有脂肪细胞、成骨细胞、成软骨细胞、骨骼肌细胞及心肌细胞[8]。有研究指出并证实放化疗损伤胸腺损伤小鼠模型通过体外输注ADSCs达到快速修复胸腺结构与功能作用,从而改善了放化疗后小鼠免疫能力及感染发生率,延长了小鼠生存时间[9,10]。但相关机制研究及体外研究报道甚少。
人脂肪源性间充质干细胞(human adipose derived mesenchymal stem cells,hAD-MSC)多以人脂肪组织为供体,有着与ADSCs相似的多分化潜能、自我更新及高度繁殖的生物学特性[11]。同时hAD-MSC取材损害小、来源丰富、方便取材、活性持久。为保障实验细胞系含量及纯度,我们以CD34及CD44 分子进行表面抗体鉴定[12],为机制探讨奠定研究基础。成脂诱导6 d、14 d后,倒置显微镜下可见细胞体积内可见逐渐充满圆形脂滴,油红O染色体印证为红色脂肪颗粒,证实hAD-MSC具备良好分化潜能。
角质生长因子是既往报道ADSCs旁分泌修复机制中主要分子,因属成纤维母细胞生长因子家族(FGFs),也称为成纤维细胞生长因子-7(fibroblast growth factor 7,FGF-7),本身有促进小鼠角质细胞有丝分裂作用[13]。KGF在胃肠、口腔黏膜、胸腺、肺、肾、膀胱、肝等器官损伤修复过程中起到重要作用[14]。KGF与KGFR信号途径在胸腺间质-上皮相互联系作用提示KGF在胸腺细胞发育及成熟过程有重要作用[15]。即胚胎期KGF受体缺失小鼠因TEC缺乏增殖及分化能力而出现明显胸腺生成障碍,伴胸腺细胞数量下降;与KGF受体缺失不同,KGF缺失小鼠表现正常胸腺发育正常,但经照射后KGF缺失小鼠表现胸腺恢复能力下降,提示KGF是生后小鼠胸腺再生必须因素[16]。同时,KGF对胸腺增殖修复功能在老龄鼠萎缩胸腺中也得到证实,并发现有促进成熟T细胞向外周免疫器官输出的功能[17]。我们发现众多证实KGF促进胸腺上皮增殖修复功能机制研究中,多以在小鼠/大鼠作为在体研究模型,体外细胞模型研究较少[18]。本研究在KGF-siRNA成功转染后,依次从RNA及下游蛋白表达证实经小RNA转染人脂肪源性间充质干细胞KGF表达明显低于空白对照组及空质粒组,且具备统计学意义,而空白对照组及空质粒组间无统计学意义。同样,小RNA沉默处理细胞下游蛋白水平表达同RNA水平表达变化一致,即低于空白对照组及空质粒组,具有统计学意义。
在众多KGF参与胸腺上皮细胞修复机制报道中,KGF与其表达于TEC细胞上KGF受体结合促进胸腺上皮增殖,同时这种受体-配体结合激活下游众多信号转导通路,信号转导通路的激活对胸腺上皮增生、分化及发挥生理效应极为重要[19-21]。本研究证实hAD-MSC通过KGF完成对放化疗损伤胸腺萎缩细胞增殖。
综上所述,我们充分证实hAD-MSC对萎缩胸腺上皮细胞有修复作用,通过KGF-siRNA瞬时转染,发现其可简便、快速、准确进行hAD-MSC修复萎缩胸腺机制研究,该机制研究及明确为促进hAD-MSC应用于临床治疗,尽早改善放化疗因素引起的患者萎缩细胞修复并改善免疫功能有重要临床意义。

