和肝汤对功能性消化不良大鼠十二指肠微炎症的影响
赵静怡,郑金粟,曹 锐
(首都医科大学附属北京朝阳医院中医科,北京 100020;*通讯作者,E-mail:caorui@vip.sina.com)
功能性消化不良(functional dyspepsia,FD)以餐后腹胀、腹痛、早饱等为主要症状表现,是临床的常见病[1]。FD的发病机制错综复杂,胃动力异常、内脏敏感性升高、十二指肠微炎症状态皆为其主要病理改变[2,3]。FD十二指肠微炎症主要表现为肥大细胞、嗜酸性粒细胞等炎症细胞以及炎症因子在局部的异常表达[4-6],并进而影响胃肠运动和感觉功能[7]。现有常规西医治疗手段主要包括抑胃酸、促动力等[2],近年胆碱酯酶抑制剂、5-HT1A激动剂、神经调节剂等逐步用于FD的治疗[3],但其有效性和安全性仍欠满意。
中医药治疗FD具有良好的疗效[8]。国医大师方和谦教授从自身重视“调理肝脾”的学术思想出发,在经方逍遥散的基础上创制经验名方和肝汤[9]。本方治疗FD效果显著,在改善临床总有效率、单项症状和降低复发率方面均优于促动力药对照组[10]。然而,和肝汤是否能够改善FD十二指肠微炎症及其机制仍需进一步研究。
既往和前期研究发现,FD十二指肠局部炎症相关因子和肥大细胞表达异常,而中药干预可减轻其局部微炎症水平[11,12],但具体的分子生物学作用机制仍有待进一步深入研究。为了初步挖掘中药和肝汤的治疗靶点,本研究推测和肝汤的作用机制可能与缓解微炎症状态相关,并通过动物实验验证和肝汤是否通过调节炎症因子和炎症细胞表达,减轻十二指肠微炎症状态,进而对FD产生治疗作用。
1 材料和方法
1.1 材料
1.1.1 实验动物 18只6周龄雄性SPF级SD大鼠,体质量(200±20)g,购自北京维通利华生物技术有限公司,动物生产许可证号:SCXK(京)2021-0006。动物使用许可证号:SYXK(京)2020-0050。所有动物饲养于北京迈德康纳生物技术有限公司SPF动物房。动物饲养条件:温度(22±1)℃,湿度50%~60%,光照/黑暗(12 h/12 h),所有动物均可自由进食、饮水。本动物实验获得首都医科大学动物伦理委员会许可(伦理编号:AEEI-2021-238)。
1.1.2 药物 和肝汤由当归12 g、白芍12 g、党参9 g、白术9 g、茯苓9 g、柴胡9 g、薄荷3 g、苏梗9 g、香附9 g、生姜3 g、大枣4枚/12 g、炙甘草6 g共12味中药组成。选用目前公认的临床等效剂量为和肝汤的大鼠干预剂量,和肝汤中药饮片生药共计102 g,计算临床等效剂量为0.918 g生药质量/100 g大鼠体质量,于江阴天江药业制备和肝汤颗粒剂,每2袋颗粒含102 g生药,研磨后加入111 ml生理盐水充分溶化,灌胃剂生药浓度为0.918 g/ml。
1.1.3 试剂和仪器 主要试剂:大鼠白细胞介素10(IL-10)ELISA试剂盒,泉州市睿信生物科技有限公司(货号:RX302880R);大鼠白细胞介素12(IL-12)ELISA试剂盒,泉州市睿信生物科技有限公司(货号:RX302878R);苏木精伊红(HE)染色试剂盒,北京索莱宝科技有限公司(货号:G1120);甲苯胺蓝染色试剂,北京索莱宝科技有限公司(货号:G3661)。
主要仪器:酶标仪(型号:RT-6100),美国Rayto公司;高速冷冻离心机(型号:TGL16M),湖南湘仪离心机仪器有限公司;电热恒温培养箱(型号:DHP-9012),武汉一恒苏净科学仪器有限公司;脱水机,武汉俊杰电子有限公司(JJ-12J);包埋机(型号:JB-P5),武汉俊杰电子有限公司;病理切片机(型号:RM2016),上海徕卡仪器有限公司;正置光学显微镜(型号:Nikon Eclipse ci),日本尼康;显微成像系统(型号:NIKON DS-U3),日本尼康。
1.2 分组与干预
将18只大鼠随机分为对照组、模型组、中药组共3组,每组6只。采用夹尾应激法[13]建立FD大鼠模型,每组5只大鼠同笼,模型组和中药组大鼠用长海绵钳夹大鼠尾巴远端1/3处,以不破皮为度,令其暴怒,寻衅与其他大鼠撕打,以激怒全笼大鼠。每次刺激持续30 min。随着打斗的加剧,大鼠可能被抓伤,为避免炎症干扰,用0.15%碘伏涂擦受伤部位控制感染。每4 h刺激1次,每日3次,连续刺激7 d。造模结束后,中药组给予和肝汤颗粒灌胃,每102 g生药的免煎颗粒研磨后稀释为111 ml液体汤剂,使其充分溶解,灌胃量为1 ml/100 g体质量,为临床等效剂量正常组和模型组给予等容积生理盐水灌胃,每日1次,连续灌胃7 d。中药组及模型组在灌胃期间继续予以夹尾,防止模型自发恢复。
1.3 一般指标检测
①体质量:在第0天(造模开始前)、第7天(造模结束后)、第14天(干预结束后取材当天)分别测量各组大鼠的体质量。
②3 h摄食量检测:第14天检测大鼠3 h摄食量,检测前禁食12 h,不禁水,检测时给予每只大鼠鼠粮15 g,3 h后称重并记录剩余鼠粮,按公式计算大鼠3 h进食量:3 h进食量(g)=15 g-剩余鼠粮(g)。
③疼痛阈值评估:在造模干预结束后对各组大鼠进行疼痛阈值评估,以体现大鼠内脏高敏程度。参照浙江大学实验动物中心的大鼠疼痛评估方法指南[14],对大鼠的体质量、摄食、外观、临床症状、社会化行为和刺激反应进行评价、记录和计分,根据评估指南中涉及的疼痛症状的轻中重等级分别记1分、2分、3分,无相应疼痛表现则记为0分,大鼠疼痛阈值的计算公式为:疼痛阈值=1-疼痛得分/总分。
1.4 实验室检测指标
1.4.1 取材 预先禁食不禁水24 h。于第14天进行取材,予1%戊巴比妥钠(80 mg/kg)腹腔注射麻醉,后逐层剪开皮肤、肌肉、暴露腹腔脏器,剪取大鼠十二指肠组织,十二指肠取位于幽门下0.5 cm后约3~4 cm的组织,分别进行如下处理:用于HE染色的胃和十二指肠组织置于4%多聚甲醛中固定,后续用石蜡包埋制作石蜡切片;用于ELISA检测的十二指肠组织置于冻存管迅速放入液氮中保存。
1.4.2 HE染色观察大鼠十二指肠形态 取各组大鼠十二指肠组织,石蜡包埋后制备组织切片,厚度5~7 μm。脱蜡、修复抗原后进行HE染色,具体步骤如下:苏木精液染色5 min,流水稍洗去苏木精液1~3 s,1%盐酸乙醇1~3 s,稍水洗10~30 s,蒸馏水洗1~2 s,0.5%伊红液染色1~3 min,蒸馏水洗1~2 s。脱水透明、封片后显微镜下观察拍照。
1.4.3 甲苯胺蓝染色观察十二指肠肥大细胞 取各组大鼠十二指肠组织,石蜡包埋后制备组织切片,厚度4 μm。脱蜡、修复抗原后进行甲苯胺蓝染色,具体步骤如下:甲苯胺蓝染色液(甲苯胺蓝0.5 g+蒸馏水100 ml)处理10 min,蒸馏水洗净,冰醋酸分化液(冰醋酸0.5 ml+蒸馏水100 ml)处理30 s左右,显微镜下观察至颗粒清晰为止,蒸馏水洗净。脱水透明、封片后显微镜下观察拍照。
1.4.4 ELISA法检测十二指肠抗炎因子和促炎因子含量 ELISA法分别检测十二指肠的促炎细胞因子IL-12和抗炎细胞因子IL-10的表达水平。将大鼠十二指肠组织迅速剪碎研磨后离心,离心力:10 000g,离心半径(R):8.5 cm,转速:10 444 r/min,时间10 min,取上清液。配置梯度浓度的标准品,用于制作标准曲线。将待检样品、标准品加入相应的96孔板中,37 ℃孵育1 h,移除封板膜,于洗涤机中洗涤5次。加入HRP标记的IL-12、IL-10抗体,37 ℃避光孵育30 min后洗涤,之后依次加入显色底物和终止液,在10 min内于酶标仪读取标准品、样品的吸光值,据标准品浓度和OD值做标准曲线,据标准曲线方程计算出样本浓度(pg/g)。
1.5 统计方法
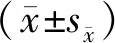
2 结果
2.1 和肝汤对FD大鼠体质量的影响
结果显示,造模开始前(第0天)各组大鼠的体质量基本一致,差异无统计学意义(P>0.05);造模结束后(第7天),中药组、模型组大鼠体质量较正常组大鼠显著减轻,差异有统计学意义(P<0.01),且中药组和模型组大鼠体质量基本一致,差异无统计学意义(P>0.05);干预结束后(第14天),模型组大鼠体质量仍较正常组显著减轻,差异有统计学意义(P<0.01),而中药组大鼠体质量较模型组增加,差异有统计学意义(P<0.05,见表1)。

表1 各组大鼠体质量变化比较 (n=6,g)
2.2 和肝汤对FD大鼠3 h摄食量的影响
3 h摄食量结果显示,模型组大鼠3 h摄食量较正常组大鼠显著减低(P<0.01);而经过和肝汤治疗后,大鼠摄食量能力部分恢复,中药组大鼠3 h摄食量高于模型组(P<0.01,见表2)。

表2 各组大鼠3 h摄食量和疼痛阈值评分
2.3 和肝汤对FD大鼠疼痛阈值的影响
疼痛阈值结果显示:模型组大鼠疼痛阈值显著低于正常组大鼠(P<0.01);而经过健脾理气方治疗后,大鼠疼痛情况改善,中药组大鼠疼痛阈值高于模型组(P<0.01,见表2)。
2.4 各组大鼠十二指肠组织形态
HE染色结果显示:各组大鼠十二指肠组织均结构完整,形态清晰,细胞排列整齐,无明显损伤病变表现(见图1)。这一结果亦符合FD不存在显著器质性病变的传统定义。

图1 各组大鼠十二指肠组织形态结构 (HE染色,×20)Figure 1 Duodenal tissue morphology of rats in each group (HE staining, ×20)
2.5 和肝汤对FD大鼠十二指肠肥大细胞聚集的影响
甲苯胺蓝染色结果显示,镜下观察正常组大鼠十二指肠的固有层有少量蓝紫色阳性着色反应;模型组大鼠十二指肠固有层蓝紫色阳性着色更为显著,呈强阳性反应;中药组大鼠十二指肠固有层的阳性反应程度较模型组减弱,与正常组基本一致(见图2)。
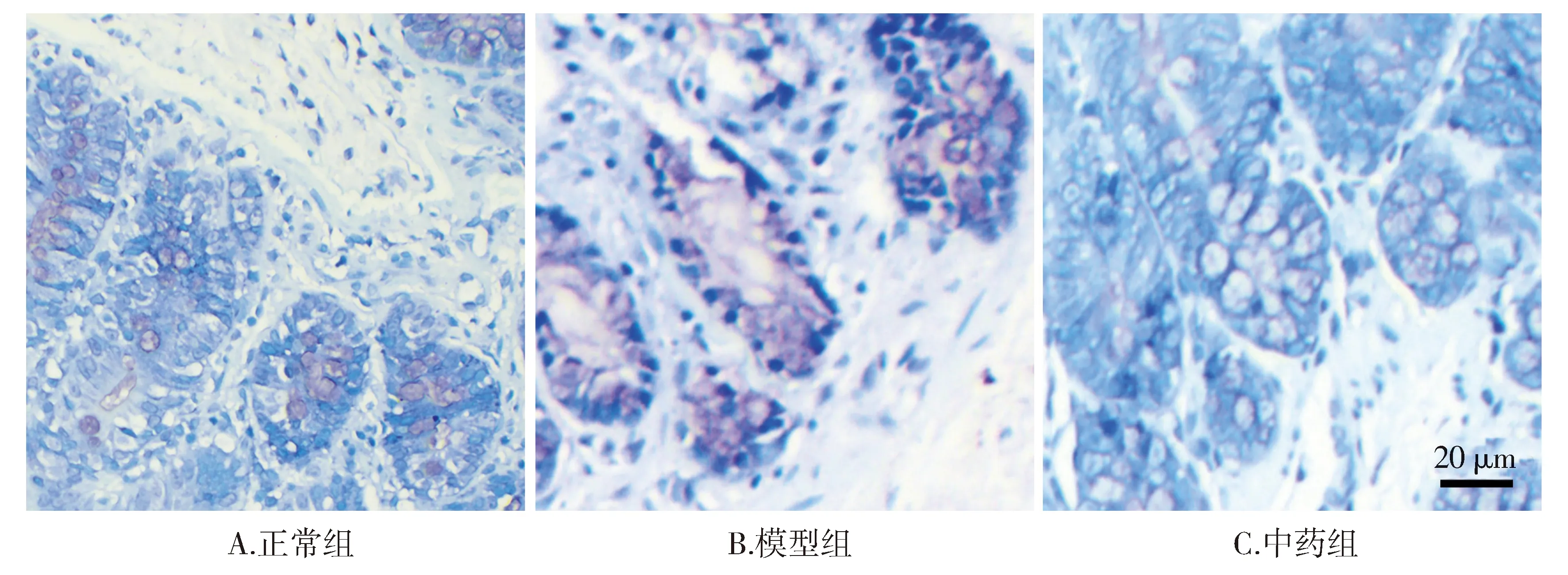
图2 各组大鼠十二指肠肥大细胞聚集情况 (甲苯胺蓝染色,×40)Figure 2 Duodenal mast cell aggregation of rats in each group (toluidine blue staining, ×40)
2.6 和肝汤对FD大鼠十二指肠炎症因子和抗炎因子表达水平的影响
ELISA结果显示,模型组大鼠十二指肠炎症细胞因子IL-12表达水平较正常组显著升高(P<0.01),经和肝汤颗粒治疗后,中药组大鼠十二指肠IL-12表达减少(P<0.01);与此同时,模型组大鼠十二指肠抗炎细胞因子IL-10表达水平较正常组增多,经和肝汤颗粒治疗后,中药组大鼠十二指肠抗炎因子IL-10水平进一步增加,差异均具有统计学意义(P<0.01,见表3)。

表3 各组大鼠十二指肠促炎因子IL-12和抗炎因子IL-10表达水平 (pg/g)
3 讨论
2016年发布的关于功能性胃肠病的罗马Ⅳ标准中将“十二指肠微炎症(duodenal low-grade inflammation)”这一概念列为功能性消化不良的病理改变之一,并提出十二指肠嗜酸粒细胞聚集是十二指肠微炎症的典型病理表现[2]。研究显示,FD患者十二指肠局部炎症细胞和炎症因子的聚集活化与黏膜下层神经及神经节的功能及结构变化相关,故目前认为十二指肠微炎症可能是脑-肠轴功能异常的驱动因素,而十二指肠可能是引起动力感觉异常的胃肠功能调控中心[5,6,15,16]。IL-12、IL-10分别为已知的机体关键促炎因子和抗炎因子,在多种以免疫失衡为主要发病机制的消化系统疾病中扮演了关键角色。在FD十二指肠局部微炎症的形成过程中,炎症细胞因子的表达是否存在失衡以及其背后的分子生物学机制仍有待明确。因此,本研究从十二指肠微炎症入手,以促炎细胞因子IL-12、抗炎细胞因子IL-10为关键靶标,探究和肝汤对FD的作用机制是否与调节炎症因子表达,进而减轻十二指肠微炎症状态有关。
研究结果显示:夹尾应激造模的FD大鼠体质量减轻,摄食量减少,疼痛阈值降低,而和肝汤颗粒可以显著改善FD大鼠的体质量和摄食量,部分缓解大鼠疼痛症状,提高疼痛阈值评分;此次,夹尾应激的FD大鼠十二指肠存在低程度炎症,其肥大细胞在十二指肠固有层聚集,促炎细胞因子IL-12的表达增多,处于炎症反应的轻度异常状态,与此同时抗炎因子IL-10表达亦增多,推测因机体存在抗炎与促炎之间的免疫协调反馈,这可能有助于使十二指肠局部炎症维持在低程度的病理状态;而和肝汤颗粒减少肥大细胞在局部的分布,下调十二指肠炎症细胞因子IL-12的含量,同时促进抗炎因子IL-10的表达,调整局部的免疫炎症程度,发挥对十二指肠黏膜的保护作用。FD十二指肠局部炎症因子和炎性细胞表达增多,刺激抗炎因子合成分泌增加,IL-10的表达量相对增多;而和肝汤治疗后抗炎因子IL-10较模型组进一步增多,提示和肝汤可能在十二指肠发挥了炎症水平调节作用,其促进抗炎因子IL-10进一步合成分泌,以抑制局部的炎症反应,体现了其多靶点、双向调节的优势作用。
现代中医根据FD患者的临床症状,将其归属于痞满、胃脘痛等病范畴,并认为其病位在胃,与肝脾密切相关,而肝脾失调是病机的关键环节[8]。因此,从肝脾论治是中医治疗FD的核心思路,调肝理脾是其基本治法。国医大师方和谦教授从自身重视调理肝脾的学术思想出发,基于经方逍遥散创制了经验名方和肝汤[9]。和肝汤中当归、白芍为君以养血柔肝,柴胡、薄荷、苏梗、香附为臣以疏肝解郁、行气宽中,党参、茯苓、白术、生姜、大枣为佐以健脾益气和胃,为仲景所谓“见肝之病,知肝传脾,当先实脾”;以甘草为使以甘缓和中、调和诸药。全方在逍遥散疏肝解郁、健脾和营的基础上加重了培土和中之效,用于治疗以肝脾失调为病机关键的FD具有较强的优势,临床应用亦屡获良效[10],值得推广和进一步深入研究。
综上所述,本研究显示:FD大鼠十二指肠固有层肥大细胞聚集,促炎细胞因子IL-12和抗炎细胞因子IL-10表达异常,这可能与十二指肠微炎症状态的形成有关;而和肝汤颗粒可以减少肥大细胞在十二指肠局部的分布,调整炎症细胞因子表达水平,进而减轻十二指肠微炎症状态,这可能是和肝汤治疗FD的作用机制之一。

