血浆-凝血酶法制备液基细胞学剩余标本细胞蜡块在恶性肿瘤病理诊断中的应用
贺 妍,吉晓霞,李晓娟,栾中华,余红梅
(1山西医科大学卫生统计学教研室,太原 030001;2山西省运城市中心医院病理科;*通讯作者,E-mail:yu@sxmu.edu.cn)
细胞蜡块(cell block, CB)是指从细胞学标本(浆膜腔积液、细针穿刺等)中收集沉淀物、血凝块或肉眼可见的组织块,这些组织块被加工成石蜡块,通常用苏木精-伊红染色(HE染色)[1]。目前,细胞蜡块已经广泛用于细胞学诊断工作中,是细胞学的重要组成部分,主要用于肿瘤的溯源和分类[2]。在细胞学标本量足够、恶性肿瘤细胞量充足的情况下,本实验室通常采用离心沉淀法制备细胞蜡块。实际工作中偶尔会遇见一些极端情况,由于各种原因(如肿瘤患者高龄、恶液质等)无法获取足量细胞学标本,患者更不可能耐受活检等创伤更大的检查。有限的标本完成液基细胞学制片后,剩余标本不能通过直接离心包埋成蜡块,导致后续对肿瘤定性分型、指导治疗相关检查(如免疫细胞化学、分子检测等)无法开展。因此,针对量少细胞学标本,迫切需要寻找一种实用的细胞蜡块制备方法。针对此种情况,本实验室将液基细胞学与血浆-凝血酶法结合起来,探寻出一种简单快速、成本低且制片效果良好,同时能满足后续相关检查保证精准诊断的细胞蜡块制备法。此种方法可避免病人重复有创性检查的痛苦,实现标本利用最大化,经实践证明,在恶性肿瘤的诊疗中发挥积极作用。
1 材料与方法
1.1 标本收集
收集运城市中心医院病理科2021年1—7月液基细胞学制片后剩余标本87例。其中包括浆膜腔积液24例,肺泡灌洗液21例,甲状腺细针穿刺16例,腹腔冲洗液15例,尿液8例,痰液3例。
1.2 主要试剂
PreservCyt®细胞清洗液(新柏氏公司细胞清洗液,用于去除体液标本中红细胞、黏液等);PreservCyt®细胞保存液(新柏氏公司细胞保存液,用于体液标本离心后细胞长期保存);凝血酶时间(TT)测定试剂盒(上海太阳生物技术有限公司、8/10×2.5 ml规格);新鲜冰冻血浆(来源于无偿献血枸橼酸钠抗凝新鲜血浆);4%中性缓冲福尔马林;免疫细胞化学试剂CK7、TTF-1、p63等一抗抗体购于福州迈新生物技术有限公司;二抗抗体购于中杉金桥公司(Ultra PATH Plus DAB染色液)。
1.3 主要材料
20 ml离心管、一次性滴管、塑料包埋盒。
1.4 主要仪器
高速离心机、脱水机、包埋机、切片机、自动染色机。免疫细胞化学采用中杉金桥Ultra PATH自动免疫组织化学染色机(设备型号:Ultra 60)。
1.5 方法
本试验采用双盲法,即技术员和诊断医师均不知晓标本液基细胞学诊断结果。
1.5.1 血浆-凝血酶法细胞蜡块制备 制备细胞蜡块操作如下:①凝血酶试剂配置:按试剂盒说明书要求,每瓶凝血酶冻干粉加入2.5 ml缓冲液,静置5~10 min,轻摇溶解。②将液基细胞样本瓶中剩余液体倒入20 ml离心管中,3 000 r/min离心5 min后,倒掉上清液,剩余细胞沉渣备用。③离心管中加入与细胞沉渣相适量的新鲜血浆,充分混匀后,加入等体积配置好的凝血酶。静置数秒,可见固体细胞团块形成后,将团块轻轻倒在包埋纸上,包好放入密孔型包埋盒内,立即投入4%中性缓冲福尔马林固定4 h。④充分固定后,将包埋盒放入脱水机进行常规脱水。
1.5.2 HE切片制备和免疫细胞化学染色 细胞蜡块常规脱水后,第2天进行石蜡包埋、切片、HE染色、镜检。针对阳性及可疑阳性标本,根据诊断需要选择免疫细胞化学抗体。免疫细胞化学染色在中杉金桥Ultra PATH自动免疫组化机上完成。镜下观察。
1.5.3 统计学方法 以病理活检为“金标准”,采用SPSS 25软件对检测结果进行配对四格表χ2检验,P<0.05为差异有统计学意义。
2 结果
87例标本中成功制备细胞蜡块83例,成功率95.4%(83/87)。83例细胞蜡块中有活检病理结果75例。二者诊断结果对比后,69例一致,6例不符,诊断正确率为92.0%(69/75)。
2.1 常规HE染色结果
83例标本细胞蜡块制片后,切片染色清晰,对比度明显(见图1)。
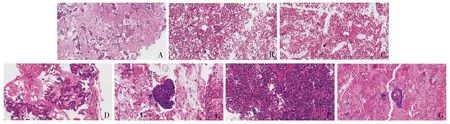
A.胸腔积液细胞蜡块中乳腺癌细胞(HE,×100);B.腹腔冲洗液细胞蜡块中恶性肿瘤细胞(HE,×200),经术后病理及外出会诊确诊为恶性混合性苗勒肿瘤;C.胸腔积液细胞蜡块中血管肉瘤细胞(HE,×200);D.甲状腺细针穿刺细胞蜡块中甲状腺乳头状癌细胞(HE,×200);E.肺泡灌洗液细胞蜡块中肺小细胞癌细胞团(HE,×200);F.尿液细胞蜡块中乳头状结构(HE,×200);G.痰液细胞蜡块中小细胞肺癌细胞团(HE,×200)图1 不同来源标本细胞蜡块切片HE染色效果Figure 1 HE staining of cell blocks from different samples
2.2 免疫细胞化学染色结果
染色背景清晰,阳性表达信号定位准确,均匀分布,对比度明显(见图2)。
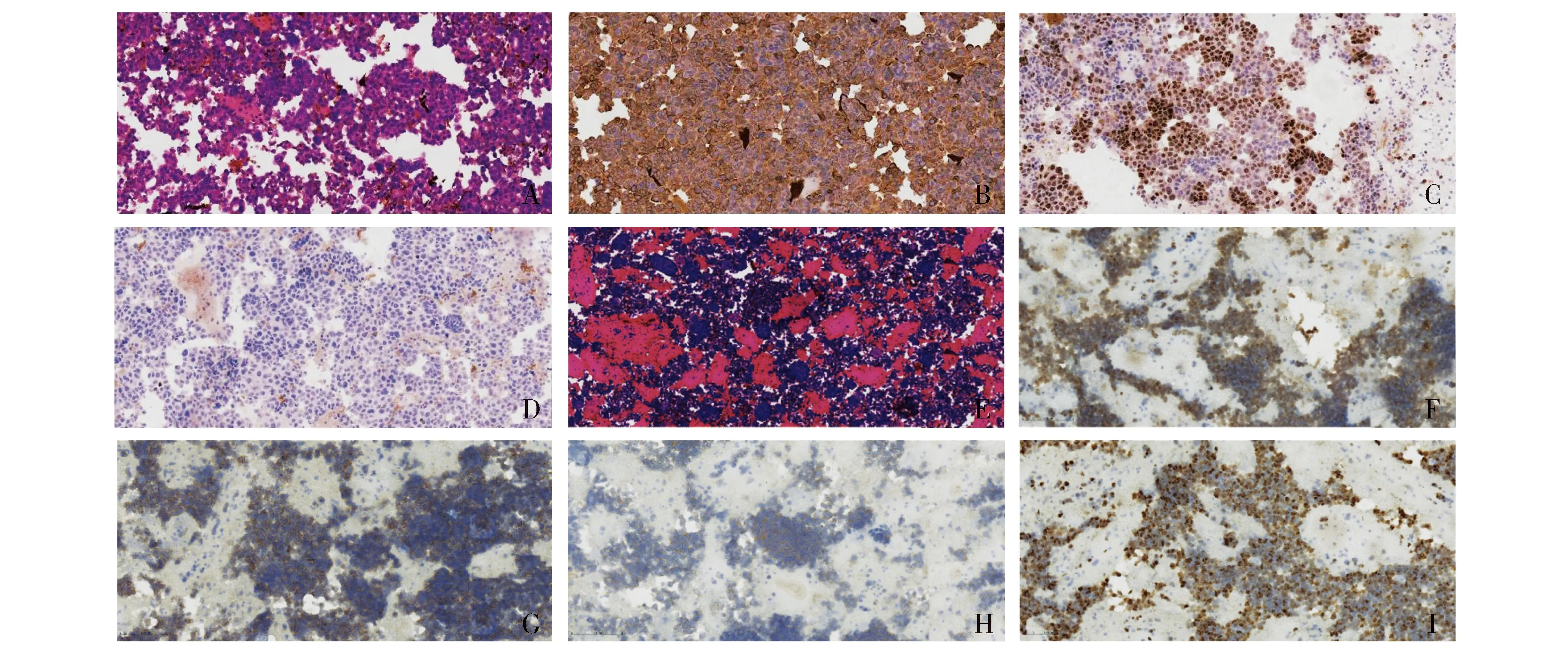
A.肺腺癌心包积液细胞蜡块常规染色(HE,×400);B.肺腺癌免疫细胞化学染色CK7(+)(ICC,×400);C.肺腺癌免疫细胞化学染色TTF-1(+)(ICC,×400);D.肺腺癌免疫细胞化学染色p63(-)(ICC,×400);E.小细胞肺癌胸腔积液细胞蜡块常规染色(HE,×100);F.小细胞肺癌免疫细胞化学染色TTF-1(+)(ICC,×200);G.小细胞肺癌免疫细胞化学染色CD56(+)(ICC,×200);H.小细胞肺癌免疫细胞化学染色Syn(+)(ICC,×200);I.小细胞肺癌免疫细胞化学染色Ki-67(70%+)(ICC,×200)图2 肺腺癌心包积液和小细胞肺癌胸腔积液细胞蜡块的HE及免疫细胞化学染色Figure 2 HE and ICC staining of cell blocks from pericardial effusion of lung adenocarcinoma and pleural effusion of small cell lung cancer
2.3 病理诊断结果
87例标本中有活检病理结果共75例。细胞蜡块与活检结果采用SPSS 25进行配对四格表χ2检验分析,结果显示两组间差异无统计学意义(P=0.219,见表1)。

表1 细胞蜡块与活检病理诊断结果 (例)
3 讨论
恶性肿瘤的细胞病理学诊断中,细胞蜡块有效弥补了液基细胞制片的缺点。细胞蜡块清晰度高,细胞量大,保存了细胞原有的排列方式和结构,免疫细胞化学及分子检测阳性率高且标本可以长期保存[3-5]。因此,目前采用液基细胞学制片和细胞蜡块联合使用以提高恶性肿瘤诊断准确性[6]。细胞蜡块可以充分利用送检材料完成更多的检查工作,对患者的创伤性更低,特别适用于因各种原因无法获取活检标本的恶性肿瘤病人[7]。细胞蜡块制备方法有多种,如玻片法、离心沉淀法、添加填充剂法等,每种方法各有其优缺点[8,9]。国内外各实验室针对不同类型标本也在不断摸索新的方法,以解决现有方法的不足[10-13]。但现有文献少有针对液基细胞学剩余标本细胞蜡块制备方法的研究,本实验室经过长期探索,寻找到一种适合的细胞蜡块制备方法:血浆-凝血酶法。
凝血酶与血浆混合可以促进纤维蛋白形成支架,将注入血浆中的细胞网罗其中。对比其他方法,本次研究发现血浆-凝血酶法制备液基细胞学剩余标本细胞蜡块在恶性肿瘤的诊断中具有以下优势:①解决了患者因标本量少、无法通过直接离心法制备细胞蜡块的困境,可得到细胞量充足的蜡块,为更多的恶性肿瘤患者争取诊断和治疗机会。本次研究87例标本中,成功制备细胞蜡块83例,成功率95.4%。②采用液基细胞学剩余标本,前期处理去除了标本内红细胞、黏液等干扰成分,高度集中保留了恶性肿瘤细胞。③血浆、凝血酶混合后形成纤维蛋白,随后不断收缩,网罗在其中的细胞在脱水包埋过程中不易松散破碎,有效避免了细胞丢失,实现恶性肿瘤患者细胞学标本利用最大化。④蜡块制备在离心管内完成,整个过程标本未暴露于空气中,有效避免蜡块本身被污染,同时生物安全性高。⑤不需购置额外设备,节约科室成本,从而节约患者诊断费用。⑥可立即包埋成块,无需等待,为技术员节省时间。此方法制备1例细胞蜡块大约仅需10~15 min。⑦细胞分布集中、不松散,切片中细胞密度高,便于诊断医师镜下观察,利于恶性肿瘤的诊断。⑧细胞结构清晰、完整,免疫细胞化学表达良好、定位准确。75例标本诊断结果与活检结果对比后,诊断正确率92.0%,诊断准确度高。
6例标本诊断结果与活检不符。其中误诊1例,术前诊断为可疑甲状腺乳头状癌,术后病理结果为桥本氏甲状腺炎,且细胞增生活跃异型性明显。漏诊5例,分别为腹腔冲洗3例,甲状腺细针穿刺1例,肺泡灌洗液1例。其中2例腹腔冲洗液漏诊原因为患者处于肿瘤早期,腹腔尚未发生转移。另外1例腹腔冲洗液和肺泡灌洗液漏诊原因为送检标本中恶性细胞量少,尚不足以明确诊断为恶性肿瘤细胞。1例甲状腺细针穿刺术后病理证实为甲状腺乳头状癌滤泡亚型,漏诊原因为细胞蜡块切片中细胞形态不够典型,尚不足以诊断为恶性。所有误诊与漏诊病例与送检标本质量、肿瘤类型及组织学形态特征有关,与本方法无关。
每种方法均有优缺点,在应用过程中,发现此法存在以下不足。首先,当液基细胞学剩余标本量过少(低于5 ml)时,细胞蜡块无法获得满意细胞量,这也是87例标本中6例标本细胞蜡块制备失败原因所在。此情况在相关文献也有报道[14]。其次,本方法用到PreservCyt®细胞保存液,有文献报道其固定效果不如福尔马林和95%酒精[15]。最后,Sung等[16]的研究表明,人类血浆可能是潜在的DNA污染源,尽管污染可能性很低,但不能排除导致错误结果的可能性。针对上述缺点还需后续不断研究探讨,以改良方法。
综上所述,使用血浆-凝血酶法制备液基细胞学剩余标本细胞蜡块,在细胞量、细胞密度、节约成本和时间、蜡块制备成功率、恶性肿瘤诊断准确率等方面均有优势,可在恶性肿瘤患者诊断及治疗中发挥积极作用。在无法获取更多满意标本的情况下,可考虑推广开展。

