胰腺癌中MKK7/JNKs/c-Jun通路通过促进施万细胞去分化促进神经浸润
李军辉,张无奈,张 焱,袁庆功,王继欣,杨文彬
(西安交通大学第二附属医院普外科,西安 710004;*通讯作者,E-mail:wenbinsurgery@126.com)
胰腺癌是一种常见的消化系统恶性肿瘤,主要来源于胰腺导管上皮。近年来,各种肿瘤的发病率均呈下降趋势,而胰腺癌的发病率仍呈缓慢上升趋势[1]。神经浸润(perineural invasion,PNI)是指癌细胞围绕和/或侵入浸润肿瘤微环境(tumor microenvironment,TME)的神经,在胰腺癌中神经浸润的发生率为80%~100%,是胰腺癌常见的不良组织学特征,与癌症侵袭性增加相关,是手术切除后癌症复发和转移的主要途径之一[2]。胰腺癌具有独特的神经微环境,其中可见神经肥大和神经密度增加,与促进细胞侵袭相关。此外,胰腺癌肿瘤微环境中具有复杂的细胞类型与信号交互,可增强胰腺癌的神经浸润、胰腺神经重塑和疾病进展,包括神经与肿瘤细胞之间的信号通路,成纤维细胞与肿瘤的交互,免疫细胞与肿瘤的交互以及肿瘤微环境中的多种基质成分等[3]。
施万细胞(Schwann cells,SCs)广泛分布在胰腺癌肿瘤微环境中,是胰腺癌患者生存不良的独立预后因素[4]。在鼠类和人胰腺上皮内瘤变组织周围可检测到施万细胞,这表明在胰腺癌进展的早期阶段,施万细胞就参与胰腺癌的发生与进展:在胰腺癌发生的早期,就存在施万细胞向胰腺癌细胞的定向迁移,并且施万细胞的存在与神经入侵的频率显著相关[5]。当外周神经受损时,施万细胞快速进入去分化状态,去分化施万细胞高表达胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP),清除髓鞘周围碎片组织并修复神经轴索,从而成为损伤反应的修复中心。去分化施万细胞可募集炎性细胞以协助髓鞘清除,分泌神经营养因子以支持神经元存活和轴突再生,使再生的轴突重新髓鞘化,最终导致神经修复[6]。
施万细胞的去分化表现为活化蛋白1(activator protein-1,AP-1)的上调和髓鞘形成关键因子Krox-20的下调,两者的表达受不同信号通路控制,单纯的Krox-20表达下降并不足以引起施万细胞去分化,但AP-1的上游分子c-Jun表达增加可介导施万细胞发生去分化,提示c-Jun是施万细胞去分化的核心因素[7]。近期研究表明,在组织发育和疾病发生过程中,c-Jun可联通、扩增和整合不同信号通路,如EGFR-ERK、EGFR-RhoA-ROCK和MAP3K1-JNK等,而c-Jun增加引起的施万细胞去分化是c-Jun N-terminal Kinase(JNK)依赖性的[7,8]。JNK的活性发挥由信号级联反应实现,主要由丝裂原活化蛋白激酶4(MKK4)和丝裂原活化蛋白激酶7(MKK7)介导,其中MKK7主要活化JNK,而MKK4可同时活化JNKs和p38MAPKs。MKK属于丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族成员,是一种Ser/Thr蛋白激酶,可在多种不同的信号转导途径中充当一种共同的信号成分,在基因表达调控和细胞质功能活动中发挥关键作用[8-11]。
前期研究发现,施万细胞在体外可使胰腺癌细胞侵袭能力增加[12],在此基础上,本研究通过观察胰腺癌组织中MKK7、c-Jun的表达情况及癌细胞、神经节中MKK7对迁移能力的影响,探讨在胰腺癌神经微环境中,MKK7/JNKs/c-Jun通路对癌细胞和神经纤维迁移的作用及对神经浸润的影响,为胰腺癌神经浸润的研究提供新的理论支持。
1 材料与方法
1.1 胰腺癌组织、细胞培养和试剂
收集西安交通大学第二附属医院2020年1—12月收治的胰腺癌患者,选择根治性手术并且病理确诊为导管腺癌的患者22例,选择同一患者癌组织和癌旁组织,收集石蜡切片进行研究。本研究经西安交通大学第二附属医院研究伦理委员会审查和批准。人胰腺癌细胞系PANC-1和BxPC-3购自中国科学院细胞库(中国上海),大鼠施万细胞RSC96(SCs)购自中国科学院细胞库(中国上海)。细胞在37 ℃恒温且含5% CO2条件下使用含有10%胎牛血清和1%青霉素/链霉素(Gibco,美国)的DMEM(Gibco,USA)培养基中培养。
试剂:anti-GFAP(Cell Signaling Technology,3670T,美国),anti-MKK7(Sigma,MABS1202,美国),anti-GAPDH(Proteintech,60004-1-Ig,美国),anti-c-Jun(Sigma,SAB4501604,美国),anti-JNK2(Sigma,05-986,美国),二抗(Abcam,ab6721,ab6728,英国)。
1.2 免疫组化检测GFAP及MKK7在施万细胞中的表达
收集我院胰腺癌患者癌组织及癌旁组织标本22例,通过HE染色检测神经浸润情况,通过免疫组化检测施万细胞去分化标记物GFAP表达。经二甲苯Ⅰ、Ⅱ脱蜡各10 min。100%,100%,90%,80%,70%酒精各5 min。切片进行HE染色,苏木精染色5 min,流水冲洗。5%乙酸分化1 min,流水冲洗,用吸管滴加乙酸,布满玻片上的组织即可,分化后颜色变浅,呈蓝色。伊红染色1 min,流水冲洗。70%,80%,90%,100%酒精各10 s,二甲苯1 min,晾干,滴上中性树胶,封片。免疫组化步骤检测癌组织和癌旁组织施万细胞MKK7以及去分化指标GFAP的表达情况,切片中加入过氧化氢-甲醇15 min,降低内源性过氧化物酶造成的非特异性背景染色,PBS清洗3次,每次5 min;将绵羊血清滴加在盖玻片上,放入37 ℃烤箱孵育30 min;吸去血清,勿洗。分别加入一抗anti-GFAP(1 ∶500),anti-MKK7(1 ∶500),于4 ℃过夜;PBS清洗3次,每次5 min;将即用型ABC液滴加在盖玻片上,孵育30 min,PBS清洗3次,每次5 min;加入DAB显色液作用10 min,PBS清洗3次,每次5 min;梯度酒精中脱水、二甲苯透明、中性树脂封片。
1.3 DRG与癌细胞条件培养基的间接共培养以及与癌细胞的直接共培养
新生SD大鼠购自西安交通大学实验动物中心,从新生大鼠中分离背根神经节(dorsal root ganglion,DRGs),通过正常培养基(Con)、癌细胞条件培养基(CM)单独培养DRG,观察癌细胞对神经纤维生长的影响,通过癌细胞-DRG共培养观察神经对癌细胞生长的趋化性。将DRG在冷PBS中洗涤,嵌入10 μl Matrigel(CORNING公司,美国)于24孔板,DRGs在37 ℃恒温且含5% CO2条件下使用含有10%FBS的DMEM培养基进行培养。
DGR与癌细胞条件培养基的间接共培养实验:将DRG分别用空白培养基(Con)、正常癌细胞条件培养基(CM)或MKK7低表达癌细胞条件培养基(sh-CM)进行培养,分别培养0,24,48,72 h,显微镜下动态观察神经纤维迁移距离并拍照。
DRG与癌细胞直接共培养实验:将DRG分别与正常癌细胞(Con)和MKK7低表达癌细胞(sh-MKK7)进行共培养。在第1天,将50 μl PANC-1或BxPC-3细胞(细胞悬液计数并调整至约2×106/ml)滴入24孔板中并正常培养以使细胞贴壁生长。在第2天,将10 μl Matrigel(内嵌DRG于Matrigel中)接种在癌细胞旁边,使癌细胞边缘与DRG边缘距离为1 mm(在显微镜下通过透明刻度尺控制距离)。分别继续培养0,24,48,72 h,在显微镜下动态观察神经纤维的生长距离和癌细胞向神经节的迁移距离并拍照。应用Image J软件对DRG中神经纤维迁移距离以及癌细胞向DRG的迁移距离进行量化分析,观察两者之间的相互作用。
1.4 慢病毒shRNA敲低胰腺癌细胞株MKK7表达
使用包含有MKK7(GATCGACCTCAACCTGGATAT)的shRNA及嘌呤霉素抗性基因的重组逆转录慢病毒感染胰腺癌细胞株PANC-1和BxPC-3。用2 μg/ml嘌呤霉素(Beyotime Technology;ST551)培养细胞4周,并选择抗嘌呤霉素的克隆继续培养。通过Western blot实验检测MKK7表达,选择MKK7下调最为明显的2个单细胞克隆进行后续实验。
1.5 蛋白质印迹分析细胞中c-Jun,JNK2以及MKK7的表达
将胰腺癌细胞株PANC-1和BxPC-3分别接种在培养皿中,用含有蛋白酶抑制剂(1%抑制剂混合物和1 mmol/L PMSF)的RIPA缓冲液从培养细胞中提取细胞裂解物提取蛋白。用BCA蛋白质测定试剂盒(Beyotime Biotechnology)测量蛋白质裂解物的浓度。通过SDS-PAGE分离等量的蛋白质,转移到PVDF膜上,并用特异性抗体进行免疫印迹。4 ℃下与一抗(anti-c-Jun,1 ∶1 000;anti-JNK2,1 ∶1 000;anti-MKK7,1 ∶500;anti-GAPDH,1 ∶500)共孵育过夜后,将膜用二抗在37 ℃下印迹2 h。使用ECL蛋白质印迹底物观察结果并使用GeneBox化学发光仪(Syngene)进行拍照。用Image J软件(NIMH,美国国立卫生研究院)测定膜的光密度定量。实验重复3次。
1.6 细胞划痕实验检测胰腺癌细胞迁移能力变化
通过细胞划痕实验检测MKK7对胰腺癌细胞株PANC-1和BxPC-3迁移能力影响。胰腺癌细胞在6孔板中生长至汇合,然后使用无菌的200 μl移液管尖端人工损伤细胞单层。通过用PBS洗涤3次去除细胞碎片并拍照,记作0 h,继续培养24 h和72 h,并在0,24,72 h时进行显微拍照,监测细胞迁移能力。
1.7 统计学分析
所有结果均表示为3次重复实验的均数±标准差,不同组之间的统计比较通过Student’st检验或one-way ANOVA进行多重比较校正。对于所有统计分析,P<0.05被认为差异具有统计学意义。使用GraphPad Prism软件7.0版(GraphPad Software)进行数据分析。
2 结果
2.1 胰腺癌组织及配对癌旁组织的免疫组化染色
为了探究构成神经髓鞘的施万细胞与胰腺癌神经浸润的关系和可能机制,我们对发生神经浸润的癌组织和配对的癌旁组织进行HE染色,发现癌组织排列紊乱,可见神经浸润,且神经密度明显高于癌旁组织(见图1)。进一步对癌组织中的神经髓鞘施万细胞进行免疫组化染色,发现癌组织中的施万细胞,其数量及去分化标记物GFAP染色水平均明显高于癌旁组织(见图1)。进一步的免疫组织化学染色发现,施万细胞MKK7表达定位于细胞核和细胞浆中,且癌组织中施万细胞MKK7表达量明显高于癌旁组织(见图1)。
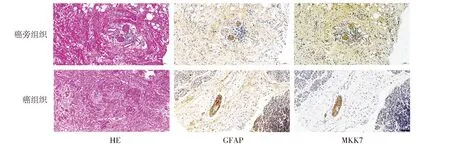
图1 胰腺癌组织及配对癌旁组织的免疫组化染色 (bar=100 μm)Figure 1 Immumohistochemical staining of pancreatic cancer tissue and paired adjacent tissue (bar=100 μm)
2.2 MKK7低表达胰腺癌细胞株构建及JNK2、c-Jun表达检测
为了探究胰腺癌中MKK7/JNK/c-Jun通路与施万细胞去分化以及神经浸润的关系,我们采用shRNA技术构建MKK7低表达胰腺癌细胞株PANC-1和BxPC-3,并利用嘌呤霉素抗性进行单克隆筛选。筛选后的胰腺癌细胞株运用Western blot检测其MKK7及其下游通路活化程度,GAPDH作为内参蛋白。
在PANC-1细胞株中,sh-MKK7 #1和sh-MKK7 #2细胞株中MKK7表达均下调,且sh-MKK7 #2单克隆细胞株中MKK7抑制效率更高,伴随JNK2和c-Jun表达明显下降(见图2),可以用于下一步实验。同样方法构建BxPC-3细胞MKK7低表达细胞株,BxPC-3细胞株中sh-MKK7 #1为下调效率较高的细胞株,JNK2和c-Jun表达也随之下降(见图2),可以用于下一步实验。
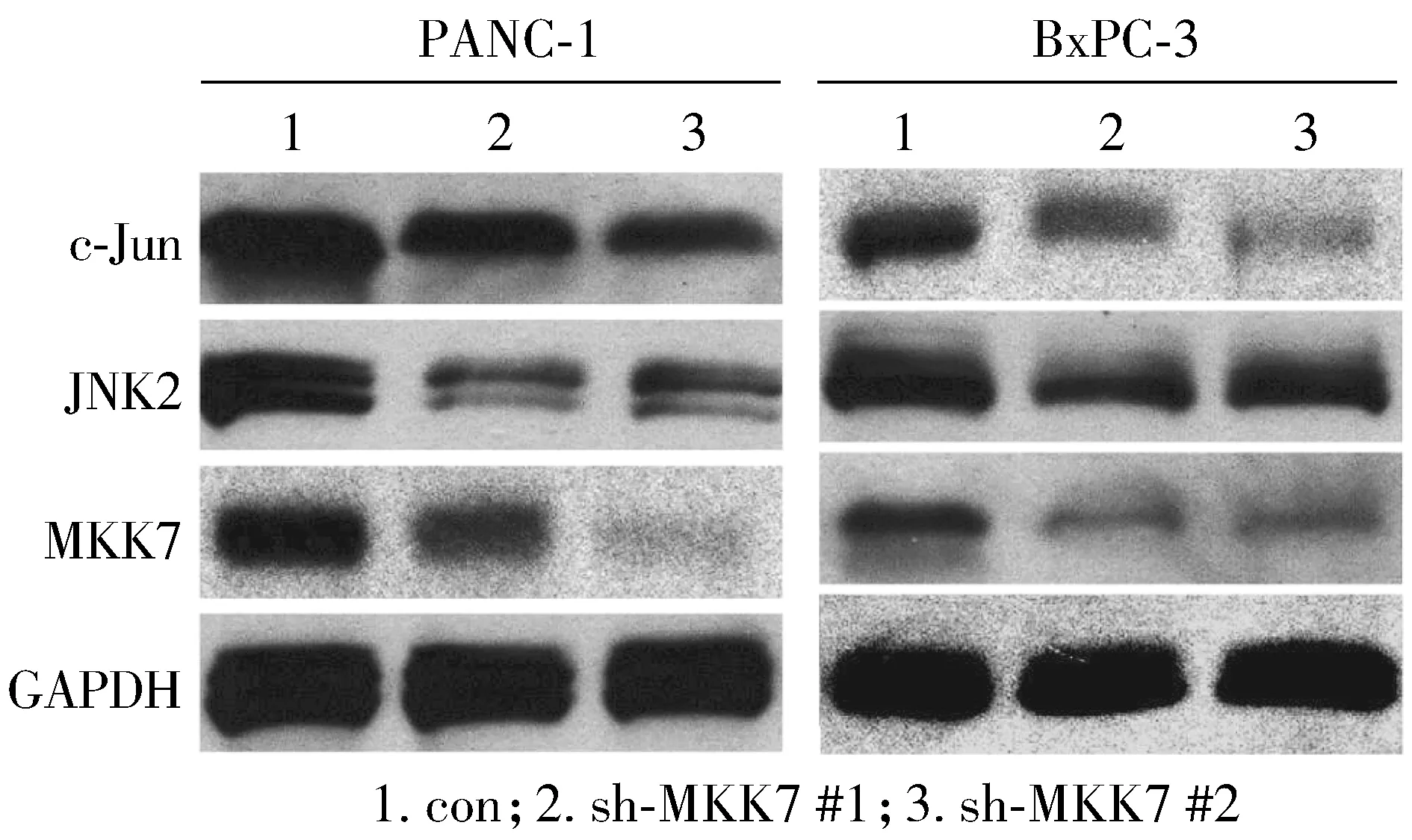
图2 Western blot检测正常胰腺癌细胞与MKK7低表达胰腺癌细胞中c-Jun,JNK2和MKK7的表达Figure 2 Expression of c-Jun, JNK2 and MKK7 in normal pancreatic cancer cells and MKK7 low expression pancrea-tic cancer cells detected by Western blot assay
2.3 划痕愈合实验检测MKK7对癌细胞迁移能力的影响
为了探究MKK7对癌细胞迁移能力的影响,我们采用细胞划痕实验来检测MMK7低表达胰腺癌细胞株与对照胰腺癌细胞株之间迁移能力的差异。结果发现,在PANC-1细胞株中,划痕后24 h和72 h时,sh-MKK7组癌细胞划痕间隙明显大于对照组;在BxPC-3细胞中,划痕后24 h和72 h时,sh-MKK7组癌细胞划痕间隙明显大于对照组(见图3)。以上结果表明,MKK7可以增强胰腺癌细胞的迁移能力。

图3 划痕愈合实验检测MKK7对胰腺癌迁移能力的影响 (bar=200 μm)Figure 3 Influence of MKK7 on pancreatic cancer migration ability detected by wound healing assay (bar=200 μm)
2.4 胰腺癌MKK7对脊髓背根神经节(DRG)神经纤维生长的影响
为了探究胰腺癌细胞MKK7通路对神经浸润中神经纤维的影响,我们首先采用胰腺癌-DRG间接共培养模型进行研究。正常对照培养基(Con)、癌细胞条件培养基(CM)、MKK7低表达癌细胞条件培养基(sh-CM)被加入神经节中进行培养,观察不同时间点神经轴索向外生长的长度。与正常对照培养基相比,PANC-1癌细胞条件培养基CM可明显促使神经轴索向外生长,并增加神经纤维密度;与正常对照培养基Con相比,MKK7低表达癌细胞培养基sh-CM同样可促使神经纤维生长,但其促进神经纤维生长的程度低于癌细胞条件培养基组,差异具有统计学意义(P<0.05,见图4)。类似地,与正常对照培养基相比,BxPC-3癌细胞条件培养基CM可明显促使神经轴索向外生长,并增加神经纤维密度;与正常对照培养基Con相比,MKK7低表达癌细胞培养基sh-CM同样可促使神经纤维生长,但其促进神经纤维生长的程度低于癌细胞条件培养基组,差异具有统计学意义(P<0.05,见图4)。以上结果说明,胰腺癌细胞可以通过旁分泌途径促进神经节中神经纤维的生长,敲低MKK7可以抑制这一过程。
2.5 胰腺癌MKK7对癌细胞朝向神经迁移能力的影响
为了进一步探究MKK7对胰腺癌神经浸润中癌细胞的影响,我们采用胰腺癌细胞与DRG直接共培养模型进行研究。将正常胰腺癌细胞株(Con组)和MKK7低表达胰腺癌细胞株(sh-MKK7组)分别与DRG进行直接共培养,并通过显微照相记录培养24,48,72 h后共培养模型中胰腺癌细胞向DRG的迁移距离。

与Con组比较,*P<0.05;与sh-CM组比较,#P<0.05图4 神经节与胰腺癌条件培养基共培养实验检测MKK7对神经纤维生长的影响 (bar=200 μm)Figure 4 Influence of MKK7 on DRG nerve fiber growth detected by DRG and pancreatic cancer conditioned medium indirect co-culture assay (bar=200 μm)
在PANC-1与DRG直接共培养模型中,随着培养时间延长,胰腺癌细胞朝向DRG迁移,且相比于Con组,sh-MKK7组癌细胞在24 h的迁移距离更短,在培养48 h和72 h时,与Con组相比,sh-MKK7组迁移距离更短,差异有统计学意义(P=0.001 9,0.032 8,见图5)。类似地,在BxPC-3与DRG共培养模型中,相比于Con组,sh-MKK7组中癌细胞向DRG的迁移距离更短,在培养72 h时,与Con组相比,sh-MKK7组迁移距离更短(P=0.000 2,见图5)。以上结果表明,在体外模型中,胰腺癌MKK7可以促进胰腺癌神经浸润,癌细胞向神经的迁移能力。
3 讨论
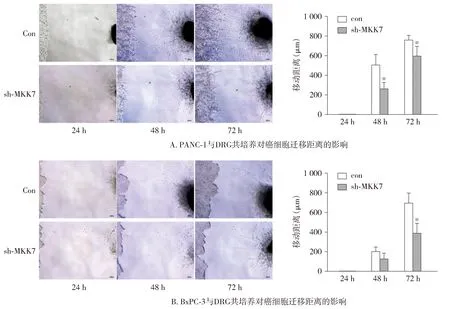
与Con组比较,*P<0.05图5 神经节与胰腺癌细胞直接共培养实验检测MKK7对癌细胞朝向神经迁移能力的影响 (bar=200 μm)Figure 5 Influence of MKK7 on the migration ability of cancer cells towards nerve detected by DRG and pancreatic cancer direct co-culture assay (bar=200 μm)
施万细胞(Schwann cell, SCs)广泛分布在胰腺癌肿瘤微环境中,是胰腺癌患者生存不良的独立预后因素[4]。SCs是外周神经系统的主要神经胶质细胞,可通过直接接触促进癌症的侵袭,诱导癌细胞向神经迁移并以接触依赖性方式促进侵袭。接触后,SCs在其方向上诱导癌细胞突起的形成并插入癌细胞之间,导致癌细胞扩散,这些过程的形成取决于神经细胞黏附分子1(neural cell adhesion molecule 1,NCAM1)在SCs表达,并最终促进神经浸润[13]。当外周神经受损时,施万细胞快速进入去分化状态,从而成为损伤反应的修复中心。去分化施万细胞可募集炎性细胞以协助髓鞘清除,分泌神经营养因子以支持神经元存活和轴突再生,使再生的轴突重新髓鞘化,最终导致神经修复。当周围神经系统受损伤时,轴突可以以每天1~3 mm的速度再生,并重新对靶器官进行神经支配。研究表明,施万细胞在胰腺癌发生发展中发挥“类神经修复样作用”[6]。在肿瘤微环境中,施万细胞可被缺氧、肿瘤细胞和T细胞分泌的因子激活,发挥“类神经修复样作用”[14]。本研究提示,在胰腺癌组织标本中,施万细胞去分化在癌组织明显高于癌旁组织。
c-Jun作为激活蛋白1(activator protein-1,AP-1)家族成员,是调节施万细胞去分化和获得修复施万细胞功能的关键转录因子,调节c-Jun的水平可能在外周神经系统的许多病理学状况中具有治疗应用[15]。而c-Jun增加引起的施万细胞去分化是JNK(c-Jun NH2-terminal protein kinase)依赖性的[7]。JNK的活性发挥是通过信号级联反应实现的,主要是MKK4和MKK7,MKK7主要活化JNK,而MKK4可同时活化JNKs和p38MAPKs。MKK属于MAPK(mitogen-activated protein kinases, MAP激酶,MAPK)家族成员,是一种Ser/Thr蛋白激酶,可在多种不同的信号转导途径中充当一种共同的信号转导成分,在基因表达调控和细胞质功能活动中发挥关键作用[9,10]。本研究提示,胰腺癌中施万细胞的去分化状态与MKK7的表达情况密切相关,并且与DRG中神经纤维生长以及神经浸润密切相关,提示其可能的调控作用。
MKK7是调节JNK级联活性最重要的MAP2K,对多种细胞内功能的重要性,如细胞生长、增殖、衰老、分化、转化、细胞周期调节和肿瘤代谢。细胞和小鼠中MKK7功能的丧失破坏了维持有机稳态所需的许多关键过程,如细胞凋亡、细胞形成和发育以及肿瘤发生[16]。
综上所述,胰腺癌细胞可通过MKK7/JNKs/c-Jun通路促进施万细胞去分化,并促进癌细胞和神经纤维的迁移,参与胰腺癌神经浸润的发生发展,针对MKK7的靶向治疗,有望为胰腺癌神经浸润的靶向治疗研究提供新的理论及实验支持。

