miR-208b干预对心肌梗死小鼠的保护作用
诸培佳 俞洁霏 邬亦华 顾 晔 张江蓉
(1. 上海申德医院内科,上海 200336)(2. 上海国际医学中心内分泌科,上海 200120)(3. 上海国际医学中心内科,上海 200120)(4. 上海市交通大学医学院附属新华医院老年科,上海 200092)
1 材料和方法
1.1 材料
1.1.1实验动物:雄性C57BL/6 J小鼠,10周龄,体质量25~35 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:【SCXK(京)2016-0011】。按照海申德医院医学伦理委员会的相关规定进行实验,伦理委员会审批号:【SCXK(沪)2017-0005】。
1.1.2实验试剂:miR-208b antagomir腺病毒及空载腺病毒购自上海汉恒生物公司;TTC和TUNEL试剂盒购自Roche;Power SYBR green PCR master mix、TaqMan Universal PCR Mix、TaqMan microRNA Assay均购自宝生物工程(大连)有限公司;Bcl-2及Bax单克隆抗体购自Santa Cruz,β-actin单克隆抗体购自上海研谨生物科技有限公司;RIPA裂解液购自北京索莱宝科技有限公司;BCA试剂盒购自Thermo Fisher公司;SDS-PAGE凝胶、电泳液等购自中科瑞泰(北京)生物科技有限公司。
1.1.3实验仪器:CM1520冷冻切片机购自Leica;荧光定量PCR仪购自ABI;逆转录试剂购自Promega;液氮罐购自四川乐山东亚机电工贸有限公司;电泳仪及转膜仪/稳压电源购自Bio-rad;离心机购自Heraeus;紫外分光光度计、酶标仪和超低温冰箱购自Thermo;成像系统购自Pierce;小动物呼吸机购自Harvard Apparatus。
1.2 方法
1.2.1心肌梗死小鼠模型制备:参考Li等[6]和史建伟[7]建立心肌梗死小鼠模型。小鼠仰卧位固定于手术台,手术区域消毒,使用50 mg/kg氯胺酮和5 mg/kg地西泮进行腹腔注射麻醉,行气管插管并连接呼吸机。麻醉后沿胸骨左侧4~5肋间切皮,钝性分离皮下组织与肌肉,打开胸腔,用胸骨撑开器固定肋骨,充分暴露心脏,分离心包膜,使用7/0滑线结扎左心耳下缘2~3 mm处的冠状动脉前降支,结扎处缺血区的左心室前壁逐渐变为灰白色,且体表心电图显示ST段抬高0.2 mV,说明心肌梗死小鼠造模成功。在成功构建心肌梗死小鼠的心肌梗死周围区域(心肌颜色灰白区周边)选择5点(0、3、6、9点及中央),分别用微量注射器注射0.9%生理盐水、腺病毒载体溶液及携带miR-208b腺病毒溶液各25 μL后,清除胸腔积血,闭合肋间伤口,逐层缝合胸壁,并抽取胸腔负压,待小鼠自主呼吸恢复至正常,撤除呼吸机。整个手术过程严格按照无菌操作进行,并将小鼠置于SPF环境下繁殖饲养(温度25 ℃、相对湿度55%)1周。为防止术后感染,术后3 d内所有小鼠均注射青霉素。
1.2.2实验分组:将造模成功的小鼠随机分为模型组(MI组)、空载体组(Ad组)、miR-208b antagomir组(实验组)。所有处理均同造模组,但是未进行前降支结扎小鼠作为假手术组(Sham组)。其中MI组小鼠在MI模型构建成功后于心肌梗死周围区域注射等量的0.9%生理盐水,Ad组小鼠于心肌梗死周围区域注射等量的腺病毒载体溶液,实验组小鼠于心肌梗死周围区域注射等量的携带miR-208b腺病毒溶液,病毒量为0.1 mL(4×107TU)。
1.2.3超声心动图检测心功能:术后,精心饲养1周后各组随机选取6只小鼠将其麻醉,采用超声心动图检测左心室舒张末期内径(LVEDd)、左心室收缩末期内径(LVESD)、左室射血分数(LVEF)、短轴缩短率(FS)等心功能指标。
1.2.4qRT-PCR:qRT-PCR检测心肌梗死小鼠心肌组织中miR-208b的表达。各组随机选取6只小鼠,将小鼠心脏组织进行胰蛋白酶消化,离心后提取总RNA,经逆转录为cDNA,使用TaqMan探针和miR-208b特异性引物进行实时荧光定量PCR反应。定量PCR反应条件:95 ℃、10 min,95 ℃、15 s,40个循环,62 ℃、1 min,40个循环。以U6作为内源参照,用2-ΔΔCT方法分析数据。miR-208b引物序列,F:5′-TCCACACAGAGGGGACTCTT-3′,R:5′-TGAGCATGAAGGCATAGCAC-3′;U6引物序列,F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACGCTTCAC GAATTTGCGT-3′。
1.2.5TTC染色法:TTC染色法测定小鼠心肌梗死面积。手术后精心饲养1周后,各组随机选取6只小鼠,处死取出心脏,用PBS溶液冲洗用纱布吸干心脏表面水分,置于-20 ℃冰箱中冷冻20 min后切片,进行TTC染色,37 ℃避光孵育15 min, 5 min晃动容器一次,染色后PBS溶液冲洗,拍照。图中灰白色区域为心肌梗死区,砖红色为正常区域,用Image Pro Plus 6.0计算心肌梗死面积。心肌梗死%=100%×(梗死面积/心脏切面总面积)。
1.2.6荧光TUNEL法:荧光TUNEL法测定心肌梗死小鼠心肌梗死周围区域心肌细胞的凋亡。各组随机选取6只小鼠,将小鼠心梗周围组织切片进行石蜡包埋,按照TUNEL试剂盒操作步骤进行脱蜡及水合,待细胞通透后加入TdT和dUTP,DAPI复染后加入抗荧光淬灭剂,封片。经荧光染色后凋亡的细胞在荧光显微镜下呈现绿色,正常细胞为蓝色,每张切片寻找5个视野,记录其平均值。凋亡率%=100%×凋亡细胞数/(凋亡细胞数+正常细胞数)。
2017年1-12月神经外科出院患者1258例,发生医院感染59例,65例次,实际感染率4.69%,感染例次率5.17%。
1.2.7Western blot:Western blot检测心肌梗死小鼠心脏组织中Bcl-2及Bax的蛋白表达。各组随机选取6只小鼠,将小鼠心肌梗死周围组织裂解后,提取总蛋白并测定浓度后,进行SDS-PAGE凝胶电泳,转膜后,封闭液温室封闭1 h后加入一抗,4 ℃孵育过夜,TPBS漂洗后加入二抗,孵育1 h后漂洗,加入ECL发光试剂,曝光后拍照,使用Image J软件进行分析。
1.3 统计方法

2 结果
2.1 心肌梗死小鼠心肌组织中miR-208b的表达
小鼠心肌梗死7 d后,与Sham组比较,MI组和Ad组小鼠心肌梗死周围区域miR-208b的表达显著上调(P<0.05),说明miR-208b在心肌组织中增加;实验组小鼠miR-208b的表达显著较MI组下调(P<0.05),说明携带miR-208b antagomir的腺病毒已成功转染至心肌梗死小鼠的心肌组织(图1)。
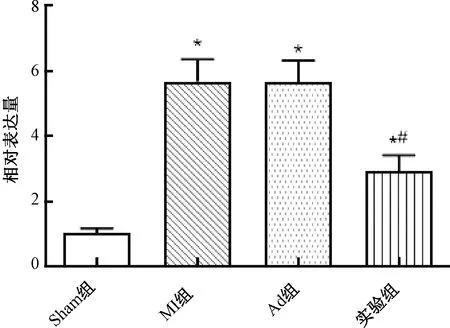
图1 心肌梗死小鼠心肌组织中miR-208b的表达注:与Sham组比较,*P<0.05;与MI组比较,#P<0.05Fig.1 Expression of miR-208b in myocardial tissue of mice with myocardial infarction Note:Compared with the sham group, *P<0.05;Compared with the MI group, #P<0.05
2.2 miR-208b干预对心肌梗死小鼠心肌梗死面积的影响
各组小鼠心肌梗死7 d后,MI组、Ad组和实验组小鼠心肌梗死面积分别为(51.890±5.903)%、(50.224±5.626)%、(29.808±6.544)%,实验组心肌梗死面积明显小于MI组、Ad组(P<0.05),说明心肌梗死小鼠miR-208b的表达明显上调,miR-208b干预可减轻心肌梗死的影响(图2)。
2.3 miR-208b干预对心肌梗死小鼠心功能的影响
与Sham组比较,MI组、Ad组及实验组小鼠LVEDd与LVESD水平明显升高,LVEF和FS%显著降低(P<0.05);与MI组比较,实验组小鼠LVEDd与LVESD水平明显降低,LVEF和FS%显著升高(P<0.05),MI组和Ad组小鼠LVEDd与LVESD水平和LVEF和FS%比较差异无统计学意义(P<0.05)(表1)。
2.4 miR-208b干预对心肌梗死小鼠心肌细胞凋亡的影响
Sham组、MI组、Ad组和实验组小鼠心肌细胞的凋亡率分别为(8.688±0.892)%、(45.099±5.355)%、(44.820±5.407)%和(37.178±2.842)%。MI组、Ad组和实验组心肌细胞的凋亡率明显高于Sham组(P<0.05),实验组小鼠心肌细胞的凋亡率明显小于MI组(P<0.05),MI组和Ad组小鼠心肌细胞的凋亡率比较无统计学意义(P>0.05)。以上说明心肌梗死小鼠心肌细胞的凋亡明显上升,miR-208b干预可抑制心肌梗死小鼠心肌细胞的凋亡(图3)。
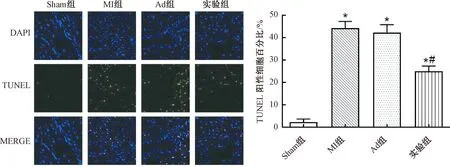
图3 心肌梗死小鼠心肌梗死周围区域心肌细胞的凋亡注:与Sham组比较,*P<0.05;与MI组比较,#P<0.05Fig.3 Apoptosis of myocardial cells around myocardial infarction in mice with myocardial infarction Note:Compared with the sham group, *P<0.05; Compared with the MI group, #P<0.05
2.5 miR-208b干预对心肌梗死小鼠心肌组织Bcl-2和Bax表达的影响
Western blot实验结果显示,4组小鼠心脏组织中Bcl-2及Bax的表达差异显著(P<0.05),MI组和Ad组心肌梗死小鼠心脏组织中Bcl-2的表达明显较Sham组下调(P<0.05),实验组Bcl-2的表达明显较MI组及Ad组上调(P<0.05);MI组和Ad组心肌梗死小鼠心脏组织中Bax的表达明显较Sham组上调,实验组Bax的表达明显较MI组及Ad组下调(P<0.05);MI组及Ad组小鼠Bcl-2和Bax的表达无显著差异(P>0.05)。说明心肌梗死小鼠Bcl-2明显下调,Bax的表达明显上调,由此可知miR-208b干预能明显上调心肌梗死小鼠心脏Bcl-2的表达,下调Bax的表达(图4)。
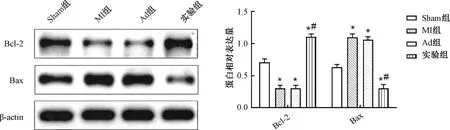
图4 miR-208b干预对心肌梗死小鼠心肌组织Bcl-2和Bax表达的影响注:与Sham组比较,*P<0.05;与MI组比较,#P<0.05Fig.4 Effect of miR-208b intervention on the expression of Bcl-2 and Bax in myocardial tissue of mice with myocardial infarction Note:Compared with the sham group, *P<0.05; Compared with the MI group, #P<0.05
3 讨论
心肌细胞是不可再生的,局部心肌细胞会因心肌梗死后而受到损伤并凋亡,丧失其原有的功能,进而引起心室重构,梗死部位胶原及纤维增生形成瘢痕组织,降低心肌的收缩性,出现心脏失代偿性扩大,心功能减弱,进而导致心力衰竭,严重影响患者的生活质量[8]。随着近年来基因治疗的崛起,众多相关研究表明miRNA能改善心肌梗死后大鼠的心功能[9-10]。
microRNA(miRNA)是内源性单链非编码RNA,通过与靶基因mRNA 3′ UTR特异性结合而抑制靶基因mRNA表达或使其降解,从而调控基因的表达,进而参与细胞的增殖与凋亡[11-12]。刘鹏飞等[13]使用携带miRNA-486的腺病毒转染心肌梗死后大鼠的心肌梗死区,发现可降低心肌梗死面积,改善大鼠心功能。miRNA-208b属于miRNA-208家族,由Myh7基因编码,在心肌及骨骼肌组织中特异性表达,与心脏发育及心肌损伤等生理及病理相关。李建民等[14]研究发现,AMI患者miR-208b水平明显升高,其早期诊断效能优于心肌肌钙蛋白(cTn Ⅰ)和肌酸激酶同工酶(CK-MB),通过检测miR-208b水平可有助于AMI的早期诊断及治疗[14]。另有研究表明,miR-208b在组织损伤时可快速释放入血,并在心肌组织中特异性高表达;急性心肌梗死时,miR-208b表达升高,可作为AMI诊断和预后的敏感生物标志物[15-16]。Alavi-Moghaddam 等[4]研究显示,AMI组miR-208b的表达明显高于健康对照组;且miR-208b表达升高与AMI患者的长期生存期降低有关。但是,目前miR-208b对心肌梗死后心肌凋亡的相关研究较少,所以本研究使用携带miR-208b的腺病毒转染心肌梗死小鼠,研究其通过调控心肌细胞的凋亡对心脏的保护作用。
本研究中使用结扎前降支的方法,重现AMI的发病过程。在构建AMI模型的过程中发现5只小鼠死亡,小鼠心肌梗死模型构建的成功率为72.22%,又选取同一批次10只小鼠进行AMI模型构建并成功后,使用腺病毒转染心肌梗死小鼠。7 d后发现,与Sham组比较,MI组及Ad组小鼠心肌梗死周围区域miR-208b的表达显著下调,实验组小鼠miR-208b的表达显著较MI组上调,说明miR-208b在心肌梗死小鼠中表达下调,且腺病毒已成功转染心肌梗死小鼠并在其心肌组织中表达。本研究结果还显示,实验组心肌梗死面积明显小于MI组;MI组、Ad组、实验组小鼠LDH和CK水平明显大于Sham组,实验组小鼠LDH和CK水平明显小于MI组。以上结果提示,miR-208b干预可明显减少心肌梗死面积,改善心功能。
细胞凋亡是由基因控制的程序性死亡,心肌梗死后机体为了保持细胞所处环境的稳定,局部心肌细胞会出现凋亡,引起心室重构。本研究结果显示,实验组小鼠心肌细胞的凋亡率明显小于MI组;实验组Bcl-2的表达明显较MI组上调,Bax的表达明显较MI组下调。提示miR-208b可能是通过调控Bcl-2及Bax的表达影响心肌细胞的凋亡,延缓心室重构,进而改善心肌梗死小鼠的心功能,实现其心肌保护作用。
因此,AMI小鼠心肌梗死周边区域miR-208b的表达明显升高,通过干预AMI小鼠心肌miR-208b的表达可明显改善其心功能,可能与其减弱心肌细胞凋亡有关,具体机制还有待进一步研究。

