心肌细胞特异性Snhg5过表达转基因小鼠的建立和应用*
孔静祎 徐京平 刘澜涛 王添乐 侯 宁 李振华 杨 晓 王 剑
(军事科学院军事医学研究院生命组学研究所,北京 102206)
近年来,随着我国社会经济发展,国民生活方式的变化,尤其是人口老龄化及城镇化进程的加速,心血管病患病率和死亡率处于持续上升阶段。目前,中国心血管病死亡占城乡居民总死亡原因的首位,农村为46.66%,城市为43.81%,心血管病给居民和社会带来的经济负担日渐加重。心脏重塑是多种心血管疾病(如高血压、心肌缺血、心律失常等)的共同病理过程,随着心脏重塑的进展,心力衰歇和心源性猝死发生率显著提高。因此,阐明心脏重塑的发生机制,寻找调节心脏重塑发生的新型调控分子对于防治心力衰竭以及改进心脏疾病个性化治疗策略具有重要和积极的意义。
长链非编码RNA(long non-coding RNA, LncRNA)是一类本身不编码蛋白、转录本长度超过200个核苷酸的长链非编码RNA分子[1]。近年来的研究表明LncRNA在心脏发育和病理重塑过程中发挥着非常重要的作用。如,小鼠心脏相关LncRNA AK143260(braveheart,Bvht)通过控制心脏细胞分化调节基因中胚层后螺旋转录因子1(mesoderm posterior 1,MesP1),Bvht通过激活参与心脏中胚层向各类心脏前体细胞转化的基因网络,来刺激干细胞分化为特定的心脏细胞[2-3]。肌球蛋白重链相关RNA转录本(myosin heavy chain associated RNA transcripts,Mhrt)在心脏组织中特异性表达,功能研究显示其可以抑制病理性心肌肥厚的发生[4]。另一种在心脏组织中丰度较高的心肌肥厚相关表观遗传调节因子(cardiac-hypertrophy-associated epigenetic regulator,Chaer),能通过与多梳蛋白抑制复合体2(polycomb repressor complex 2,PRC2)复合体内的Zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)相互作用,在心肌肥厚的发生及相关基因表达调控的过程中发挥重要的功能[5]。此外,长链非编码RNA H19能够抑制心肌细胞的肥大生长,在心脏组织中过表达H19能够缓解病理性心室重塑[6-7]。Snhg5(small nucleolar RNA host gene 5),又称U50HG, 是非蛋白编码小核RNA (SnoRNA)宿主基因家族和5′-寡嘧啶家族基因的一个成员,近年来的研究显示其在肿瘤发生发展过程中具有重要的功能。本团队前期研究发现Snhg5在发生病理性心脏重塑的小鼠模型心脏样品中表达水平上调,提示其在心脏重塑发生过程中可能发挥了重要功能,但目前关于其在心脏组织的功能还未见报道。
为了研究Snhg5在心脏组织中发挥的功能,本研究建立了心肌细胞特异性Snhg5过表达转基因小鼠。该小鼠的成功建立将首次提供体内的遗传学证据揭示Snhg5在心脏稳态维持中发挥的功能,并也有可能为未来探索心脏重塑发生机制,及发展心脏疾病的治疗策略提供理想的动物模型。
1 材料和方法
1.1 材料
1.1.1质粒与菌株:α-MHC-Cre-hGH载体由本室保存。
1.1.2实验动物:40只SPF级FVB小鼠,体质量25~28 g,来源于维通利华公司【SCXK(京)2021-0011】。本实验按照生命组学研究所国家蛋白质科学中心北京实验动物管理与使用委员会的相关规定进行实验,伦理委员会审批号:IACUC-20200515-17MB。
1.1.3工具酶和试剂:所用的限制性内切酶、T4 DNA连接酶、mRNA Selective PCR Kit (AMW)Ver 1.1均购自TaKaRa(大连)公司,蛋白酶K购自Merck公司。试剂盒QIA prep Spin Miniprep Kit购自Qiagen公司,琼脂糖为Biowest Agarose琼脂糖,核酸染料(EL105)购自北京博迈德基因技术有限公司。苏木素(HHS16)购自Sigma公司。0.1 mol/L柠檬酸盐修复液(ZLT9065)、双氧水(PV-6001)、山羊血清工作液(ZLI-9056)、一抗稀释液(ZLI-9020)、兔二步法试剂盒(PV6002)购自北京中杉金桥有限公司。TSA Systems相关显色试剂购自PerkinElmer公司。Trizol购自Invitrogen公司。Real-time PCR Mix(QPK-201)购自TOYOBO公司。
1.2 方法
1.2.1心肌细胞特异性过表达Snhg5 (α-MHC-Snhg5-hGH)转基因载体的构建:以小鼠心脏组织cDNA为模板扩增获得小鼠Snhg5,引物为:MHC-Snhg5 1 s(5′-TTTGTCGACGGGCTCGTTCTTTTACG ACG-3′)和Snhg5 1a(5′-TTTAAGCTTTTTGCAA TTGAATGTTTTTTA-3′),引物两端分别引入了SalⅠ和HindⅢ酶切位点。PCR扩增体系:1 μL cDNA,25 μL 2 × buffer ,10 μL dNTPs,1 μL KOD酶,1 μL上游引物,1μL下游引物,ddH2O补足50 μL。PCR扩增条件为:94 ℃预变性3 min;94 ℃变性30 s;55 ℃复性30 s;72 ℃延伸1 min,30个循环;72 ℃延伸10 min,4 ℃保温。将扩增产物于1.0%琼脂糖凝胶中电泳,回收1.1 kb左右的目的片段,克隆入T载体中,测序结果确认序列准确无误无任何突变。将测序正确的Snhg5 片断连入用SalⅠ和HindⅢ酶切的α-MHC-Cre-hGH载体,得到了含有α-MHC启动子、Snhg5基因以及人生长素基因polyA共3个元件的α-MHC-Snhg5-hGH的转基因载体。
1.2.2受精卵的显微注射:将α-MHC-Snhg5-hGH的转基因载体经KpnⅠ和SacⅡ酶切线性化后,通过受精卵原核显微注射法[8],共注射FVB小鼠受精卵200枚,然后将获得的受精卵移入8只母鼠的输卵管内进行妊娠。实验用FVB小鼠饲养于SPF级动物房。
1.2.3转基因小鼠的基因型鉴定:取出生后10 d左右的子代小鼠,剪下约0.5 cm的尾尖置于1.5 mL离心管中,加入400 μL组织裂解液,50 ℃保温过夜,制备基因组DNA作为PCR的模板。αMHC-Snhg5转基因特异引物α-MHC-s和MHC-Snhg5-2a由擎科公司合成,其中MHC-1: 5’-ATGACA GACAGATCCCTCCTATCTCC-3’位于α-MHC启动了序列上,MHC-Snhg5b-2a位于Snhg5片段上,序列为5’-CGCCATTGTCCTTGTGAA-3’。可扩增获得300 bp的片段,用于阳性转基因小鼠的检测。PCR扩增体系:20 μL体系:1μL小鼠DNA,10 μL 2 × mix ,7 μL ddH2O,1μL上游引物,1μL下游引物。PCR扩增的条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min,4 ℃保温。
1.2.4Snhg5在不同组织中表达水平的检测:提取心脏及其他组织RNA,将提取的RNA按 TOYOBO公司的ReverTra® Ace qPCR RT Master Mix进行逆转录反应,反转体系为:RNA 2 μg;5×RT Mix (TOYOBO) 2 μL;DEPC水补足至10 μL。反应条件为:37 ℃ ,15 min;50 ℃,5 min;98 ℃,5 min。
利用7500 Fast real-time PCR system对上述获得的cDNA进行检测。引物序列为:
GAPDH sense: 5′-TGCCCAGAACATCATCCCT-3′;
GAPDH antisense: 5′-GGTCCTCAGTGTAGCCC AAG-3′;
Snhg5 sense: 5′-CAGTCCGCCTGTGAAGAT-3′;
Snhg5 antisense: 5′-CTGCCAGAATAAGGAAA TAG-3′;
扩增条件为:95 ℃:20 s,95 ℃:60 s,95 ℃:15 s,60 ℃:15 s,72 ℃:45 s,40个循环;95 ℃:15 s; 60 ℃:60 s; 95 ℃:30 s; 60 ℃:15 s。
1.2.5小鼠心脏组织学检测:取两个月小鼠心脏组织于4% PFA固定过夜后,放入包埋机中进行系列组织脱水和透蜡,包埋蜡块。利用石蜡切片机制作厚度为5 μm的组织切片,用于H&E和Masson染色观察心脏组织形态和纤维化改变情况,以及Laminin免疫荧光染色检测心肌细胞表面积改变[9]。
1.3 统计学分析
数据以均数 ± 标准误表示,使用统计学软件Graphpad进行统计学分析。数据进行非配对t检验,P<0.05和P<0.01具有统计学意义。
2 结果
2.1 成功构建心肌细胞特异性Snhg5转基因载体(αMHC-Snhg5-hGh)
α-MHC-Snhg5转基因载体主要含有3个元件:5.5 kb启动子片断,1个1.1 kb的Snhg5基因和2.1 kb含有内含子的人生长激素(hGH)PolyA序列(图1A)。对得到的载体进行SalⅠ 和HindⅢ 酶切鉴定,显示出现10.7 kb 和1.1 kb的片断,其结果与预期结果相符(图1B)。进一步利用Snhg5全长引物对载体进行 PCR鉴定,转基因载体出现1.1 kb条带,与预期结果相符(图1C)。

图1 α-MHC-Snhg5转基因载体的构建与鉴定注:A. α-MHC-Snhg5转基因载体结构示意图;B. 转基因载体Sal Ⅰ和Hind Ⅲ 酶切鉴定图,1和10:DNA 相对分子质量标准,2~9:连入Snhg5片段的α-MHC-Snhg5-hGH质粒;C. 转基因载体PCR鉴定图,1和10:DNA 相对分子质量标准;2~8:连入Snhg5片段的α-MHC-Snhg5-hGH质粒Fig.1 Construction and identification of α-MHC-Snhg5 transgenic vectorNote:A. Structure diagram of α-MHC-Snhg5 transgenic vector; B. Restriction map of transgenic vectors digested by Sal I and Hind Ⅲ,1 and 10:1 kb DNA relative molecular weight standard, 2~9: α-MHC-Snhg5-hGh vectors; C. PCR identification map of transgenic vectors,1 and 10:1 kb DNA relative molecular weight standard, 2~8: α-MHC-Snhg5-hGh vectors
2.2 α-MHC-Snhg5转基因小鼠的构建
利用KpnⅠ和SacⅡ 酶切去除原核载体序列,电泳回收8.7 kb的α-MHC-Snhg5转基因片段。该片段纯化后,用注射用TE稀释至2.0 ng/μL。通过显微注射,将该片段导入小鼠受精卵雄原核中。共注射FVB小鼠受精卵200枚,然后将获得的受精卵移入8只母鼠的输卵管内进行妊娠,有3只假孕母鼠怀孕,获得子代小鼠14只,阳性小鼠4只,阳性率28.6%。提取了子代小鼠的鼠尾DNA,利用α-MHC-Snhg5转基因特异引物α-MHC-s和 MHC-Snhg5-2a进行PCR鉴定,发现转基因首建者小鼠出现300 bp的阳性条带(图2)。

图2 小鼠基因型鉴定结果图注:1和10:Mark Ⅰ DNA相对分子质量标志物;2~4:转基因首建小鼠;5~8:非转基因小鼠作为阴性对照;9:转基因载体作为阳性对照Fig.2 Results of mouse genotypingNote:1,10: Mark Ⅰ DNA relative molecular weight standard; 2~4: transgenic founder mice;5~8: non-transgenic mice; 9: Transgenic vector as positive control
2.3 α-MHC-Snhg5转基因小鼠不同组织中Snhg5表达水平的检测
为检测Snhg5过表达的组织特异性,利用实时定量PCR检测了转基因小鼠不同组织中Snhg5的表达情况。结果显示α-MHC-Snhg5转基因小鼠心脏组织中的Snhg5表达水平较对照小鼠心脏明显升高(图3A),而其他组织内Snhg5无过表达情况 (图3B),表明心肌细胞特异性过表达Snhg5的转基因小鼠建立成功。
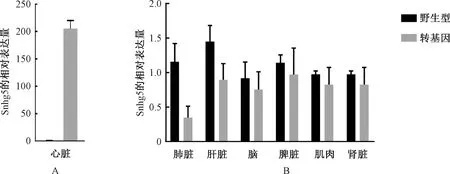
图3 转基因小鼠心脏及其他组织中Snhg5表达水平的检测注:A. 对照和转基因小鼠的心脏组织中Snhg5表达水平的检测;B. 对照组和转基因小鼠其他组织中Snhg5的表达水平的检测 Fig.3 Detection of Snhg5 expression level in the multiple tissues of transgenic miceNote: A. Detection of Snhg5 expression level in heart tissue from control and transgenic mice; B. Detection of Snhg5 expression level in other tissues from control and transgenic mice
2.4 Snhg5转基因小鼠在异丙肾上腺素(ISO)诱导之后更容易发生心脏重塑
对基础水平和ISO处理情况下转基因小鼠和对照小鼠心脏组织的大体形态和组织学变化情况检测结果显示,尽管2月龄转基因小鼠和对照小鼠的心脏大体形态和组织学结构在基础水平无明显差异(图4),但在ISO处理情况下,转基因小鼠较对照小鼠更容易发生心脏增大(图4A),心脏质量与胫骨长度或体重比值明显增加(图4B和4C),心室壁增厚(图4 D和4E),以及心肌细胞面积增加(图4F和4 G),这些结果表明,与对照小鼠相比,Snhg5转基因小鼠在ISO处理后更容易发生心肌肥厚,提示Snhg5会促进心脏重塑的发生。

图4 Snhg5过表达加重ISO引发的心肌肥厚注:A.心脏大体形态分析;B,C:鼠心脏质量与胫骨长度比值,小鼠心脏质量骨长度比值统计结果,n=5,*P<0.05,**P<0.01,***P<0.0005;D,E:心脏组织切片的H&E和Masson染色结果;F. 心脏组织切片的Laminin免疫荧光染色结果;G. 小鼠心脏切片细胞表面积的统计结果,n=3,*P<0.05Fig.4 Overexpression of Snhg5 aggravates ISO-induced cardiac hypertrophyNote: A. Cardiac gross morphology analysis of different groups of mice; B, C:Ratio of heart weight to tibia length or body weight,n= 5, *P<0.05, **P<0.01, ***P<0.0005; D, E: H&E and Masson staining results of heart tissue sections; F.Laminin immunofluorescence staining of heart tissue sections; G:Statistical results of cell surface area of heart sections, n=3, *P<0.05
3 讨论
转基因技术是将外源DNA导入动物受精卵或胚胎干细胞内,以随机插入或同源重组的方式整合到受体染色体中,并随细胞的分裂而遗传给后代的技术[10],通过该技术为生命科学和医学科学研究提供了一系列理想的疾病模型。随着LncRNA在心脏中功能研究的深入,建立心脏组织特异性LncRNA转基因疾病动物模型对于研究LncRNA在心脏稳态维持中的功能和相关机制非常必要,而目前仅有少量心脏组织特异性LncRNA转基因小鼠模型被报道[11-12]。在前期研究中发现,Snhg5在主动脉结扎手术(TAC)引起的病理性心肌肥厚和心衰小鼠模型心脏组织中表达水平明显升高。为了研究Snhg5在心脏稳态维持中的功能,本研究中利用转基因技术建立了心肌细胞特异性Snhg5转基因小鼠,利用实时定量PCR对不同组织内Snhg5的表达水平进行检测,发现Snhg5只在转基因小鼠心脏中表达水平明显升高,表明该转基因小鼠建立成功,为研究Snhg5在心脏组织中的功能提供了理想的动物模型。
目前关于Snhg5功能的研究大多局限在肿瘤发生发展的过程中。Snhg5在多种癌症中异常表达,影响着肿瘤细胞的增殖、迁移、转移、侵袭、凋亡、细胞周期和自噬等[13]。Snhg5可以作为miRNA的 sponges调控癌症的表型和恶性程度[14]。Snhg5还可以通过调控包括Wnt/β-catenin信号通路在内的一些重要的信号通路,以及调节上皮细胞-间充质转化(EMT)过程[15],从而影响癌症的发生及进展。此外,Snhg5还可作为肿瘤的血清学诊断分子标志物[16]。而迄今为止,关于Snhg5在心脏稳态维持中是否发挥功能尚未见报道。通过对建立的心肌细胞特异性Snhg5小鼠进行表型分析,发现尽管转基因小鼠的心脏组织形态在基础水平与对照小鼠无明显差别,但在特定病理刺激下更容易发生心脏重塑,表明Snhg5过表达会促进心脏重塑。
综上所述,心肌细胞特异性Snhg5过表达转基因小鼠的成功建立不仅有助于揭示Snhg5在心脏稳态维持中的功能,还可能成为研究人类心脏疾病发生机制、开展新药研发及疗效评价的理想动物模型。

