小鼠肺炎病毒RT-PCR方法的建立及在实验动物感染和国际比对样本检测中的应用*
王 吉 王莎莎 王淑菁 李 威 秦 骁 李晓波 付 瑞 岳秉飞 贺争鸣
(中国食品药品检定研究院 国家实验动物微生物遗传检测中心,北京 102629)
小鼠肺炎病毒(pneumonia virus of mice,PVM)属副粘病毒科(Paramyxoviridae)、肺炎病毒属(pneumovirus),核酸型为单股RNA,是啮齿类动物中最常见的病毒之一[1]。PVM 呈世界范围性分布,广泛存在于小鼠和大鼠群中。PVM呈严格的嗜肺性,主要经呼吸道传播。实验动物中自然宿主为小鼠、大鼠、仓鼠、豚鼠等啮齿类动物。兔、猴、黑猩猩和人也能感染。动物感染后表现食欲下降、被毛粗乱、消瘦、呼吸急促等症状, 不仅会对实验动物本身造成危害,还会对吸入毒理学、肺细胞动力学、代谢学以及免疫学等实验研究产生干扰[1-2]。Madarame等[3]从疑似为刺猬摇摆综合征(WHS)的患病非洲刺猬(Atelerixarbiventris)体内检到PVM病原体,说明PVM宿主范围在扩大。
本研究旨在建立简便、快速RT-PCR检测方法,用于小鼠、大鼠、沙鼠等实验动物及其相关样本的快速检测。为实验动物的质量控制及实验动物疾病的快速诊断提供必要、可靠的检测技术手段。
1 材料和方法
1.1 材料
1.1.1病毒及实验动物样本:小鼠肺炎病毒(PVM):美国ATCC(编号:VR-25);汉坦病毒(hantavirus,HV)、淋巴细胞脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)、仙台病毒(sendai virus,SV)、呼肠孤病毒3型(reovirus type 3,Reo3)及不同代次PVM细胞毒:本室保存。5只长爪沙鼠、7只清洁级小鼠肺组织样本:国内某送检单位;9只SPF大鼠、20只SPF小鼠和19只PVM感染SPF小鼠肺组织样本:中国食品药品检定研究院动物生产供应室提供【SCXK(京)2017-0005】【SYXK(京)2017-0013】。本实验按照中国食品药品检定研究院实验动物福利伦理审查委员会的相关规定进行实验,伦理委员会审批号:中检动(福)第2019(A)001。
1.1.2主要试剂及仪器:RNA快速提取试剂盒:德国QIAGEN公司;逆转录试剂盒:Thermo公司;TaqHS酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、10×PCR buffer、100 bp DNA Marker:宝生物工程(大连)有限公司;pGEM T Easy质粒(Promega公司):宝生物工程(大连)有限公司。PCR仪:美国Bio-RAD公司MYCYCLER;核酸琼脂糖凝胶电泳仪:美国Bio-RAD公司PwerPac Basic;凝胶成像分析仪:美国Kodak公司 GL212Pro。
1.2 方法
1.2.1引物的设计及合成:比较分析已报道的不同株PVM G基因序列,根据GenBank中登录的PVM毒株(序列号:AY729016)G基因序列选择保守区域作为靶基因,用Primer Premier 6.0软件设计两组引物,并委托生工生物工程(上海)股份有限公司进行引物合成(表1)。
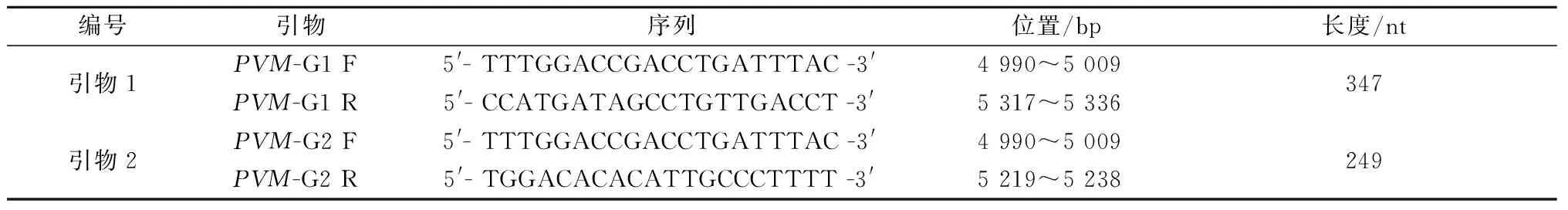
表1 引物序列及位置Table 1 The primer sequence and position
1.2.2毒种的处理:取ATCC PVM毒种用DMEM进行10倍稀释,一部分用于病毒RNA提取,一部分冻存于-70 ℃冰箱保存。
1.2.3病毒RNA提取:取正常BHK21细胞冻存液、10倍稀释ATCC PVM毒种、HV、LCMV、SV、Reo3细胞毒各0.2 mL作为模板,按照RNA提取试剂盒操作方法进行RNA提取。提取的RNA样本立即进行cDNA合成。
1.2.4反转录:通过对随机引物及AMV逆转录酶浓度进行优化,确定反转录体系为:5×RNA PCR Buffer 5 μL、dNTPs Mixture 4 μL、RNase Free dH2O 5.5 μL、随机引物1 μL、RNase Inhibitor 1 μL、 AMV反转录酶0.5 μL、病毒RNA 8 μL,反应条件为:37 ℃ 90 min、42 ℃孵育15 min、95 ℃ 5 min,获得cDNA,保存备用[4-5]。
1.2.5PCR方法反应体系及反应条件的确定:以10倍稀释ATCC PVM毒种 cDNA为模板进行PCR扩增。对2组引物PCR反应体系的10×Buffer浓度、dNTPs浓度、TaqHS酶浓度、引物、模板量,及反应体系的退火温度及循环次数等进行优化,通过对正常BHK细胞、PVM毒种进行PCR扩增来确定RT-PCR反应的最佳反应模式[4-5]。
1.2.6PCR扩增产物的检测:取5 mL 扩增产物于1.5%琼脂糖凝胶(含0.5 μg/mL EB)进行电泳鉴定。电泳缓冲液为1×TAE (0.04 mol/L Tris乙酸,0.001 mol/L EDTA,pH 8.0),110 V电泳40 min,在紫外成像仪下观察PCR产物条带在凝胶中的位置,以100 bp DNA ladder Marker为参照物,判定结果。RT-PCR阳性扩增片段进行测序,通过与GenBank 中PVM序列进行比对以确定PCR检测的准确性[4-5]。
1.2.7特异性试验:用建立的RT-PCR方法同时检测PVM、HV、LCMV、SV、Reo3及BHK21细胞,以验证建立方法的特异性。
1.2.8敏感性试验:(1) PVM病毒浓度梯度检测。取感染滴度为104.75/mL PVM病毒液,用PBS做系列倍比稀释,分设10-1~10-99个不同浓度梯度。取每个稀释度病毒液各0.2 mL制备模板,用所设计的2组引物进行RT-PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳鉴定,确定所能检测病毒最小滴度。
(2)PVM DNA质粒浓度梯度检测。将起始浓度为 8.77×107copies/μL PVM质粒做倍比稀释,分设8.77×107~8.77×100copies/μL 8个不同浓度梯度进行PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳鉴定,确定所能扩增的最小DNA质粒模板浓度。
1.2.9重复性和稳定性试验:将8.77×106~8.77×104copies/μL 3个浓度梯度PVM质粒和同一批PCR检测试剂于-30 ℃冰箱放置12个月后,进行PCR检测。每个浓度梯度质粒各做3个重复。扩增产物经1.5%琼脂糖凝胶电泳鉴定[5]。
1.2.10方法的应用:(1)对日常送检部分小鼠、大鼠和沙鼠的检测。取日常送检的清洁级长爪沙鼠5只、2个品系SPF大鼠9只、4个品系SPF小鼠20只和1个品系清洁级小鼠7只肺组织样本进行研磨,用无菌PBS震荡悬浮,5 000 r/min离心30 min,取上清用引物2建立的方法进行检测。检测的阳性样本,需要进行测序,并将测序结果与GenBank中PVM核酸序列进行比对,以验证检测结果的准确性。送检动物具体信息见表2。

表2 肺组织样本来源动物信息Table 2 The information of testing lung tissue samples
(2)对感染小鼠的检测。用引物2 建立的方法检测人工感染小鼠:为验证方法的可应用性及初步探索PVM对小鼠的感染性,实验通过滴鼻方式人工感染4周龄SPF NIH小鼠19只,剂量为0.06 mL/只。分别于感染后第3、5、7、9、14、18天取小鼠肺组织样本,除第9天取样4只外,其他时间均取样3只。取样结束,对19只人工感染的小鼠肺组织样本进行研磨处理后,用引物2建立的方法检测。取样时间和对应的样本编号信息见表3。

表3 取样时间和对应的样本编号信息Table 3 The information of sampling time and corresponding sample number
(3)可信度验证。用本实验室建立的PVM荧光定量PCR方法,检测19只人工感染小鼠肺组织样本,验证用引物2建立PCR方法的可信度。Q-PCR方法用引物和探针见表4。
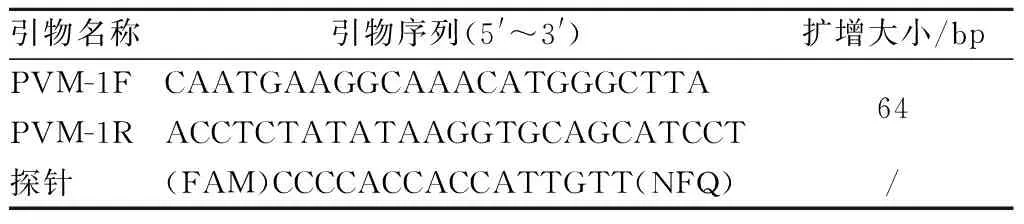
表4 荧光定量PCR方法所用引物和探针Table 4 The primers and probes for fluorescence quantitative PCR method
(4)用于ICLAS国际比对样本的检测。利用引物2建立的方法对2016—2019年连续4年ICLAS组织的国际比对大小鼠易感待检RNA病毒样本和未知RNA或DNA病毒样本进行检测。样本具体信息见表5。

表5 ICLAS诊断实验室能力评估程序样本分布Table 5 ICLAS diagnostic laboratory performance evaluation program specimen distribution
2 结果
2.1 反应体系及反应条件的确定
以10倍稀释ATCC PVM毒种 cDNA为模板用2组引物进行PCR扩增。反应体系为:10×ExTaqBuffer(Mg2+Free) 2 μL, dNTPs Mixture(10 mmol/L)2 μL,TaqHS酶(5 U/μL)0.5 μL,上、下游引物(10 pmol/μL)各1 μL,cDNA 2 μL,补水至20 μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃再延伸5 min。均有明显的目的条带产生(图1和图2)。2组引物扩增产物测序结果与GenBank 中PVM标准株序列进行比对,核苷酸序列同源性均为99%。
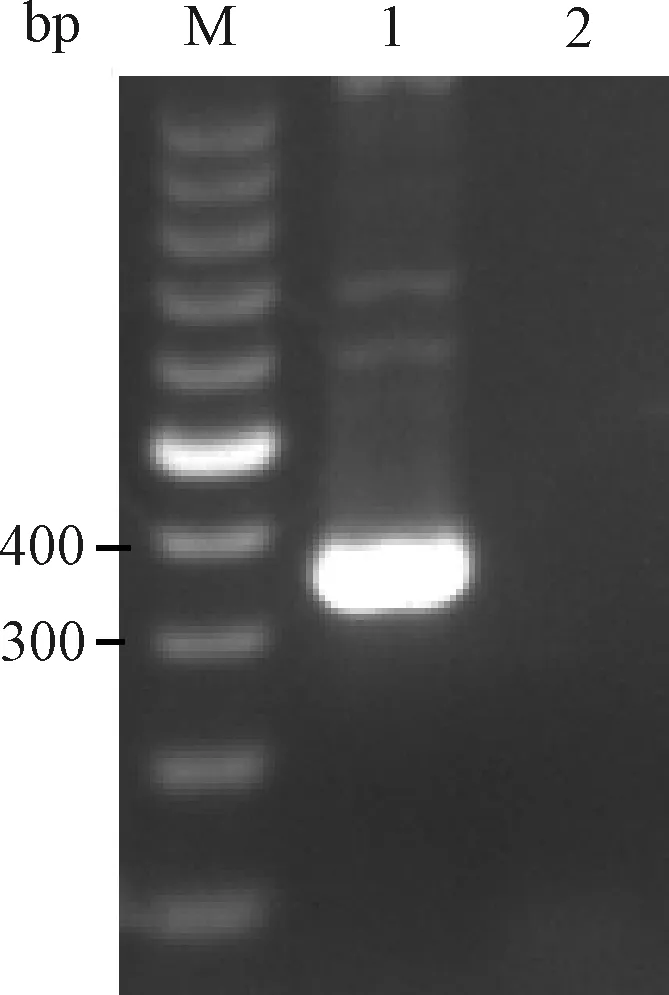
图1 引物1扩增PVM电泳结果M:100 bp DNA marker;1:PVM;2:BHK21细胞Fig.1 The electrophoresis results of primer 1 amplified PVMM:100 bp DNA marker;1:PVM;2:BHK21 cells
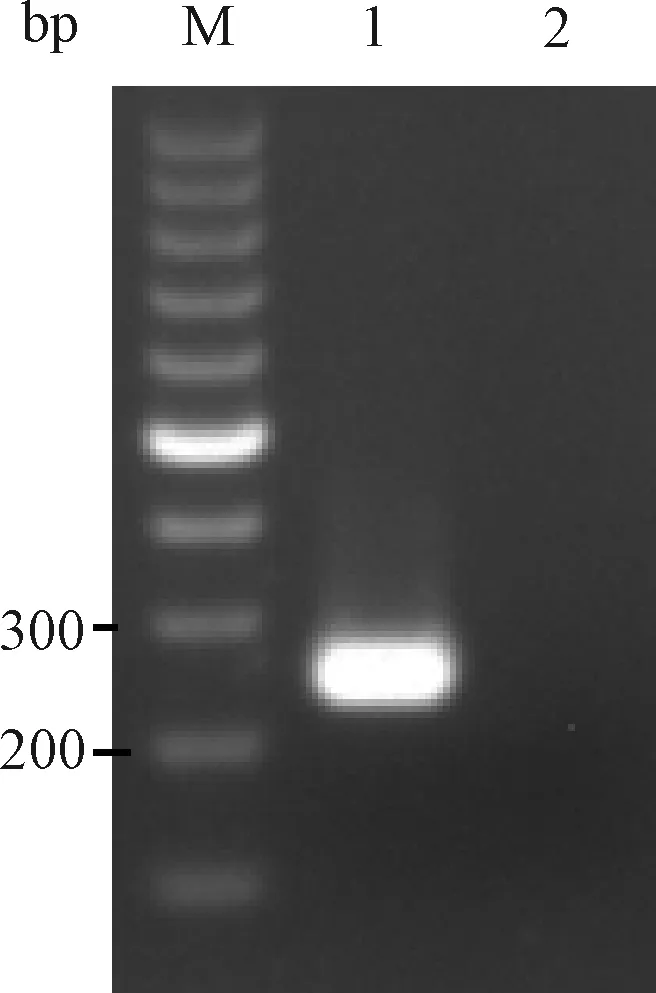
图2 引物2扩增PVM电泳结果M:100 bp DNA marker;1:PVM;2:BHK21细胞Fig.2 The electrophoresis results of primer 2 amplified PVMM:100 bp DNA marker;1:PVM;2:BHK21 cells
2.2 特异性试验
用2组引物同时检测PVM、HV、LCMV、SV、Reo3及BHK21细胞,电泳结果显示除PVM产生目的条带外,其他4种病毒和BHK21细胞均无目的条带产生(图3和图4)。说明2组引物特异性均良好。

图3 引物1特异性试验电泳结果M:100 bp DNA marker;1:PVM;2~6:BHK21细胞、HV、LCMV、SV、Reo3Fig.3 The electrophoresis results of primer 1 specific testM:100 bp DNA marker;1:PVM;2~6:BHK21 cells,HV, LCMV, SV, Reo3
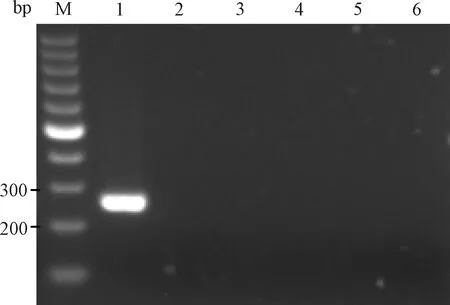
图4 引物2特异性试验电泳结果M:100 bp DNA marker;1:PVM;2~6:BHK21细胞、HV、LCMV、SV、Reo3Fig.4 The electrophoresis results of primer 2 specific testM:100 bp DNA marker;1:PVM;2~6:BHK21 cells,HV,LCMV,SV,Reo3
2.3 敏感性试验
2.3.1PVM病毒浓度梯度检测:用2组引物检测感染滴度为104.75/mL不同浓度梯度的病毒,结果显示引物1和引物2所能检测的最小浓度梯度病毒分别为10-3和10-4(图5和图6)。

图5 引物1病毒浓度梯度检测结果M:100 bp DNA marker;1~9:10-1~10-9浓度梯度病毒Fig.5 The detection results of primer 1 for virus concentration gradientM:100 bp DNA marker;1~9:10-1~10-9 dilution concentration gradient virus

图6 引物2病毒浓度梯度检测结果M:100 bp DNA marker;1~9:10-1~10-9 浓度梯度病毒Fig.6 The detection results of primer 2 for Virus concentration gradientM:100 bp DNA marker;1~9:10-1 ~10-9 dilution concentration gradient virus
2.3.2PVM DNA质粒浓度梯度检测:用2组引物检测8.77×107L~8.77×100copies/μL 8个不同浓度梯度的质粒,结果显示引物1和引物2所能检测到的病毒质粒最小浓度分别为8.77×103copies/μL和8.77×102copies/μL(图7和图8)。
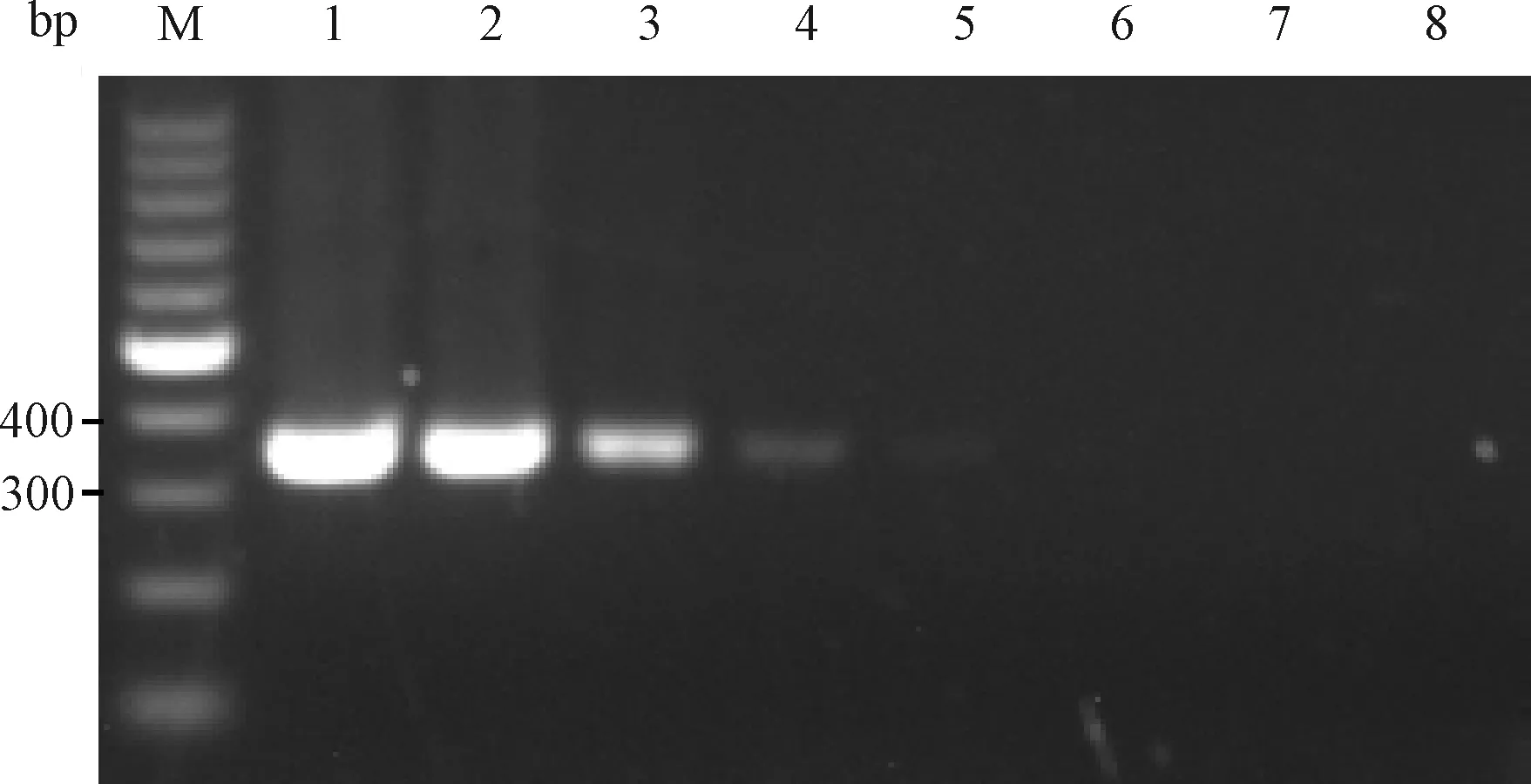
图7 引物1质粒浓度梯度检测结果M:100 bp DNA marker;1~8:8.77×107 ~8.77×100 copies/μL质粒;Fig.7 The detection results of primer 1 for plasmids concentration gradientM:100 bp DNA marker;1~8:8.77×107 ~8.77×100 copies/μLconcentration gradient plasmids
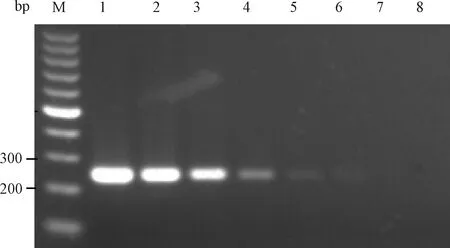
图8 引物2质粒浓度梯度检测结果M:100 bp DNA marker;1~8:8.77×107 ~8.77×100 copies/μL质粒;Fig.8 The detection results of primer 2 for plasmids concentration gradientM:100 bp DNA marker;1~8:8.77×107 L~8.77×100 copies/μL concentration gradient plasmids
通过2组引物病毒浓度梯度和质粒浓度梯度的敏感性检测结果,说明引物2检测灵敏度更高。因此实验选择引物2作为方法建立检测用引物。
2.4 重复性和稳定性试验
用引物2进行重复性和稳定性试验,结果显示引物2上下游引物、检测试剂及8.77×104~8.77×106copies/μL 3个浓度梯度PVM质粒放置于-30 ℃冰箱12个月后,依然能扩增到明显的目的条带(图9)。说明建立的方法重复性良好,稳定性至少可达12个月。
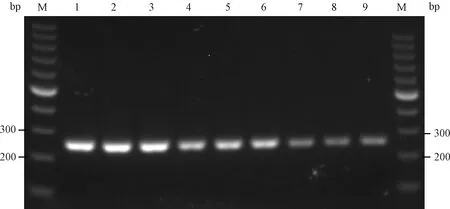
图9 引物2重复性及稳定性试验结果M:100 bp DNA marker;1~3:8.77×106 copies/μL质粒;4~6:8.77×105 copies/μL质粒;7~9:8.77×104 copies/μL质粒Fig.9 The repeatability and stability test results of primer 2M:100 bpDNAmarker;1~3:8.77×106 copies/μL plasmids;4~6:8.77×105 copies/μL plasmids;7~9:8.77×104 copies/μL plasmids
2.5 方法的应用
2.5.1对小鼠、大鼠和沙鼠的检测:用引物2建立的方法检测5只清洁级长爪沙鼠、9只SPF大鼠、20只SPF小鼠和7只清洁级小鼠,电泳结果显示,均无约249 bp目的条带产生。检测结果均为阴性(图10和图11)。

图10 引物2检测5只沙鼠(G1~G5)、7只清洁级小鼠(M1~M7)和5只SPF小鼠(M8~M12)肺组织样本电泳结果M:100 bp DNA marker;1和15:PVM;2和16:BHK21cells;3~7:G1~G5;8~14:M1~M7;17~21:M8~M12;Fig.10 The electrophoresis results of primer 2 for detection lung tissue samples of 5 gerbils(G1~G5),7 clean mice(M1 ~ M7) and 5 SPF mice(M8-M12)M:100 bp DNA marker;1 and 15:PVM;1and 16:BHK21cells;3~7:G1~G5;8~14:M1~M7;17~21:M8~M12

图11 引物2检测15只SPF小鼠(M13~M27)和9只SPF大鼠(R1~R9)肺组织样本电泳结果M:100 bp DNA marker;1~15:M13~M27;16~24:R1~R9Fig.11 The electrophoresis results of primer 2 for detection lung tissue samples of 15 SPF mice(M13-M27)and 9 SPF rats(R1~R9)M:100 bp DNA marker;1~15:M13~M27;16~24:R1~R9
2.5.2对感染小鼠的检测:(1)用引物2建立的PCR方法检测人工感染小鼠结果。对表3中人工感染19只SPF 小鼠进行检测,结果显示IM1、IM2、IM7、IM8、IM10、IM12、IM13号小鼠肺组织有约249 bp明显目的条带产生,电泳结果见图12。7个样本扩增产物测序结果与PVM标准株核苷酸序进行比对同源性均为99%。19只小鼠感染率为36.8%(7/19)。
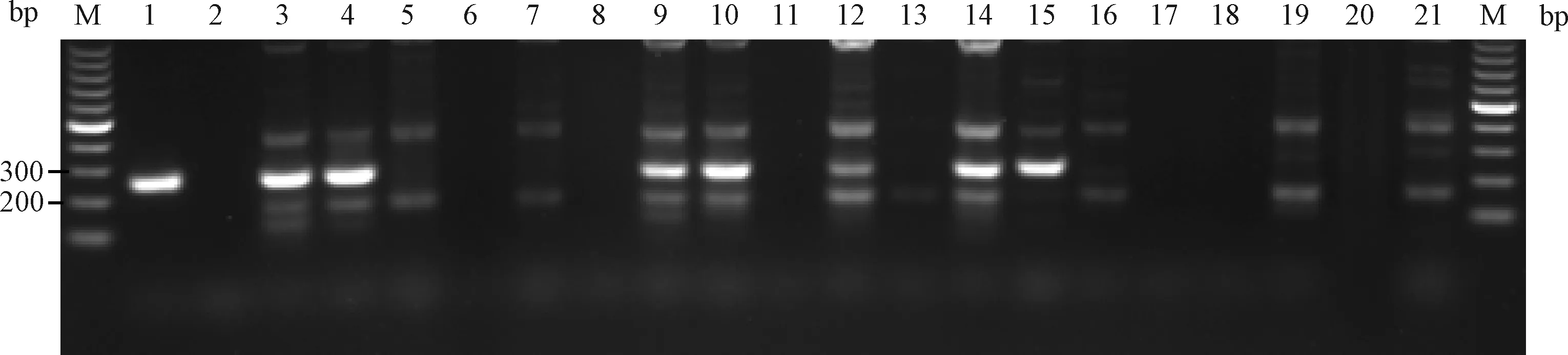
图12 引物2检测19只人工感染小鼠肺组织样本电泳结果M:100 bp DNA marker;1:PVM;2:BHK21 cells;3~21:IM1~IM19;Fig.12 The electrophoresis results of primer 2 for detection 19 lungtissue samples of artificially infected mice(IM1~IM19)M:100 bp DNA marker;1:PVM;2:BHK21 cells;3~21:IM1~IM19
(2)可信度验证。用本研究建立的PVM荧光定量PCR(q-PCR)方法检测表3中人工感染的19只小鼠肺组织样本。在阴阳对照成立的条件下,结果显示有7只小鼠肺组织样本有明显的扩增曲线,PVM核酸阳性,阳性小鼠编号分别为IM1、IM2、IM7、IM8、IM10、IM12、IM13号。其他编号小鼠肺组织样本均无扩增曲线产生,结果均为阴性。19只小鼠q-PCR扩增曲线见图13,结果阳性的7只小鼠肺组织样本检测结果见表6。
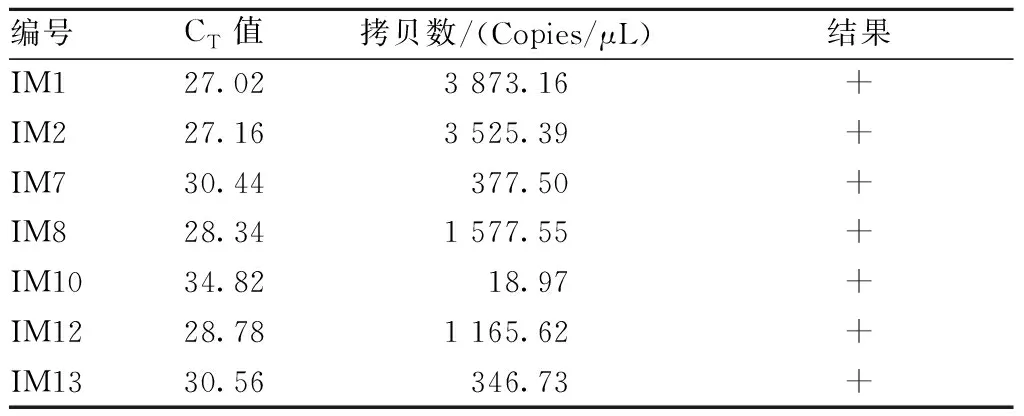
表6 q-PCR检测7只阳性小鼠肺组织样本结果Table 6 The results of q-PCR detection for 7 positive mice lung tissue samples
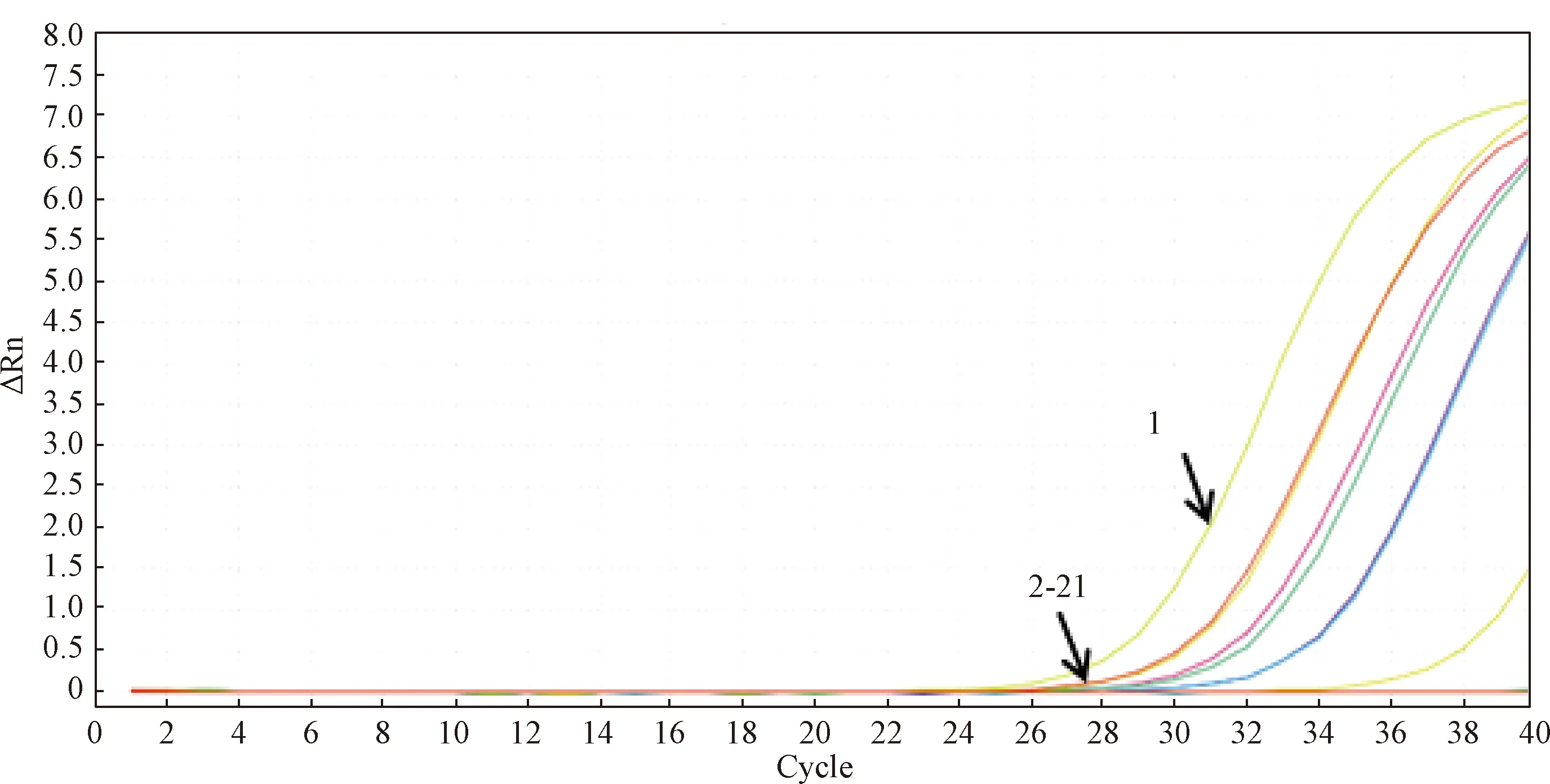
图13 q-PCR检测19只人工感染小鼠肺组织样本扩增曲线图 1:P/C;2-21:N/C 和IM1~IM19Fig.13 The amplified graph of lung tissue samples from 19 artificially infected mice were detected by q-PCR1:P/C; 2-21:N/C 和IM1~IM19
从检测结果看,用引物2建立的PCR方法和本室q-PCR方法同时检测19只人工感染小鼠肺组织样本,IM1、IM2、IM7、IM8、IM10、IM12、IM13结果均为阳性,其他12个样本均为阴性,2种方法检测结果符合率为100%。
2.5.3用于ICLAS国际比对样本的检测:利用建立的方法对2016—2019年连续4年ICLAS组织的国际比对待检RNA病毒样本和待检未知RNA或DNA病毒样本进行检测。结果显示2016—2019年的5个待检RNA病毒样本和2018年的1个待检未知RNA或DNA病毒样本,PVM检测结果均为阴性。电泳结果图均略。
2019年2个RNA病毒样本52-6、52-8经引物2建立的方法检测,电泳结果显示2个样本均有约249 bp目的条带产生,电泳结果见图14。2个样本扩增产物送生工生物工程(上海)股份有限公司进行测序。测序结果通过NCBI BLAST与GenBank 中PVM序列进行比对(图15),结果显示52-8为非特异扩增到的小鼠基因组。52-6样本为特异性扩增,且与GenBank中PVM标准株核苷酸序列同源性为100%。经验证确定52-6样本为小鼠肺炎病毒,与ICLAS预期结果一致。
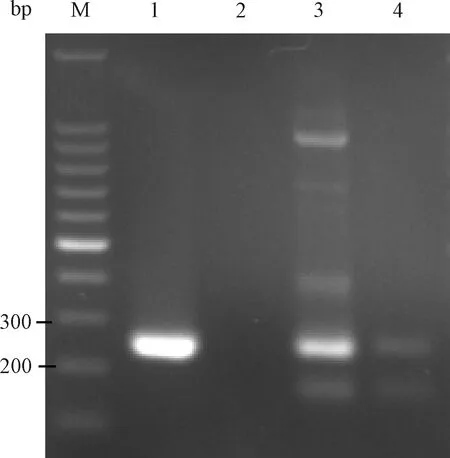
图14 引物2检测ICLAS实验室能力评估样本52-6、52-8电泳结果M:100 bp DNA marker;1:PVM;2:BHK21 cells;3:52-6;4:52-8Fig.14 The electrophoresis results of primer 2 for detection laboratory performance evaluation specimens 52-6 and 52-8 provided by ICLAS
2个样本扩增产物送生工生物工程(上海)股份有限公司进行测序。测序结果通过NCBI BLAST与GenBank 中PVM序列进行比对(图15),结果显示52-8为非特异扩增到的小鼠基因组。52-6样本为特异性扩增,且与GenBank 中PVM标准株核苷酸序列同源性为100%。经验证确定52-6样本为小鼠肺炎病毒,与ICLAS预期结果一致。
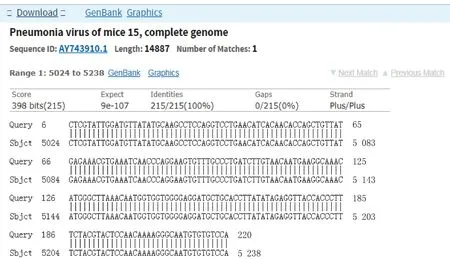
图15 ICLAS能力评估样本52-6扩增产物与PVM标准株比对结果Fig.15 The comparison results of amplification products of ICLAS performanceevaluation specimen 52-6 with PVM standard strains
3 讨论
PVM于1940年由Hor-sfall和Hahn首次分离[7],吴惠英等[8]在我国首次分离得到1株鼠肺炎病毒。PVM在实验小鼠中感染该病毒比较普遍, 美国的实验鼠群中有50%被感染,吴惠英等[8]调查了实验鼠群中PVM抗体, 证实与国外报道一致。赵雅静等[2]对开放饲养鼠群中50份小鼠血清样本行检测,PVM感染率30%;王吉等[9]对2003~2007年我国实验小鼠病毒抗体检测结果进行统计,发现PVM抗体阳性率为0.51%。葛文平等[10]检测不同厂家SPF小鼠,结果显示PVM抗体阳性率为3.125%。吴瑞可等[11]对广东省2014—2016年普通级豚鼠进行病毒抗体监测,发现普通级豚鼠PVM抗体阳性率为20%。以上结果均说明PVM在我国啮齿类实验动物群中依然广泛存在。
同时PVM不仅是实验动物国家标准SPF小鼠、大鼠、豚鼠、地鼠等实验动物及沙鼠地方标准要求的必检项目之一[12-14],也是《中国药典》2020年版 三部“生物制品生产及检定用实验动物质量控制”要求生物制品生产用和检定用SPF小鼠、生物制品生产用SPF地鼠、生物制品生产用长爪沙鼠、生物制品检定用SPF豚鼠要求必须排除的项目[15],而且还是ICLAS国际实验室能力评价大小鼠检测项目范围之内的病毒项目。因此PVM的监测在啮齿类实验动物质量控制中依然重要。
本研究建立的PVM RT-PCR方法特异性试验结果显示与同科的SV和啮齿类实验动物易感的与HV、LCMV、Reo3均无交叉反应;敏感性结果显示检测最小DNA模板浓度可达8.77×102拷贝/μL;稳定性试验结果显示方法稳定性至少可达12个月;说明建立的方法特异、敏感、稳定、可靠。在可应用性方面,(1)用建立的方法检测日常送检测的27只小鼠(7只清洁级小鼠和20只SPF级小鼠)、9只大鼠(SPF级)、5只沙鼠(清洁级)肺组织样本结果均为阴性,实验室同时采用ELISA方法对同41只动物进行PVM抗体检测,结果均为阴性。说明上述动物确实无PVM感染。(2)用建立的方法检测19只滴鼻感染的小鼠,扩增的阳性产物经测序验证证明1、2、7、8、10、12、13号小鼠PVM检测结果为阳性;为验证方法的可信度,以避免假阴性结果的出现,实验同时用q-PCR 方法检测了19只人工感染的小鼠肺组织样本,结果显示2种方法检测结果符合率为100%,说明建立的方法检测结果准确可靠。从检测结果看,动物在感染后第3、7、9天时能从肺组织内检测到病毒,在感染后第5、14、18天未检测到病毒。至于PVM在动物体内感染和存在的规律还有待进一步研究。(3)用建立的方法对2016—2019年ICLAS组织的国际比对大鼠、小鼠易感待检RNA病毒样本和未知RNA或DNA病毒样本进行检测,通过电泳结果及对扩增产物进行测序验证,证明只有2019年52-6样本为PVM,与ICLAS提供的预期结果相符。说明建立的方法特异、敏感、检测结果可靠,可用于动物、动物感染样本和国际比对样本的检测。
PCR技术以其简便、快速、特异、敏感及可通过对产物进行测序验证防止假阳性结果出现的特点,依然是临床检验及实验室检测的一种可靠手段。虽然国内已有PVM核酸检测方法建立的相关报道[16],但均没有推广应用。本研究建立的PVM PCR方法不仅可以作为实验室的技术资源储备用于实验动物监测及相关样本的检测,也为试剂盒的研制及技术的推广应用奠定了基础。

